子宫内膜样腺癌术后再发阴道未分化多形性肉瘤1例及文献分析
韩肖彤 刘 晨 李锐锐 王永军
(北京大学国际医院妇产科,北京 102206)
子宫内膜癌术后复发主要与局部治疗不彻底或首次治疗时已发生治疗范围外的亚临床转移癌,具有肿瘤复发的高危因素如病理分级高、肌层浸润深度深、盆腔及腹主动脉旁淋巴结转移和腹腔冲洗液中有癌细胞等有关[1]。复发部位以局部复发最为常见,其中62%~73%局限在阴道[2]。阴道顶端复发与宫颈受累关系较为密切。阴道或残端复发可有阴道细胞学异常、不规则阴道出血、尿频、排尿排便困难甚至血尿、血便、直肠梗阻等[2]。复发并不一定存在典型的临床症状,术后再出现病灶也不一定是肿瘤复发。判断术后再发病灶究竟是肿瘤复发还是多发肿瘤,需结合病史特点、病理结果等进行综合分析。本文报道1例子宫内膜样腺癌术后再发未分化多形性肉瘤,再次行手术加术后化疗,根据临床病例资料及免疫组化特点,并结合文献对其临床特点、诊断要点及其预后予以探讨。
1 临床资料
患者47岁,主因“子宫内膜癌术后4个月,阴道出血1个月”门诊以“高分化子宫内膜样腺癌ⅠA期术后;阴道残端未分化多形性肉瘤”于2017年10月19日收住院。2017年3月开始阴道淋漓出血,6月13日行B超示宫腔内不均质高回声,内可见较丰富血流信号,当地医院行诊断性刮宫,术后病理子宫内膜复杂性增生伴非典型增生,不除外小区癌变。6月15日行盆腔增强MRI示子宫后壁肌瘤,子宫内膜不厚。血CA125 39.27 IU/ml(正常值≤35 IU/ml)。于6月17日在当地医院行腹腔镜全子宫双附件切除术,术中剖视子宫见:宫腔后壁可见约3 cm×4 cm不规则赘生物,肌层可见侵犯,宫颈管内未见异常。术后病理:高分化子宫内膜样腺癌,癌组织侵犯子宫肌层<1/2肌层。免疫组化:ER(10%+),PR(60%+),CK7(+),CEA(灶+),Vimentin(-),P16(+),P53野生型表达,Ki-67(30%+)。术后1个月于当地三甲医院复查,考虑未行淋巴结切除,7月13日行PET-CT提示阴道残端放射性分布较浓聚,SUVmax约5.0,考虑术后改变(图1)。于8月14日行子宫内膜癌补充手术——腹腔镜盆腹腔淋巴结切除术,术后病理:送检淋巴结未见癌转移(左盆腔0/9,右盆腔0/8,腹主动脉旁0/5)。2017年9月开始阴道出血,略少于月经量,查体见阴道残端1 cm赘生物,活检病理示未分化多形性肉瘤。此后阴道出血淋漓不净,无腹胀、腹痛、恶心、呕吐、尿频、便秘、腹泻等不适。否认家族肿瘤病史。孕1产1。
入院查体妇科检查:阴道残端被一直径9 cm×6 cm×5 cm的肿物占据,表面可见暗红色血迹,盆腔可触及与阴道残端相连的7 cm×6 cm×6 cm包块,质软,活动度差,无压痛。盆腔MRI(10月17日)(图2):原子宫区可见混杂信号肿块影,外周呈等T1稍长混杂T2信号,DWI呈高信号,增强扫描明显异常强化,其内可见片状等T1短T2信号,DWI呈低信号,增强扫描未见强化,大小约6.3 cm×5.5 cm×12.2 cm,边缘毛糙,与膀胱及盆壁之间脂肪间隙存在。阴道B超(10月19日):阴道断端可见低回声包块8.8 cm×5.2 cm×4.7 cm,形态不规则,边界尚清,回声不均匀,可探及血流信号。腹盆部增强CT(10月24日)(图3):阴道断端可见不规则肿块向腹盆腔内生长,呈等低混杂密度,大小约5.7 cm×7.6 cm×7.4 cm,增强扫描肿块周围明显强化,肿块中心呈不规则无强化区,肿块前上部与乙状结肠远端关系密切,前下端与膀胱壁关系密切,腹盆腔未见积液及肿大淋巴结。北京协和医院及我院病理会诊(10月24日):全子宫标本(图4):高分化子宫内膜样腺癌,侵犯浅肌层(<1/2子宫壁),未见脉管侵犯。阴道残端赘生物标本(图5):结合免疫组化符合未分化多形性肉瘤。免疫组化结果:CK7(-),EMA(局灶+),S-100(-),WT1(局灶+),Vimentin(+),CD10(+),Desmin(-),SMA(+),Myogenin(+),H-caldesmon(+),Ki-67(50%+)。未行肠镜检查。
于10月31日在全麻下行开腹阴道残端病灶整体切除+直肠、乙状结肠部分切除吻合术,术中见(图6):阴道残端病灶约8 cm,与膀胱、乙状结肠粘连融合,界限不清,右侧腹膜表面近膀胱处可见直径1 cm的病灶累及,肝、胆、胰、脾、其余肠管、大网膜表面未见明显病灶。腹膜后途径分离阴道残端病灶,见病灶累及部分乙状结肠肠管及膀胱浆膜层。切除腹膜表面受累病灶,沿膀胱表面小心分离病灶,整块切除阴道病灶及周围2 cm的部分阴道。因病灶累及乙状结肠肠管,行肠管部分切除吻合术。手术时间270 min,术中出血1200 ml,输液4840 ml,其中压积红细胞4 U。
术后病理结果(图7):(阴道残端病灶)结合免疫组化,符合未分化多形性肉瘤,肿瘤组织侵出外膜层;可见脉管内瘤栓及神经侵犯;(乙状结肠)肿瘤侵犯肠壁至黏膜下层;肠系膜淋巴结未见肿瘤转移(0/7)。免疫组化染色结果:CK7(-),S-100(部分+),WT1(少量+),CD34(血管+),CD10(部分+),SMA(-),Myogenin(-),Ki-67(热点区约30%+),Desmin(-),CD68(+),ER(-),PR(-),CD99(+)。
术后诊断:未分化多形性肉瘤Ⅲb期;高分化子宫内膜样腺癌ⅠA期。术后3周开始(2017年11月20日~2018年1月17日)行IEP(异环磷酰胺+表柔比星+顺铂)方案静脉化疗3个疗程,具体方案:异环磷酰胺(2 g/d,d1~d3)+表柔比星(90 mg)+顺铂(100 mg)。肿瘤标志物CA125、CA19-9、CEA、AFP、CA15-3术前、术后均正常,CA72-4术前正常,术后第1疗程化疗后升高至28.9 U/ml(正常值≤8.2 U/ml),第2疗程后降至10.6 U/ml。现化疗3个疗程结束,未发现复发、转移征象,拟继续化疗3个疗程。
2 讨论
2.1 子宫内膜癌术后阴道残端肿瘤诊断相关问题
子宫内膜癌复发是指子宫内膜癌经系统的初始治疗完全缓解一段时间后(采用放疗者为3个月,未放疗者为6个月以上),临床又发现新的癌灶,且组织病理类型与原发灶完全一致[3]。未控是指未完成有效治疗或首次治疗后仍有残余肿瘤,包括放疗结束后3个月内原发肿瘤持续存在,或盆腔内出现新病灶;或手术中肿瘤未能切净;或系统性化疗结束后肿瘤病灶仍然存在等。规范性治疗后总复发率为10%~20%,其中治疗后1年内复发者占50%,Ⅰ期复发率约15%[4]。复发的高危因素包括年龄、组织学分级、细胞类型、肿瘤分期、肌层浸润深度、宫颈受累、宫腔受累范围、淋巴血管间隙浸润及肿瘤组织的一些生物学标志(如肿瘤新生血管、激素受体、癌基因、抑癌基因、DNA倍体等)[3]。本例为中年女性,首次手术病理为高分化子宫内膜样腺癌ⅠA期,术中剖视子宫见:宫腔后壁可见约3 cm×4 cm不规则赘生物,肌层可见侵犯,宫颈管内未见异常,阴道断端光滑。病灶距离阴道断端较远,故阴道断端肿瘤残留可能性较小。本例子宫内膜样腺癌期别早,高分化,手术彻底,无淋巴结转移及淋巴血管间隙受累,无附件及宫旁受累,故不存在肿瘤复发的高危因素。但术后3个月即出现阴道出血并发现阴道残端病灶,因有子宫内膜癌病史,首先应考虑肿瘤复发问题。对于子宫内膜癌术后阴道残端复发患者,首选近距离或盆腔外照射放疗,若盆腔瘤灶较大,单纯放化疗很难奏效时,积极彻底的减瘤或许为改善预后的有效手段。但复发病灶多为浸润性生长,而根据影像学表现,该病灶为膨胀性生长,且短时间内迅速增大,提示恶性程度极高。阴道病灶活检及手术切除组织学证实肿瘤为起源于间叶组织的软组织肉瘤,与子宫内膜癌病理不相符,且术中未发现原发肿瘤复发和转移征象,故可以明确并非子宫内膜癌复发或未控,而是与首次子宫内膜样腺癌无关的多发性原发性恶性肿瘤(multiple primary malignant neoplasm,MPMN)。
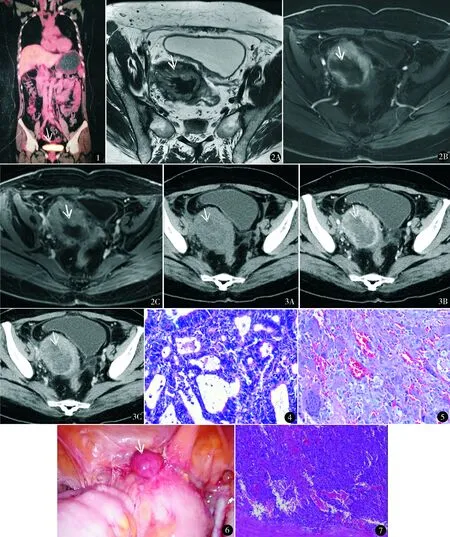
图1 PET-CT提示阴道残端高代谢 图2 MRI轴位T2WI不抑脂序列(A)、增强扫描动脉早期(B)和静脉期(C)示原子宫区混杂信号肿块影 图3 CT轴位平扫(A)、动脉期(B)和静脉期(C)示阴道断端不规则肿块向腹盆腔内生长,呈等低混杂密度 图4 全子宫切除标本病理(HE染色 ×400):高分化子宫内膜样腺癌,腺体不规则,有融合,呈筛状 图5 阴道残端赘生物病理(HE染色 ×200):可见多核巨细胞、较多异型细胞。结合免疫组化符合未分化多形性肉瘤 图6 术中所见(箭头所指及其下方埋在组织中的均为病灶) 图7 阴道残端病灶术后病理(HE染色 ×100):低分化肉瘤,呈实性,细胞异型性大。结合免疫组化,符合未分化多形性肉瘤
MPMN指同一个体的单个或多个器官同时或先后发生2种或2种以上彼此无关的原发性恶性肿瘤,诊断沿用1932年Warren和Cates提出、1979年刘复生[5]补充的标准:每一肿瘤必须是原发的恶性肿瘤并有其特殊的病理形态,排除转移癌,肿瘤发生在不同部位或器官(包括同一器官的不同位置)。Tichansky等[6]认为,第二原发性恶性肿瘤在第一肿瘤治疗后平均5~7年内发生,且间隔时间越短,预后越差。恶性肿瘤治疗后的5年内是复发的高峰期,第二原发性恶性肿瘤发生时间与第一肿瘤复发的时间点基本重合,因此,恶性肿瘤治疗后出现的新癌灶在考虑转移或复发的同时,应注意排除新发生的恶性肿瘤的可能。在临床工作中,MPMN容易与单发原发性恶性肿瘤转移和复发混淆,病理学诊断起着重要的、决定性的作用。根据组织病理类型的不同,诊断MPMN难度不大,但相同病理类型如何与复发、转移相鉴别,需结合病理形态的独特性、临床表现、随访预后及有无癌前病变。
本例阴道残端病灶术后病理结合免疫组化诊断未分化多形性肉瘤。未分化多形性肉瘤(undifferentiated pleomorphic sarcoma,UPS)以往称为恶性纤维组织细胞瘤(malignant fibrous histiocytoma,MFH),起源于间叶组织,是成人较常见的软组织肉瘤,占所有软组织肉瘤的20%~30%[7]。因为其组织学来源及分化方向仍不明确,2002年WHO重新评估和修订了MFH的术语及分类方法[8],以UPS代替了MFH但这种分类方法仍存在争议,根据2013年WHO的最新分类[9],UPS归于未分化/不能分类的肉瘤(undifferentiated/unclassified sarcomas)。
UPS好发于中老年人,高发年龄为50~70岁,男性多于女性,多发生于四肢深部软组织,特别是下肢,尤以大腿多见,其次是腹膜后、躯干等,亦可发生于骨骼、头颈部、胰腺、肝、肾等其他部位。Nakayama等[10]报道,75%的病变位于四肢,90%的病变部位较深,常位于肌肉内。该病临床表现缺乏特异性,恶性度高,复发率高,预后差。
UPS缺乏特异性免疫组化标记,病理主要为排除性诊断。大部分肿瘤对Vimentin、肌动蛋白(Actin)、CD68、α1抗胰蛋白酶(α1-AT)、α1抗胰糜蛋白酶(α1-ACT)呈阳性,少部分对Desmin、角蛋白(Keratin)、S-100、Ki-67、NF蛋白等呈灶性阳性[11],提示肿瘤可能是原始间叶细胞来源,部分具有纤维母细胞及肌纤维母细胞特征,并一定程度表达组织细胞标记。本例阴道残端赘生物表现为异型性显著的高级别肉瘤样结构,无腺体分化特征,且免疫组化不表达上皮标记,ER、PR均为阴性,故考虑并非子宫内膜癌复发,而是新发的未分化多形性肉瘤。
尽管CT、MRI对其检出率几乎达到100%,但是由于影像表现多样,术前常被误诊或不能确诊。影像上呈边界不清的类圆形或不规则团块状影,无明显包膜;肿瘤内常伴渗出、坏死、囊变,病灶实性部分信号混杂,CT呈等低混杂密度;T1WI呈等低信号,T2WI上若瘤体以组织细胞为主,细胞含水量高,则呈高信号,以纤维成分为主则呈等信号;增强扫描肿瘤实性部分呈中度不均匀强化。本例腹盆部增强CT提示阴道断端可见不规则肿块向腹盆腔内生长,呈等低混杂密度,增强扫描肿块周围明显强化,平扫、动脉期及静脉期CT值分别为37、83、75 HU,肿块中心呈不规则无强化区。盆腔MRI提示原子宫区可见混杂信号肿块影,外周呈等T1稍长混杂T2信号,DWI呈高信号,增强扫描明显异常强化,其内可见片状等T1短T2信号,DWI呈低信号,增强扫描未见强化,边缘毛糙。CT及MRI均对病灶有一个较清晰的影像提示,但明确诊断仍需要结合术中所见及术后病理。
2.2 阴道残端肉瘤的治疗
目前多数学者认为[12],MPMN应采取与单发性恶性肿瘤相同的治疗原则,即根据肿瘤的分期、累及的器官及病理类型等,同时结合患者自身条件,尽量采取手术为主,放化疗及生物治疗为辅的综合治疗方案。确诊或高度怀疑为子宫内膜癌的患者首选手术治疗,推荐标准的子宫内膜癌分期手术,即全子宫+双附件+盆腔淋巴结+腹主动脉旁淋巴结切除术[13]。与开腹手术相比,在早期子宫内膜癌的治疗中,腹腔镜手术是安全可行的[14]。目前UPS临床治疗方案很多,主要以手术切除为主,辅助放化疗,但其术后肿瘤复发率及转移率较高,预后较差,早期发现和完整切除肿瘤是必要的。本例先因子宫内膜癌行腹腔镜全子宫+双附件+盆腔淋巴结切除术,术后病理为高分化子宫内膜样腺癌ⅠA期,无需添加辅助治疗;术后阴道残端出现巨大病灶,活检提示低分化肉瘤,存在单发、孤立的巨块型病灶,应先行彻底的减瘤术,故行阴道残端病灶切除+直肠、乙状结肠部分切除吻合术,术后病理提示未分化多形性肉瘤,恶性程度高,预后较差,需加用化疗。子宫肉瘤的术后辅助治疗以化疗为主,选择化疗方案时,单药和联合化疗方案可能均有效,但应综合评估,选择最佳方案。常用的单药化疗药物有多柔比星、表柔比星、顺铂、异环磷酰胺和达卡巴嗪[15]。联合化疗目前尚无理想、统一的方案,尤其对于各种不同组织学亚型,选择何种化疗药物及化疗药物剂量仍有争议。常用的联合化疗方案主要有异环磷酰胺+表柔比星+顺铂、吉西他滨+多西他赛、多柔比星+顺铂+氮烯咪胺、长春新碱+放线菌素D+环磷酰胺、羟基脲+达卡巴嗪+依托泊苷、环磷酰胺+长春新碱+多柔比星+达卡巴嗪等,对于未分化子宫内膜肉瘤,通常认为其对化疗不敏感,辅助化疗用于未分化子宫内膜肉瘤治疗的报道较少,多采用以铂类为主的化疗。Yamagami等[16]对11例接受异环磷酰胺+多柔比星+顺铂化疗的复发性子宫肉瘤的研究显示,反应率为36.4%,疾病控制率为90.9%。本例术后采用异环磷酰胺+表柔比星+顺铂方案,目前仍在化疗中,疗效还有待进一步观察。
2.3 经验教训
MPMN的预后难以统计,受到多种因素的影响。总体来讲,MPMN若能早期发现并进行干预,其预后不一定比单原发癌差[17],甚至明显优于单原发恶性肿瘤的复发或转移。本例初次就诊行子宫内膜活检发现子宫内膜复杂性增生伴非典型增生,不除外小区癌变,行盆腔增强MRI示子宫内膜不厚,但未行宫颈细胞学检测。初次手术仅行全子宫双附件切除,行PET-CT后加做盆腔淋巴结切除术。初次手术后3个月即发现阴道残端病灶并再次手术。是否能早期发现病灶,避免第一次术后短期内再次手术呢?我们可以在以下几方面做出改进:初次就诊最好行宫腔镜检查+子宫内膜活检,可以增加宫腔镜下诊断,亦可以更好地选择活检取材部位,减少漏诊;MRI应提示子宫内膜与肌层之间的子宫结合带是否完整,手术医生应与影像科医生共同阅片,以帮助评估子宫内膜癌期别,从而指导手术方式;术前还应行宫颈细胞学检查。若术前做好更为充分的评估,初次手术即行全子宫双附件+盆腔淋巴结切除术,可以减少手术次数;若先行宫颈细胞学检查,或许有可能在初次手术前发现阴道病变,若行子宫切除时同时切除部分阴道,是否能避免阴道残端病灶出现,还有待进一步研究。
1 王 芳.子宫内膜癌复发的影响因素分析及相应治疗方案.实用癌症杂志,2017,32(5):820-822.
2 Scholten AN,van Putten WL,Beerman H,et al.Postoperative radiotherapy for Stage 1 endometrial carcinoma:long-term outcome of the randomized PORTEC trial with central pathology review.Int J Radiat Oncol Biol Phys,2005,63(3):834-838.
3 熊光武.子宫内膜癌的复发及转移.见:王建六,主编.子宫内膜癌.第2版.北京:北京大学医学出版社,2017.366-403.
4 高 敏,蒋国庆,燕 鑫,等.子宫内膜癌85例临床分析.中国妇产科临床杂志,2008,9(1):16-17.
5 刘复生.多原发癌瘤172例临床病理分析.中华肿瘤杂志,1979,1(2):113-119.
6 Tichansky DS,Cagir B,Borrazzo E,et al.Risk of second cancers in patients with colorectal carcinoids.Dis Colon Rectum,2002,45(1):91-97.
7 汪颖姝,王立峰,刘翠翠,等.常规MRI联合DWI在软组织未分化多形性肉瘤诊断中的价值.河南医学研究,2015,24(10):11-13.
8 Fletcher CD.The evolving classification of soft tissue tumours: an update based on the new WHO classification.Histopathology,2006,48(1):3-12.
9 贡其星,范钦和.WHO软组织肿瘤分类第四版(2013年)的学习体会.临床与实验病理学杂志,2013,29(6):587-590.
10 Nakayama Y,Minagawa N,Torigoe T,et al.Malignant fibrous histiocytoma originating from the mesorectum:a case report.World J Surg Oncol,2011,9(1):15.
11 Patel DP,Gandhi YS,Sommers KE,et al.Primary pulmonary malignant fibrous histiocytoma.Case Rep Pulmonol,2015,3(8):1-5.
12 石 莉,周树林,姜 旖,等.妇科恶性肿瘤相关的多发性原发性恶性肿瘤30例临床分析.中华妇产科杂志,2014,49(3):199-203.
13 张 坤,郭红燕,韩劲松.22例子宫内膜癌复发病例的临床特点分析.中国微创外科杂志,2017,17(6):495-497.
14 王海波,高丽彩,李秀娟,等.腹腔镜与开腹手术治疗肥胖妇女早期子宫内膜癌的对比研究.中国微创外科杂志,2015,15(6):515-517.
15 李鹏飞.60例子宫肉瘤化疗体会.中国伤残医学,2015,23(14):76-77.
16 Yamagami W,Susumu N,Ninomiya T,et al.A retrospective study on combination therapy with ifosfamide,adriamycin and cisplatin for progressive or recurrent uterine sarcoma.Mol Clin Oncol,2014,2(4):591-595.
17 杨建光,李晓霞,孔凡民.多原发癌临床特征分析.现代肿瘤医学,2011,19(12):2551-2553.

