脑胶质瘤放化疗后增强磁共振早期动态变化及其与预后的关系
李运奇,赵智伟
磁共振成像(magnetic resonance imaging, MRI),比如PWI(perfusion-weighted imaging),已经被用于监测肿瘤治疗的效果。采用不同的方法对肿瘤灌注数据进行分析是最近的研究热点。有研究认为基于动态敏感性对比强化(dynamic sensitivity contrast enhancement, DSC)T2加权序列得到的灌注参数,比如相对脑血容量(relative cerebral blood volume, rCBV),可以作为生物标志物预测机体对不同治疗方案的生理反应[1]。在这些研究中,DCE-MRI(dynamic contrast-enhanced magnetic resonance imaging)主要通过计算灌注参数用于评价抗血管生成治疗的效果。容积转运常数(transfer contrast volume,Ktrans)是DCE-MRI示踪动力学中的基本参数,可以评估整个肿瘤的体积大小。肿瘤的异质性是高级神经胶质瘤的一个固有属性,然而Ktrans不能反映胶质瘤的异质性。本研究设计了一个前瞻性的预后研究,通过在患者在放射化疗(temozolomide)过程中监测DCE-MRI相关灌注参数,以12个月PFS(progression-free-survival)为研究终点评估患者预后。此外,作者试图通过基于参数体素映射的方法评估肿瘤组织中灌注相关参数的变化。现报道如下。
1 资料与方法
1.1一般资料回顾分析2014年11月至2016年2月经临床或者病理证实为脑胶质瘤患者15例,男性9例,女性6例,年龄18.22~55.07(40.38 ± 9.11)岁。病理分级全部为Ⅳ级。所有患者的诊断都是根据2016年世界卫生组织(WHO)分类进行确认[2]。所有患者确诊前没有颅外伤史,肿瘤体积不超过5 cm3,没有骨髓抑制,肝功能正常,KPS评分大于60分,入组后接受替莫唑胺口服和放射(60 Gy)联合治疗方案[3]。分别在放化疗开始前(放化疗前1 d)、放疗剂量达到30 Gy后 (放疗第22~24天)、 放疗剂量达到60 Gy后(放疗第42~25天)进行DCE-MRI检查。按照Ktrans和血管外细胞外容积分数(blood vessel extracellullar volume fraction,Ve)值的下降程度把患者分为下降显著组和不显著组,根据放化疗开始后12个月的PFS情况将患者分为治疗有效组和无效组。PFS>12m的为治疗有效组,12个月以内有残留病灶增加>25%或者切除完全后复发患者为无效组。治疗前和治疗后Ktrans和Ve的差值采用△Ktran和△Ve表示。
1.2方法选择西门子1.5T超导MR仪,头部正交线圈,对全部患者实施MRI平扫横断和冠状、矢状扫描。成像方案包括纵向的液体衰减反转恢复成像(TR/TE:9 000/94 ms;TI:2 500 ms;层厚4 mm;FOV:220 mm×220 mm)和对比剂注射前后T1WI的畸变校正(TR/TE279/2.5 ms;层厚4 mm;FOV230 mm×230 mm)。所有DCE-MRI均采用3D快速小角度激发序列获得(参数如下:TR/TE:4/1.4 ms;翻转角:15°;时间分辨率:7 s;基线分辨率128;相位分辨率100%;图层分辨率100%;23 层;层厚4 mm;FOV:220 mm×220 mm;信号收集时间:5 min)。第5个基线数据获得后,钆双胺注射液(Gd-DTPA-BMA,欧乃影,通用电气医疗集团,挪威),通过肘前静脉注射,注射剂量为0.1 mmol·kg-1,速度4 mL·s-1。
1.3数据分析由两位神经系统放疗专家分别对普通的MRI和DCE-MRI进行读片,对患者的进行双盲。所有数据传入Siemens工作站 ,用自带FDA认证的Tissue 4D(Tissue 4D®, Siemens Medical Systems)软件包处理,该软件设计的药代动力学模型是改良的 Tofts-Kermode两室模型。后续处理的软件包括对强化前动态MRI的运动伪影校正和刚体配准,以便图像信号强度转化为钆浓度。通过计算获得基线 T1值,进而计算DCE-MRI图像的T1强化值,获得反映血管通透性的相关参数Ktrans和Ve图像;ROIs区域被自动转移到轴向对比度T1WI成像和Ktrans和Ve参数图中。每个肿瘤术前区域的ROI大小保持不变(半径:4~6 mm)。每个病人测量3次ROIs,选择3次中Ktrans和Ve值最大的。ROI由两位神经系统放射人员分别手工绘制。
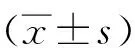
2 结果
2.1患者放化疗前后Ktrans和Ve值的变化图1显示了肿瘤和正常脑白质区的ROIs,肿瘤ROI的中位体积和正常脑白质ROI的中位体积分别为34.3 cm3(体积范围11.3~89.7 cm3)和16.7 cm3(体积范围1.7~28.6 cm3)。放化疗前Ktrans的基线值为0.189±0.061;Ve的基线值为0.24±0.17。放化疗30 Gy后Ktrans和Ve的下降程度(△Ve)最大,分别为(-33.1±60.4)%和(-26.9±31.7)%。在60 Gy后Ktrans下降程度减小,Ve从一开始的下降变为上升,见表1。

图1 在增强MRI T1加权像中描绘的ROI区域

灌注参数Mean±SD值域Ktrans baseline/min-10.19±0.060.07^0.29Ve baseline/%0.24±0.170.10^0.4830 Gy的△ Ktrans/%-33.11±60.40-57.20^78.6330 Gy的△Ve/%-26.92±31.70-50.40^40.0060 Gy的△ Ktrans/%-26.32±62.22-66.11^70.5060 Gy 的△Ve/%22.41±64.44-61.60^85.33
注:Krans:容积运转常数;Ve:血管外细胞外容积分数。
2.2Ktrans和Ve与预后的相关性根据放化疗开始后12个月的PFS情况将患者分为治疗有效组和无效组。PFS>12 m的为治疗有效组,12个月以内有残留病灶增加大于25%或者切除完全后复发患者为无效组。放化疗前有效组Ktrans的基线值为0.142±0.057,Ve的基线值为0.211±0.104;无效组Ktrans的基线值0.183±0.063,Ve的基线值为0.261±0.125;Ktrans和Ve在两组均无统计学差异(P=0.06,P=0.35)。放疗30 Gy 后两组的△Ktrans
和△Ve有统计学差异,P值分别为0.001和0.04。放疗60 Gy后有效组的Ktrans和Ve下降程度减小,并且从一开始的下降变为上升(表2);无效组的Ktrans从一开始的上升变为下降,无效组的Ve从开始的下降变为上升(表2)。Cox单变量分析表明肿瘤大小、肿瘤位置和△Ktrans的情况与生存相关(表3)。Cox比例风险模型多变量分析表明肿瘤位置和放疗60 Gy后的△Ktrans高低是独立的危险因素(P=0.033,P=0.031,表3)。

表2 放化疗中灌注参数在有效组和无效组中的变化
注:①P<0.05。

表3 15例胶质瘤患者不同预后因素对PFS的单因素和多因素分析
注:①P<0.05。HR:hazard ratio;CI:confidence interval。
3 讨论
Ktrans值与肿瘤血流量、渗透率和血容量呈显著正相关[4]。Ktrans的变化可能反映了肿瘤血管壁通透性的变化或血流量的变化[5],但是目前关于Ktrans的变化与放化疗的效果以及预后方面的研究很少。在该项研究中,Ktrans显示其预后价值。治疗早期Ktrans的变化显著,有效组治疗早期Ktrans明显降低,但是紧随其后出现了增加反弹。这种现象反映早期的治疗作用,可以帮助识别肿瘤对放化疗的敏感性,及时停止无效的治疗[5]。该结果与Sorensen的研究结果[6]基本一致。Sorensen等认为,Ktrans是主要反映渗透率的参数。治疗早期Ktrans减少说明了放化疗明显减少了肿瘤血管的灌注,也提示了肿瘤对放化疗的敏感性[7],随后出现的Ktrans增加在后续治疗中意义更大,因为新生血管渗漏明显,Ktrans增加提示肿瘤内部新生血管增加,这可能导致血液灌注增加,从而提高肿瘤区域的氧含量以及化疗药物的浓度[8]。另一方面,适度的灌注减少可以维持肿瘤区域缺氧环境,进而降低放化疗的效果,而过度的灌注减少将导致肿瘤细胞缺血缺氧而死亡[6]。
Ve参数反映了血容量、间质体积以及渗透率和血流情况[4]。Ktrans和Ve与血管系统多个方面的参数密切相关,但是目前还很难解释在治疗过程中Ve随时间变化的原因[9-11]。在这项研究中,回归分析显示Ve的变化不是影响预后的一个独立因素,但在治疗早期Ve的减少在有效组和无效组之间的差别显著(P=0.04),由此作者推测治疗早期Ve的减少对提示治疗效果具有是极其重要的意义。目前,尚没有报道显示Ve在神经胶质瘤治疗过程中的变化情况,作者将本结果与乳腺肿瘤对治疗反应的研究做了比较[12-15]。作者的结果显示治疗中病人出现Ve增加。传统解释是治疗过程中细胞密度降低、间质细胞死亡及溶解所造成的。
总之,本研究结果表明,DCE-MRI在胶质瘤治疗过程中检测到治疗初期Ktrans值的减少,与患者12个月的PFS相关,均已经达到了显著水平。因此,Ktrans可作为预后标记。初始的Ktrans减少被证明是12个月PFS的一个独立预后因素。这有助于判断患者受益于术后放化疗的可能性,并在此基础上进行个体化治疗方案的制定。
参考文献:
[1]Petrilio A,Fusco R,Petrillo M,et al.Standardized Index of Shape (DCE-MRI) and Standardized Uptake Value (PET/CT):two quantitatiVe approaches to discriminate chemo-radiotherapy locally advanced rectal cancer responders undera functional profile[J].Oncotarget,2017,8(5):8143-8153.
[2] Banan R,Hartmann C.The new WHO 2016 classification of brain tumors-what neurosurgeons need to know[J].Acta Neurochir,2017,159(3):403-418.
[3]Stupp R,Mason W,Vandenbent M,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].New Engl J Med,2005,352(10):987-996.
[4]Xie L,Layton A,Wang N,et al.Dynamic contrast-enhanced quantitatiVe susceptibility mapping with ultrashort echo time MRI for evaluating renal function[J].Am J Physiol Renal,2016,310(2):174-182.
[5]Xue W,Du X,Wu H,et al.Aberrant glioblastoma neovascularization patterns and their correlation with DCE-MRI-derived parameters following temozolomide and bevacizumab treatment[J].Sci Rep,2017,7(1):13894-13903.
[6]Sorensen A,Emblem K,Polaskova P,et al.Increased survival of glioblastoma patients who respond to antiangiogenic therapy with elevated blood perfusion[J].Canser Res,2012,72(2):402-407.
[7]Dijkhoff RAP,Beets-Tan RGH,Lambregts DMJ,et al.Value of DCE-MRI for staging and response evaluation in rectal cancer:a systematic review[J].Eur J Radiol,2017,95:155-168.
[8]Hilario A,Sepulveda J,Hernandez A,et al.Leakage decrease detected by dynamic susceptibility-weighted contrast-enhanced perfusion MRI predicts survival in recurrent glioblastoma treated with bevacizumab[J].Clin Transl Oncol,2017,19(1):51-57.
[9]Meyer HJ,Leifels L,Schob S,et al.Histogram analysis parameters identify multiple associations between DWI and DCE MRI in head and neck squamous cell carcinoma[J].Magn Reson Imaging,2017,45:72-77.
[10]Lei J,Tian Y,Zhu SC,et al.Preliminary study of IVIM-DWI and DCE-MRI in early diagnosis of esophageal cancer[J].Eur Rev Med Pharmacol Sci,2015,19(18):3345-3350.
[11]Heye AK,Culling RD,Valdés Hernández Mdel C,et al. Assessment of blood-brain barrier disruption using dynamic contrast-enhanced MRI. a systematic review[J].Neuroimage Clin,2014,6:262-274.
[12]Gaeta M,Benedetto C,Minutoli F,et al.Use of diffusion weighted,intravoxel incoherent motion,and dynamic contrast enhanced MR imaging in the assessment of response to radiotherapy of lytic bone metastases from breast cancer[J].Acad Radiol,2014,21(10):1286-1293.
[13]Fan M,Wu G,Cheng H,et al.Radiomic analysis of DCE-MRI for prediction of response to neoadjuvant chemotherapy in breast cancer patients[J].Eur J Radiol,2017,94:140-147.
[14]Thibault G,Tudorica A,Afzal A,et al.DCE-MRI texture features for early prediction of breast cancer therapy tesponse[J].Tomography,2017,3(1):23-32.
[15]Jena A,Taneja S,Singh A,et al.Role of pharmacokinetic parameters derived with high temporal resolution DCE MRI using simultaneous PET/MRI system in breast cancer:a feasibility study[J].Eur J Radiol,2017,86:261-266.

