山萘酚对HepG2细胞凋亡的影响
,,,,,,,
1.山西医科大学附属第二临床医院消化内科,山西 太原 030001;2.首都医科大学附属北京佑安医院重症肝病科;3.首都医科大学附属北京佑安医院北京市肝病研究所;4.山西省肿瘤医院 山西省肿瘤研究所
【Abstract】ObjectiveTo investigate the effect of kaempferol on the apoptosis of human hepatocellular carcinoma HepG2 cells.MethodsHepG2 cells were incubated with different concentrations of kaempferol for 24 hours to select the best drug concentration (100 μmol/L), and HepG2 cells were incubated at different times. Cell viability was measured by MTT assay; lactate dehydrogenase (LDH) activity in cell supernatants was measured by LDH assay kit; apoptosis was measured by flow cytometry. The expression of apoptosis-related protein was detected by Western blotting.ResultsKaempferol had the induced effect on apoptosis of HepG2 cells in a dose- and time-dependent. When HepG2 cells were treated with kaempferol for 24 hours, the cells viability was gradually decreased and the apoptotic rate was increased gradually with the increase of kaempferol concentrations. Compared with the normal control group, in the 100 μmol/L kaempferol for 24 hours group, the cells survival rate was significantly decreased [(60.58±3.74)%vs(100±2.28)%,P<0.0001], and the apoptotic rate was significantly increased [(16.43±0.07)%vs(0.68±0.09)%,P<0.0001]. The expression of apoptotic factor Cleaved-caspase3 protein was increased with the increase of kaempferol concentrations, HepG2 cells were incubated with kaempferol for 24 hours by Western blotting. When the kaempferol concentration was 100 μmol/L, the apoptotic rate also was increased gradually with the prolongation of time when HepG2
cells were incubated with kaempferol. Compared with the normal control group, in the 100 μmol/L kaempferol for 24 hours group, the cell survival rate was significantly decreased [(59.36±3.09)%vs(100±2.28)%,P<0.0001], and the apoptotic rate was significantly increased [(16.71±1.12)%vs(0.35±0.01)%,P<0.0001]. The expression of apoptotic factor Cleaved-caspase3 was increased with the prolongation of time.ConclusionKaempferol has an induced effect on the apoptosis of human hepatocellular carcinoma cell line HepG2 cells in dose- and time-dependent. It indicats that high concentration of kaempferol could induce the apoptosis of HepG2 cells by promoting the expression of apoptotic factor Cleaved-caspase3, and thus it has the potential effect on anti-hepatocarcinoma activity.
【Keywords】 Kaempferol; HepG2 cells; Cell apoptosis; Mechanism
山萘酚是一种多酚类抗氧化物,为天然黄酮类化合物的一种(化学结构见图1),其主要来源于姜科植物山萘的根茎,中草药淫羊藿、石菖蒲、苦参、山豆根等均含有此成分,同时广泛存在于日常食用的蔬菜、水果当中。山萘酚具有抗氧化、抗炎、抗菌、抗癌、保肝等功效。据研究证实,山萘酚可通过阻碍NF-κB信号通路来抑制炎症因子IL-6、TNF-α的表达,可对因为炎症因子诱发的哮喘、肝细胞炎症等发挥预防及治疗作用;山萘酚具有激活过氧化物酶增殖物激活受体(PPAR-γ)的作用,从而提高胰岛素敏感性,增强葡萄糖储存能力,其中PPAR-γ激动剂已成为脂质代谢异常和2型糖尿病的常用药物,据此推测山萘酚将可能成为治疗糖尿病的临床用药;山萘酚还可提高细胞氧化应激能力,降低活性氧的产生,有显著的抗氧化活性,具有抗心肌细胞缺氧复氧损伤作用。山萘酚不仅有如上作用,还有诱导癌细胞凋亡的功效,据相关研究[5-8]表明,山萘酚有抗胃癌、结肠癌、胰腺癌、肾癌等功能,然而关于山萘酚对肝癌的研究为数甚少且相关机制说法不一。所以本次研究通过体外实验,来探讨山萘酚对于人类肝癌细胞HepG2凋亡的影响,从而为日后山萘酚用于药品研发及肝癌的临床治疗提供实验依据。

图1 山萘酚化学结构Fig 1 The chemical structure of kaempferol
1 材料与方法
1.1材料山萘酚(纯度>95%)、二甲基亚砜(DMSO)、胰蛋白酶购自美国Sigma公司;噻唑蓝(MTT)购自美国Amresco公司;DMEM培养基和胎牛血清(FBS)购自美国Hyclone公司;乳酸脱氢酶(LDH)活力定量检测试剂盒购自普利莱基因技术有限公司;Annexin V-FITC PI双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;ECL化学发光液购自美国Thermo公司;β-actin、Cleaved-caspase3抗体和辣根酶标记兔抗购自美国Cell Signaling Technology公司。
1.2细胞培养人肝癌细胞系HepG2细胞购自美国ATCC公司,于含质量浓度为100 g/L的胎牛血清、100 U/ml青霉素、100 mg/L链霉素DMEM培养基中(孵箱气体体积分数为5%的CO2、温度为37 ℃、饱和湿度)传代培养。
1.3药品配制山萘酚溶于DMSO,配制为5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L的储存浓度。
1.4药物干预取对数生长期的HepG2细胞以1×104/孔接种于96孔板里培养,24 h后换成含有山萘酚浓度分别为5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L的培养基,同时设溶剂对照组(DMSO终浓度为2 g/L)和空白对照组,孵育HepG2细胞24 h。再以浓度为100 μmol/L山萘酚的培养基孵育HepG2细胞3 h、6 h、12 h、24 h。
1.5MTT法检测细胞存活率按上述方法进行细胞培养及药物干预,弃去培养液,每孔加入MTT(0.5 mg/ml)200 μl,继续培养4 h,弃去MTT,每孔加DMSO 150 μl,震荡器震荡10 min,于酶标仪490 mm处波长测定吸光度值(OD值),计算细胞存活率,公式如下:细胞相对存活率(%)=(药物处理组OD值-空白对照组OD值)/(溶剂对照组OD值-空白对照组OD值)×100%。
1.6细胞上清LDH检测按上述方法进行细胞培养及药物干预后,留取细胞上清液,按LDH试剂盒说明书进行操作,酶标仪测定A440值,根据标曲计算细胞上清液LDH活性单位。
1.7流式细胞术检测山萘酚干预HepG2细胞对凋亡的影响细胞培养及药物干预如上,收集细胞上清置于15 ml离心管中,用质量浓度为2.5 g/L的胰酶消化细胞,并将细胞收集于同一离心管中,离心,1 000 r/min,离心半径为5 cm,5 min,弃掉细胞上清,用1×PBS洗涤细胞2次,加入500 μl结合缓冲液,将细胞移入流式管,每管加入5 μl Annexin V-FITC和5 μl PI,避光,室温放置15 min,流式细胞仪进行检测。
1.8蛋白印记法检测Cleaved-caspse3蛋白的表达细胞培养及药物干预如上,弃上清,用1×PBS洗3次,收集细胞于1.5 ml离心管中,每管加入500 μl细胞裂解液(含有蛋白酶抑制剂),-80 ℃与4 ℃之间反复冻融3次,定量后取适量蛋白上样,质量浓度为120 g/L的SDS-PAGE凝胶电泳,转膜(聚偏氟乙烯膜,30 V,4 ℃,过夜),一抗(1∶1 000稀释)4 ℃孵育过夜,TBST漂洗3次,1.5 h,二抗(1∶2 000稀释)室温孵育1 h,TBST漂洗3次,1.5 h。取等量的ECL化学发光试剂A液和B液混匀后孵育聚偏氟乙烯膜,压片曝光。
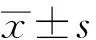
2 结果
2.1山萘酚对HepG2细胞存活率的影响山萘酚作用于HepG2细胞24 h后,5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L山萘酚组细胞的存活率分别为(103.12±3.53)%、(94.87±5.34)%、(86.73±7.67)%、(75.23±6.98)%、(60.58±3.74)%。其中浓度为50 μmol/L、100 μmol/L组细胞存活率与空白对照组(100±2.28)%相比,差异有统计学意义(P<0.05,见图2A)。山萘酚浓度为100 μmol/L作用于HepG2细胞3 h、6 h、12 h、24 h后细胞存活率分别为(104.73±3.84)%、(87.58±6.98)%、(74.68±5.41)%、(59.36±3.09),12 h、24 h药物处理组与空白对照组相比,差异有统计学意义(P<0.05)(见图2B)。

图2 山萘酚对HepG2细胞生存率的影响
A:不同浓度山萘酚作用于HepG2细胞对其生存率的影响;B:浓度为100 μmol/L的山萘酚作用不同时间对HepG2细胞生存率的影响
Fig2TheeffectsofkaempferolonthesurvivalrateofHepG2cells
A: the effects of different concentrations of kaempferol on the survival rate of HepG2 cells; B: the effects of kaempferol at the concentration of 100 μmol/L on the survival rate of HepG2 cells at different time
2.2山萘酚对HepG2细胞上清LDH活性的影响山萘酚5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L孵育HepG2细胞24 h后,细胞上清LDH活性单位分别为(198.4±10.35)U、(368.71±4.69)U、(392.36±3.97)U、(432.46±11.82)U、(471.37±8.16)U,除了浓度为5 μmol/L组,其余各组与空白对照组(213.7±10.89)U两两相比,差异均有统计学意义(P<0.05)(见图3A)。浓度为100 μmol/L的山萘酚作用于HepG2细胞3 h、6 h、12 h、24 h后,细胞上清LDH活性单位分别为(228.03±17.71)U、(231.52±18.13)U、(312.52±18.79)U、(429.76±12.76)U。其中12 h、24 h与空白对照组(165.62±12.28)U比较,差异有统计学意义(P<0.05)(见图3B)。
2.3山萘酚对HepG2细胞凋亡率的影响不同浓度的山萘酚作用于HepG2细胞24 h后均能诱导细胞凋亡,其中浓度为100 μmol/L山萘酚干预组细胞凋亡率为(16.43±0.07)%,显著高于空白对照组(0.68±0.09)%,差异有统计学意义(P<0.0001);山萘酚浓度为100 μmol/L,作用时间3 h、6 h、12 h、24 h细胞凋亡率分别为(5.23±0.08)%、(7.41±0.01)%、(11.9±0.95)%、(16.71±1.12)%,与空白对照组(0.35±0.01)%相比,差异有统计学意义(P<0.05)(见图4)。
2.4山萘酚诱导HepG2细胞凋亡对Cleaved-caspase3蛋白的影响蛋白印迹法检测凋亡标志性蛋白Cleaved-caspase3的表达,实验以β-actin为内参。结果证实,当山萘酚作用于HepG2细胞24 h后,随着山萘酚浓度的升高,凋亡蛋白Cleaved-caspase3表达增加(见图5A);当使用浓度为100 μmol/L山萘酚干预HepG2细胞时,凋亡蛋白Cleaved-caspase3的表达随着作用时间的延长表达也增加(见图5B)。

图3 山萘酚对HepG2细胞上清LDH酶活性影响
A:不同浓度山萘酚作用于HepG2细胞对其细胞上清LDH酶活性的影响;B:浓度为100 μmol/L的山萘酚作用不同时间对HepG2细胞上清LDH酶活性的影响
Fig3TheeffectsofkaempferolonLDHenzymeactivityinHepG2cellssupernatant
A: the effects of different concentrations of kaempferol on LDH enzyme activity in HepG2 cells supernatant; B: the effects of kaempferol at the concentration of 100 μmol/L on LDH enzyme activity in HepG2 cells supernatant

图4 山萘酚对HepG2细胞凋亡率的影响
A~B:不同浓度山萘酚作用于HepG2细胞间对其细胞凋亡率的影响;C~D:浓度为100 μmol/L的山萘酚作用不同时间对HepG2细胞凋亡率的影响
Fig4TheeffectsofkaempferolonapoptoticrateofHepG2cells
A-B: the effects of different concentrations of kaempferol on the apoptotic rate of HepG2 cells; C-D: the effects of kaempferol at the concentration of 100 μmol/L on the apoptotic rate of HepG2 cells at different time
3 讨论
肝癌是全世界最常见的恶性肿瘤之一,在我国常见恶性肿瘤中目前排第4位,肿瘤致死病因排第3位,严重危害人类生命健康[9-10]。在中医范畴中,肝癌可根据其临床表现归属为“症瘕”、“积聚”、“鼓胀”,而现代中医药可治疗轻型症状,改善生命质量,延长生存时间,缓解毒副作用,在临床上已成为不可或缺的治疗手段。

图5 山萘酚作用于HepG2细胞对其凋亡蛋白Cleaved-caspase3表达的影响
A:不同浓度山萘酚作用于HepG2细胞对其凋亡蛋白
Cleaved-caspase3表达的影响;B:浓度为100 μmol/L的山萘酚作用不同时间对HepG2细胞凋亡蛋白Cleaved-caspase3表达的影响
Fig5TheeffectsofkaempferolontheexpressionofapoptosisproteinCleaved-caspase3inHepG2cells
A: the effects of different concentrations of kaempferol on the expression of apoptosis protein Cleaved-caspase3 in HepG2 cells; B: the effects of kaempferol at the concentration of 100 μmol/L on the expression of apoptosis protein Cleaved-caspase3 in HepG2 cells at different time
山萘酚是一种黄酮类化合物,具有广泛的生物学作用。近年来,关于山萘酚抗癌方面的大量研究证实了一定浓度的山萘酚可通过不同的机制抑制结肠癌、胃癌[6]、胆管癌[7]、口腔癌[11]等癌细胞增殖转移、侵袭扩散,并促进癌细胞凋亡。如QIN等[7]研究表明,山萘酚影响PI3K/AKT信号通路从而抑制胆管癌细胞增殖代谢并诱导癌细胞凋亡;HUNG等[8]发现,山萘酚可以通过下调AKT/FAK信号通路来抑制肾癌细胞的增殖和转移,从而预防癌细胞侵袭扩散。通过本次实验的研究,结果表明,山萘酚能够以剂量和时间依赖的方式诱导人类肝癌细胞系HepG2细胞凋亡,其作用机制是高浓度的山萘酚诱导凋亡因子Cleaved-caspase3表达,从而促使癌细胞凋亡。
凋亡自古谓之大量减少,据《陈书·世祖纪》记载:“自丧乱以来,十有馀载,编户凋亡,万不遗一,中原氓庶,盖云无几。”现代医学定义细胞凋亡具体指由基因介导的程序性死亡,此过程可清除衰老和异常的细胞,从而维持细胞内环境稳态。Caspase家族是含半胱氨酸的天冬氨酸蛋白水解酶[12],Caspase3是蛋白Caspase家族中重要的一员,Cleaved-caspase3是Caspase3的激活体,主要参与调控细胞凋亡及炎症过程。当凋亡发生时,各个凋亡信号通路最终激活Caspase3,从而诱导细胞凋亡。
本次实验结果不仅表明山萘酚具有诱导肝癌细胞HepG2凋亡的作用,同时证实了单体山萘酚主要依赖药物剂量诱导肝癌细胞凋亡。早期研究[13]证实,低浓度0.01、0.1 μmol/L山萘酚可以抑制正常肝细胞7702内质网应激所诱导的CHOP蛋白表达,减少细胞凋亡。当浓度增至1.00 μmol/L时,山萘酚对CHOP蛋白表达的抑制作用不显著,且会产生细胞损伤作用。另一项研究[14]采用5~100 μmol/L的山萘酚孵育HepG2细胞24 h,用MTT法检测药物毒性,发现当药物浓度<20 μmol/L时对细胞活性无显著影响,但随着药物浓度增高,所产生的细胞毒性增强。同样,本实验结果也验证了以上结论,当浓度为5 μmol/L时,山萘酚对细胞具有保护作用,与正常组相比,细胞活性增高且细胞上清LDH含量有所下降;当浓度为100 μmol/L时,山萘酚对细胞的毒性作用明显增强,促进了细胞凋亡,显著降低了细胞活性,增加了细胞上清LDH含量,且诱导凋亡相关蛋白Caspase3表达。同时随着山萘酚浓度的增加,细胞活性降低,凋亡率升高,表明山萘酚随浓度的升高,药物毒性逐渐增加。随后选取高浓度山萘酚孵育HepG2细胞,发现随着时间的延长,药物毒性增加,细胞活性逐渐下降,凋亡率增高,凋亡相关蛋白Cleaved-caspase3表达增强。本实验结果表明,低浓度山萘酚对细胞可起到保护性作用,而高浓度山萘酚产生细胞毒性会诱导细胞损伤及凋亡,同时在高浓度状态下,山萘酚孵育时间的延长对细胞的损伤会增加。
在本实验中,我们研究了山萘酚对于人类肝癌细胞凋亡的影响,结果发现,山萘酚以剂量-时间依赖性诱发肝癌细胞凋亡。经山萘酚处理的肝癌HepG2细胞,随着药物浓度增加和孵育时间延长导致凋亡因子Cleaved-caspase3的表达逐步增强,表明山萘酚诱导肝癌HepG2细胞凋亡与提高Caspase3活性和药物高浓度密切相关。研究后期可通过体内试验进一步验证山萘酚诱导肝癌细胞凋亡作用,为山萘酚的研究开发及临床应用提供实验基础,并为肝癌的治疗提供更多的选择。
[1] CHEN A Y, CHEN Y C. A review of the dietary flavonoid, kaempferol on human health and cancer chemoprevention [J]. Food Chem, 2013, 138(4): 2099-2107. DOI: 10.1016/j.foodchem.2012.11.139.
[2] 周运江, 王虎, 李丽, 等. 山柰酚对脂多糖诱导的肥大细胞炎症反应的抑制作用[J]. 药学学报, 2015, 50(6): 702-707. DOI: 10.16438/j.0513-4870.2015.06.018.
ZHOU Y J, WANG H, LI L, et al. Inhibitory effect of kaempferol on inflammatory response of lipopolysaccharide-stimulated human mast cells [J]. Acta Pharmaceutica Sinica, 2015, 50(6): 702-707. DOI: 10.16438/j.0513-4870.2015.06.018.
[3] 吴巧敏, 金雅美, 倪海祥. 山萘酚对2型糖尿病大鼠慢性并发症相关因子的影响[J]. 中草药, 2015, 46(12): 1806-1809.
WU Q M, JING Y M, NI H X. Effect of kaempferol on correlation factors of chronic complications of type 2 diabetic rats [J]. Chinese Traditional and Herbal Drugs, 2015, 46(12): 1806-1809.
[4] 汤喜兰, 刘建勋, 李澎, 等. 山萘酚和槲皮素对乳鼠心肌缺氧复氧及过氧化损伤的保护作用[J]. 中药药理与临床, 2012, 28(1): 56-59. DOI: 10.13412/j.cnki.zyyl.2012.01.022.
TANG X L, LIU J X, LI P, et al. Protective effects of kaempferol and quercetin on hypoxia/reoxygenation and peroxidation injury in neonatal cardiomyocytes [J]. Pharmacology and Clinics of Chinese Materia Medica, 2012, 28(1): 56-59. DOI: 10.13412/j.cnki.zyyl.2012.01.022.
[5] LEE H S, CHO H J, YU R, et al. Mechanisms underlying apoptosis-inducing effects of Kaempferol in HT-29 human colon cancer cells [J]. Int J Mol Sci, 2014, 15(2): 2722-2737. DOI: 10.3390/ijms.15022722.
[6] SONG H, BAO J, WEI Y, et al. Kaempferol inhibits gastric cancer tumor growth: An in vitro and in vivo study [J]. Oncol Rep, 2015, 33(2): 868-874. DOI: 10.3892/or.2014.3662.
[7] QIN Y, CUI W, YANG X, et al. Kaempferol inhibits the growth and metastasis of cholangiocarcinoma in vitro and in vivo [J]. Acta Biochim Biophys Sin (Shanghai), 2016, 48(3): 238-245. DOI: 10.1093/abbs.gmv.133.
[8] HUNG T W, CHEN P N, WU H C, et al. Kaempferol inhibits the invasion and migration of renal cancer cells through the downregulation of AKT and FAK pathways [J]. Int J Med Sci, 2017, 14(10): 984-993. DOI: 10.7150/ijms.20336.
[9] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262.
[10] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338.
[11] LIN C W, CHEN P N, CHEN M K, et al. Kaempferol reduces matrix metalloproteinase-2 expression by down-regulating ERK1/2 and the activator protein-1 signaling pathways in oral cancer cells [J]. PLoS One, 2013, 8(11): e80883. DOI: 10.137/journal.pone.0080883.
[12] MCLLWAIN D R, BERGER T, MAK T W. Caspase functions in cell death and disease [J]. Cold Spring Harb Perspect Biol, 2013, 5(4): a008656. DOI: 10.1101/cshperspect.a008056.
[13] 郭媛媛, 任锋, 张向颖, 等. 山萘酚对内质网应激诱导的肝细胞损伤的保护及机制[J]. 世界华人消化杂志, 2014, 22(35): 5400-5407.
GUO Y Y, REN F, ZHANG X Y, et al. Protective effect of kaempferol on endoplasmic reticulum stress-induced hepatocyte apoptosis and underlying mechanism [J]. World Chinese Journal of Digestology, 2014, 22(35): 5400-5407.
[14] GUO H, LIN W, ZHANG X, et al. Kaempferol induces hepatocellular carcinoma cell death via endoplasmic reticulum stress-CHOP-autophagy signaling pathway [J]. Oncotarget, 2017, 8(47): 82207-82216. DOI: 10.18632/oncotarget.19200.
doi:10.3969/j.issn.1006-5709.2018.06.006

