蛋清酶解多肽的制备及其清除自由基活性
吴烨婷,黄慧娜,施宝珠,刘 琪,侯盼盼,段旭昌
(西北农林科技大学食品科学与工程学院,陕西杨陵 712100)
自由基是生物体氧化反应过程中产生的对机体有害的一类化合物,具有强氧化性,可损害机体组织和细胞,促进机体衰老,引起机体产生慢性疾病[1]。研究表明鸡蛋中的蛋白多肽负离子能够消减人体自由基,减缓人体衰老,增强人体免疫力[2]。
蛋清是一种天然蛋白,其功能被认为与人血血浆蛋白相似,蛋清中的卵白蛋白[3]、溶菌酶[4]等具有天然抗氧化活性,蛋清经酶水解可明显提高蛋清的抗氧化活性,水解的多肽产物具有清除多种自由基能力,产生抗氧化性[5]、抑菌性[6-8]、抗肿瘤等多种活性功能[9-12]。
为了提高鸡蛋附加值,开拓蛋品资源加工新途径,鸡蛋多肽的研究已成为蛋品加工的一大热点。蛋清多采用酶解法来制备蛋清多肽,制备的蛋清多肽分子质量小,益于消化吸收[13-14],并具有多种保健功能。酶解法较酸、碱水解法不仅水解效率高,而且条件温和,可较好的保留蛋清的营养成分[15],且水解程度易于控制,能较好的得到人们所需的水解多肽。
但目前关于蛋白的人工控制定向水解以获得人们所需的功能多肽的研究尚处于起步阶段,有许多问题需要探索。本研究以全蛋清为试材,采用碱性蛋白酶、胰蛋白酶、中性蛋白酶,通过控制蛋白的水解条件从而控制蛋白水解程度,以DPPH自由基清除率为指标,建立蛋清蛋白水解程度与抗氧化之间的控制关系,研究了蛋清抗氧化肽的制备方法,以获取最强和最大量的蛋清抗氧化肽的制备控制条件,并探讨了所制备的蛋清抗氧化肽的体外清除自由基能力和抗氧化活性,以期为鸡蛋功能性产品开发提供一定的技术和理论支持。
1 材料与方法
1.1 材料与仪器
鲜鸡蛋 格润牧业发展有限公司提供;碱性蛋白酶(酶活为170000 U/g)、胰蛋白酶(酶活为250000 U/g) 美国AMRESCO公司;中性蛋白酶(酶活为60000 U/g) 北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 东京化成工业株式会社;预染蛋白Marker#26617 上海新睿生物科技有限公司。
UV-2550型紫外可见分光光度计 日本岛津公司;HH-4恒温水浴锅 北京科伟永兴仪器有限公司;HC-3018高速离心机 广州越特科学仪器有限公司;DYCZ-24双垂直电泳仪 北京六一生物科技有限公司;LGJ-100型冷冻干燥机 北京四环仪器公司;电子分析天平 上海天平仪器厂;SEM6360LV扫描电镜 日本电子株式会社。
1.2 实验方法
1.2.1 工艺流程 鲜鸡蛋→分离→蛋清→调整蛋清浓度→热变性→调pH→加酶→恒温酶解→灭酶→离心→酶解上清液→浓缩→冷冻干燥
1.2.2 操作要点 将蛋清液的蛋白浓度调整至所需浓度,经85 ℃加热10 min使蛋清蛋白变性,然后冷却至所需温度,用1 mol/L HCl或1 mol/L NaOH溶液调整溶液pH至各蛋白酶的最适pH,加入一定量蛋白酶恒温搅拌控制酶解,酶解完成后将酶解液95 ℃灭酶10 min,冷却至室温,于5000 r/min离心10 min,上清液即为蛋清蛋白酶水解多肽制备液,经40 ℃真空浓缩,-80 ℃冷冻干燥24 h即得蛋清多肽制品。
1.2.3 酶的选择方法 以3%(m/V)蛋白浓度的蛋清液为底物溶液,分别采用碱性蛋白酶、胰蛋白酶、中性蛋白酶,在酶用量均为12000 U/g蛋白条件下,分别在各酶最适工作条件下进行酶解1、2、3、4、5、6、7 h,以各酶酶解上清液水解度和清除DPPH自由基能力为考察指标,以清除DPPH自由基能力最高者筛选蛋清多肽制备的最佳水解酶。各酶对蛋清的水解进程和水解效果采用SDS-PAGE凝胶电泳进行追踪。其中碱性蛋白酶工作条件是pH9.0,温度45 ℃;中性蛋白酶工作条件是pH7.0,温度40 ℃;胰蛋白酶工作条件是pH7.8,温度37 ℃。
1.2.4 蛋清多肽制备工艺优化方法
1.2.4.1 单因素实验 取一定体积的蛋白底物浓度为3 g/100 mL(m/V)的蛋清液,分别用12000、14000、16000、18000、20000 U/g蛋白的碱性蛋白酶,在pH9.0,45 ℃,水解7 h,考察酶用量对水解液清除DPPH自由基能力的影响,以清除能力最强者优选酶用量;以酶用量为18000 U/g蛋白,在pH9.0、温度45 ℃,分别以蛋清蛋白底物浓度为2、2.5、3、4、5 g/100 mL(m/V)进行水解7 h,以考察蛋白底物浓度对水解液清除DPPH自由基能力的影响,以清除能力最强者优选蛋清蛋白底物浓度;以酶用量为18000 U/g蛋白、蛋白底物浓度为3 g/100 mL,在45 ℃,分别在pH8、9、10、11、12条件下水解7 h,以考察水解pH对水解上清液清除DPPH自由基能力的影响,以清除能力最强者优选水解pH;以酶用量为18000 U/g蛋白、底物浓度为3 g/100 mL,调pH9.0,分别在35、45、55、65、75 ℃水解7 h,以考察水解温度对水解上清液清除DPPH自由基能力的影响,以清除能力最强者优选水解温度。
1.2.4.2 正交实验 在单因素实验基础上,采用L9(34)正交表进行正交实验,其因素水平如表1所示。以水解上清液对DPPH自由基清除率为衡量指标,以清除率最高者确定蛋清酶解多肽制备的工艺条件。
1.2.5 蛋清酶解多肽体外抗氧化实验 以VC作为对照,以蛋清冻干粉、制备蛋清多肽粉为实验材料,分别配制成2、4、6、8、10 mg/mL溶液,测定各溶液对DPPH自由基、超氧阴离子、羟自由基的清除能力及Fe3+还原能力,分析蛋清多肽体外清除自由基的能力。
1.2.6 检测方法
1.2.6.1 蛋白水解度测定方法 参照文献[16]的茚三酮比色法。取0.5 mL水解蛋白液稀释至50 mL,量取0.4 mL于试管中,同时加入1.6 mL蒸馏水和1 mL显色剂,混匀后置于沸水浴中加热15 min,显色结束后冷水冷却,再加入5 mL 40%乙醇溶液混匀后放置15 min,然后于570 nm处测定吸光值。根据标准曲线(y=0.03816x-0.01081,R2=0.998)计算出蛋白水解液中-NH2基的含量(mmol/L)。根据下式计算出水解度:
水解度(%)=[(水解后-NH2-水解前-NH2)/(6.25N×htot)]×100
式中:6.25 N为水解底物蛋白质质量浓度(g/L);htot为每克蛋白质中肽键总数,mmol/g,本研究中htot=9.1438。
1.2.6.2 电泳分析 参照曹健[17]的方法进行。标准蛋白加样量3 μL,待测样品加样量20 μL。先在15 mA左右的电流下电泳,待样品进入分离胶后,再将电流调整至80 V左右,直至溴酚蓝指示带接近胶底1 cm时,停止电泳。小心将凝胶取下,置于染色容器中染色2 h,即可脱色,待条带清晰后于凝胶成像系统上记录实验结果。
1.2.6.3 蛋清水解效果观测方法 将蛋清冻干粉、蛋清多肽冻干粉及蛋清水解沉淀物冻干粉,用导电双面胶固定在扫描电子显微镜载物台上,用洗耳球吹去粘结不牢的粉末,在真空喷金机上喷金后,用扫描电子显微镜观察其微观结构并拍照,比较酶解前后蛋清蛋白结构变化情况。
1.2.6.4 DPPH自由基清除能力测定方法 参照Shahidi F[18]的方法。取2 mL样品溶液及2 mL 0.1 mmol/L DPPH乙醇溶液(现配)于试管中,混匀后室温避光放置30 min,于517 nm波长下测定吸光值。以VC为对照,平行测定3次,清除率按下式计算:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为蒸馏水代替样品的空白吸光值;A1为样品的吸光值;A2为无水乙醇代替DPPH溶液的对照吸光值。
1.2.6.5 超氧阴离子清除能力测定方法 参照朴美子[19]的方法进行。取4.5 mL pH8.2的Tris-HCl缓冲液于试管中,25 ℃温浴20 min,加入1 mL样品溶液和0.5 mL 4.5 mmol/L邻苯三酚溶液,混匀,25 ℃保温6 min,加入两滴8 mol/L HCl终止反应,于320 nm波长下测定吸光值。以VC为对照,平行测定3次,清除率按下式计算:
超氧阴离子清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为蒸馏水代替样品溶液的空白吸光值;A1为样品的吸光值;A2为含样液不含邻苯三酚的对照吸光值。
1.2.6.6 羟自由基清除能力测定方法 参照Tsai Shu-Yao[20]的方法。在试管中先后加入1 mL 6.0 mmol/L FeSO4溶液、1 mL 6.0 mmol/L水杨酸溶液、1 mL样品溶液,然后加入1 mL 6.0 mmol/L的H2O2溶液启动反应,37 ℃水浴30 min后,于510 nm波长下测定吸光值。以VC为对照,平行测定3次。
羟自由基清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为蒸馏水代替样品的空白组吸光值;A1为样品的吸光值;A2为蒸馏水代替H2O2溶液的对照组吸光值。
1.2.6.7 还原能力测定方法 参照GowChin Yen[21]的方法进行。在试管中加入1 mL样品溶液和2.5 mL 0.2 mol/L磷酸缓冲液(pH6.6),再加入2.5 mL 10 mg/mL的铁氰化钾,混匀后在50 ℃保温20 min,加入2.5 mL 10%的三氯乙酸,3000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL H2O和0.5 mL 0.1%的FeCl3溶液,混匀后于700 nm波长下测定吸光值。以VC为对照,平行测定3次。
1.3 数据处理
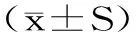
2 结果与分析
2.1 蛋清多肽水解酶选择实验
2.1.1 不同酶对蛋清水解产物DPPH自由基清除率的影响 由图1可知,在相同蛋白底物浓度和水解时间情况下,不同蛋白酶在各自最适工作条件下,水解的蛋清多肽液对DPPH自由基清除率高低依次为碱性蛋白酶>中性蛋白酶>胰蛋白酶;碱性蛋白酶水解液的DPPH自由基清除率随水解时间延长明显增加,在水解7 h达到最大值;而胰蛋白酶水解液的DPPH自由基清除率随水解时间延长虽也有所增加,但增加速度远低于碱性蛋白酶;中性蛋白酶水解液的DPPH自由基清除率随水解时间延长先增大后减小,在水解4 h时达到最大值,其最大值与碱性蛋白酶水解4 h的清除率相当,但却远远低于碱性蛋白酶水解7 h的清除率;三种蛋白酶比较,碱性蛋白酶水解液的DPPH自由基清除率最高,其次是中性蛋白酶,胰蛋白酶最差。因此碱性蛋白酶是获得清除自由基最好的蛋清多肽水解酶,其7 h的蛋清水解液的DPPH自由基清除率最高达52.17%。

图1 三种蛋白酶水解蛋清蛋白液的 DPPH自由基清除能力Fig.1 DPPH radical scavenging activity of three different protease hydrolysates of the EWP
2.1.2 不同酶对蛋清蛋白水解度的影响 由图2可知,在相同蛋白底物浓度和酶用量情况下,蛋白的水解度均随水解时间的延长而增加,但三种蛋白酶的水解度增加趋势不同,碱性蛋白酶水解蛋清蛋白的水解度随水解时间的延长增加最快,其次是中性蛋白酶,胰蛋白酶增加最慢,说明三种蛋白酶水解蛋清蛋白能力为碱性蛋白酶>中性蛋白酶>胰蛋白酶,这也说明碱性蛋白酶水解蛋清蛋白最快,最彻底。

图2 三种蛋白酶水解蛋清蛋白的水解度Fig.2 The degree of hydrolysis(DH)of the EWP hydrolyzed by three different protease
2.1.3 电泳结果分析 蛋清蛋白是由卵白蛋白、卵转铁蛋白,卵类粘蛋白、溶菌酶、卵球蛋白,卵巨球蛋白,卵糖蛋白、卵抑制剂、抗生物素蛋白、胱抑素等多种蛋白质所组成,其中前5种蛋白占蛋清蛋白组成的87%[22]。由图3可知,蛋清中的5种蛋白条带分离很明显。据文献[22-23]可知这五种蛋白质从分子量大小依次排序是:卵转铁蛋白(12%,MW 76 kDa),卵粘蛋白(3.5%,MW 55-83 kDa)、卵白蛋白(54%,MW 45 kDa)、卵类粘蛋白(11%,MW 28 kDa)、溶菌酶(3.4%,MW 14.3 kDa)。从水解的电泳图分析可知,分子量大的蛋白质很快就被酶解,蛋白条带明显变浅,分子量小的蛋白质酶解较慢,蛋白条带随水解时间的延长慢慢变浅,随着水解时间的延长,低于15 kDa以下部分逐步出现黑色条带,并且不断加深,说明蛋清中的蛋白经酶解后分子量低于15 kDa,形成了多肽物质。
由图3A可看出,随水解时间延长,经碱性蛋白酶水解蛋清的各蛋白条带明显变浅,而且在水解7 h蛋清中的各蛋白条带几乎完全消失,说明此时蛋清中原有蛋白质被完全降解,可见碱性蛋白酶对蛋清蛋白的水解效果较好,而且水解后在低于15 kDa处出现了非常深的蛋白质条带,说明蛋清蛋白被碱性蛋白酶水解后的蛋白质分子量均低于15 kDa,属于多肽分子水平。
由图3B可知,随水解时间的延长,胰蛋白酶水解蛋清液的蛋白质条带颜色也逐渐变浅,但变浅的程度明显不如碱性蛋白酶水解液变浅的程度,而且分子量25~40 kDa的蛋白条带变浅程度不明显,说明胰蛋白酶对蛋清中分子量在25~40 kDa的蛋白质水解效果不佳。而且水解后蛋白的分子量均在15 kDa左右,范围变化不大。胰蛋白酶对蛋清蛋白的水解效果较差,可能是因为蛋清蛋白中含有胰蛋白酶抑制剂卵类粘蛋白等所致[24]。
由图3C可知,随水解时间的延长,中性蛋白酶水解蛋清液的各蛋白条带颜色也不同程度的逐步变浅,但变浅的程度远不如碱性蛋白酶水解液变浅的程度,而且中性蛋白酶水解到7 h,蛋清中的各蛋白条带还显示明显,说明中性蛋白酶对蛋清各蛋白的水解速度和水解程度各不相同,水解7 h后,蛋清中各蛋白质还水解不完全。

图3 三种蛋白酶水解蛋清蛋白液的SDS-PAGE电泳图Fig.3 Electrophoregram of three different protease hydrolysates of the EWP注:M为Marker,0,1,2,3,4,5,6,7分别为 蛋清蛋白在0,1,2,3,4,5,6,7 h的水解液。
三种酶解电泳图的综合比较分析可知,碱性蛋白酶对蛋清中蛋白质水解最彻底,因为碱性蛋白酶在水解7 h的水解液中已检测不到蛋清中原有的蛋白质,而胰蛋白酶和中性蛋白酶的7 h水解液中还明显存在蛋清中原有蛋白条带。电泳结果与水解度实验结果相一致,说明碱性蛋白酶是蛋清的最适水解酶。出现这种现象的原因可能是卵转铁蛋白、卵白蛋白及大分量的蛋白质的氨基酸组成中疏水性氨基酸较多,而碱性蛋白酶和中性蛋白酶[25]水解蛋白时主要作用的是疏水性氨基酸的肽键,所以大分量的蛋白质很快首先被水解,水解后这些蛋白的电泳条带迅速变浅。黄群等人[26]采用碱性蛋白酶对卵白蛋白进行改性处理发现碱性蛋白酶能迅速降解卵白蛋白,有效改善卵白蛋白的起泡性,这也证明碱性蛋白酶能较好地水解蛋清蛋白。从以上分析,碱性蛋白酶是制备蛋清多肽的最适水解酶。
2.2 水解工艺条件优化实验结果分析
2.2.1 单因素实验
2.2.1.1 酶用量对蛋清水解物清除DPPH自由基的影响 由图4可知,随着酶用量的增大,蛋清水解物对DPPH自由基清除率逐渐增大,酶用量在12000~18000 U/g之间的水解液DPPH自由基清除率增加较快,超过18000 U/g时,蛋清水解液的DPPH自由基清除率几乎不再变化,因此选择酶用量为18000 U/g作为优化酶解条件的酶用量中心实验点为宜。
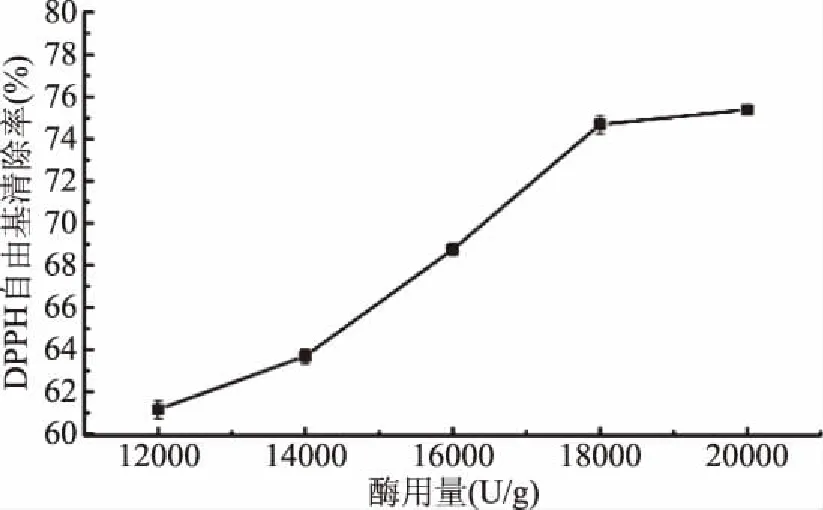
图4 酶用量对蛋清水解物DPPH自由基清除率的影响Fig.4 The effect of enzyme dosage on the DPPH radical scavenging activity of the EWP antioxidant peptides
2.2.1.2 蛋白底物浓度对蛋清水解物清除DPPH自由基的影响 由图5可知,随着底物浓度的增大,蛋清水解物对DPPH自由基清除率呈现先增大后减小又逐渐趋于平稳的趋势,说明在实验范围内,较低蛋白底物浓度水解液清除DPPH自由基能力较强。在蛋白底物浓度为3 g/100 mL时,蛋清水解物对DPPH自由基清除率达到最大。因此选择3 g/100 mL为优化酶解条件的蛋白底物浓度中心实验点为宜。

图5 蛋白底物浓度对蛋清水解物 DPPH自由基清除率的影响Fig.5 The effect of substrate concentration on the DPPH radical scavenging activity of the EWP antioxidant peptides
2.2.1.3 pH对蛋清水解物清除DPPH自由基的影响 由图6可知,随着水解pH的不断增大,当水解pH>9时,蛋清水解物对DPPH自由基清除率极速降低,在pH为9时,蛋清水解物对DPPH自由基清除率最高,因此在优化酶解条件时pH选择为9.0固定值。

图6 pH对蛋清水解物DPPH自由基清除能力的影响Fig.6 The effect of pH on the DPPH radical scavenging activity of the EWP antioxidant peptides
2.2.1.4 水解温度对蛋清水解物清除DPPH自由基的影响 由图7可知,随着水解温度的升高,蛋清水解物对DPPH自由基清除率先增加后降低,在65 ℃时,蛋清水解物对DPPH自由基清除率达到最大。而当酶解温度大于65 ℃之后,碱性蛋白酶变性失活,蛋清水解物对DPPH自由基清除率反而下降。故确定65 ℃为优化酶解条件的温度中心实验点。

图7 水解温度对蛋清水解物DPPH自由基清除能力的影响Fig.7 The effect of temperature on the DPPH radical scavenging activity of the EWP antioxidant peptides
2.2.2 正交实验 碱性蛋白酶水解物的制备工艺条件优化实验结果见表2和表3。由表2可知,影响蛋清水解物对DPPH自由基清除率的因素依次为蛋白底物浓度>酶用量>水解温度,由表3方差分析结果可知,底物浓度、酶用量对水解物的DPPH自由基清除率影响显著(p<0.05),水解温度对水解物的DPPH自由基清除率影响不显著(p>0.05)。经极差分析得出获得最大DPPH自由基清除率水解物的水解组合条件为A3B2C3(M#)。为验证优选实验结果的可靠性,将M#与正交实验表中的最大值8号实验进行了重复对比实验,发现M#的DPPH自由基清除率为68.72%,与8号实验结果差异不大。为节省能量消耗,最终选择最优水解条件为蛋白底物浓度4 g/100 mL,调整蛋清液pH9.0,添加18000 U/g蛋白的碱性蛋白酶,在60 ℃水解7 h,此时制备的蛋清蛋白酶水解物的DPPH自由基清除率最高,达到68.37%,高于王君虹等[27]在水解温度48.5 ℃,木瓜蛋白酶酶用量2.85%,酶解时间4.33 h的条件下制得的鸭蛋清肽的DPPH自由基清除率的17.49%。
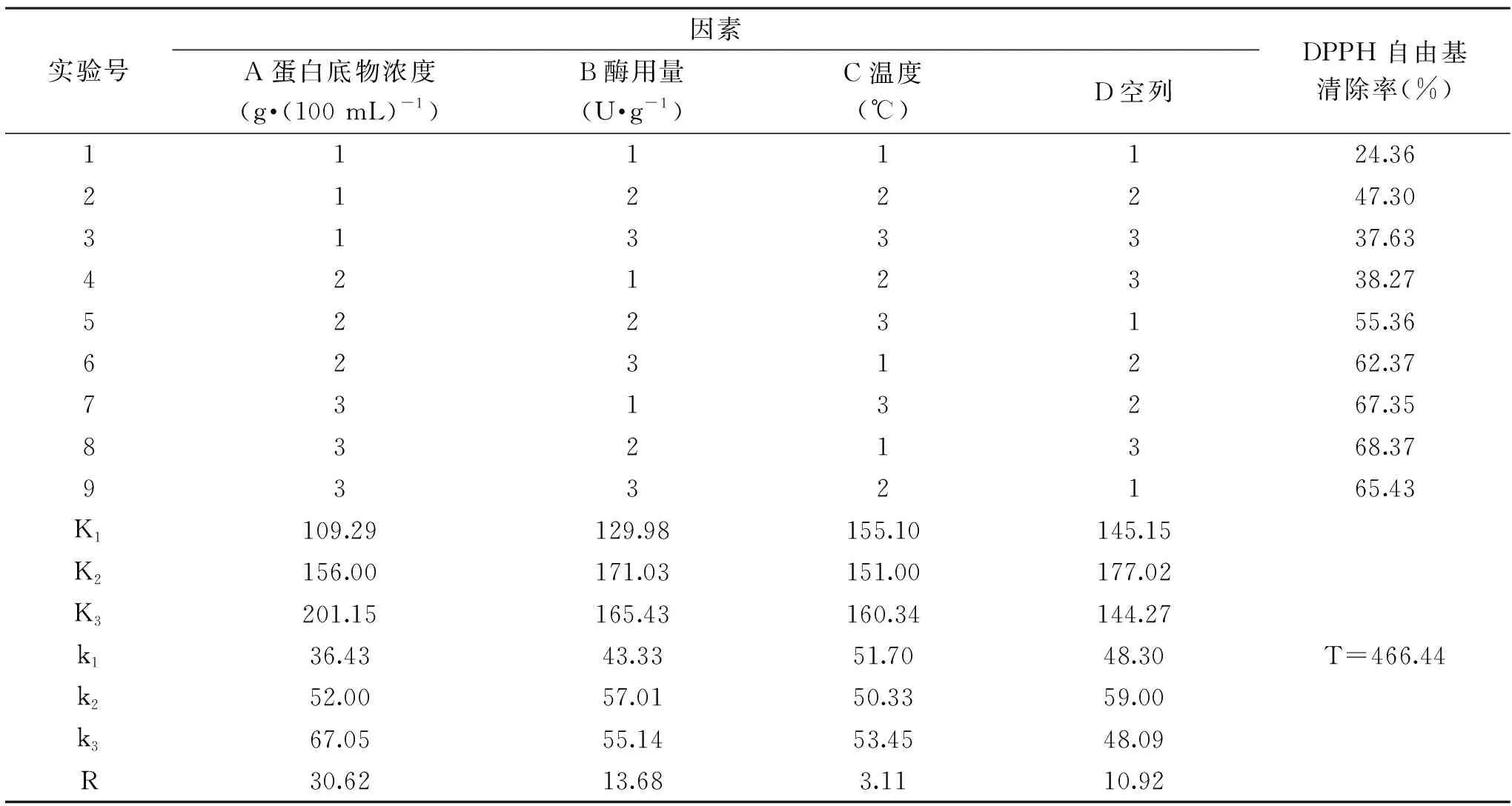
表2 正交实验结果Table 2 The result of orthogonal experiment

表3 方差分析结果Table 3 The results of variance analysis
2.2.3 微观结构分析 图8是蛋清冻干粉、蛋清碱性蛋白酶水解物冻干粉、蛋清碱性蛋白酶水解沉淀物冻干粉分别在500,2500,5000倍下的微结构电镜观测结果。由图8可知,蛋清冻干粉呈不规则的片状或者块状晶体结构,晶体表面光滑。而蛋清的碱性蛋白酶水解物的冻干粉颗粒表面呈现不规则蜂窝形多孔结构,多孔中镶嵌着不规则的细小晶体颗粒,显示出更大的表面积。而蛋清的碱性蛋白酶水解沉淀物的冻干颗粒呈不规则的松散棉絮状,这可能是蛋清蛋白被碱性蛋白酶水解后释放了部分氨基酸或空间结构,一部分小分子溶于水,而一部分大分子失去亲水结构后产生沉淀,说明蛋清蛋白被碱性蛋白酶水解后分子结构发生了巨大变化。
2.3 体外清除自由基实验结果分析
2.3.1 超氧阴离子清除率实验结果 由图9可知,蛋清水解物对超氧阴离子的清除率随着质量浓度的增大而增大,且在2~6 mg/mL范围内基本呈线性关系,超过6 mg/mL后,超氧阴离子的清除率随浓度的增加趋于稳定;而蛋清有较弱的超氧阴离子清除能力,且随着蛋清质量浓度的增大清除率反而降低。与VC相比,蛋清水解物的超氧阴离子清除能力远远低于VC,但却明显高于蛋清,说明蛋清经碱性蛋白酶水解后清除超氧阴离子的能力明显增强。

图9 蛋清蛋白酶水解物清除超氧阴离子实验结果Fig.9 The scavenging of the EWP antioxidant peptides on superoxide anion radical
2.3.2 羟自由基清除率实验结果 由图10可知,蛋清本身就有一定的羟自由基清除能力,但随质量浓度的增加先是保持不变,然后呈非线性增强。而蛋清水解物随浓度的增加呈线性增强。在较低浓度时,蛋清清除羟自由基能力优于蛋清水解物,但当浓度增大时,相同质量浓度的蛋清水解物清除羟自由基能力明显大于蛋清。通过拟合得到蛋清水解物浓度、VC浓度与羟基自由基清除率之间的关系方程分别为y=239.41x+0.792(R2=0.9899)和y=7.91587x-7.90394(R2=0.99085)。通过计算可知VC对羟自由基的半抑制浓度为0.2055 mg/mL,蛋清水解物的半抑制浓度为5.104 mg/mL,蛋清的半抑制浓度范围为8~10 mg/mL,说明蛋清水解物清除羟自由基的能力远远小于VC,但却明显大于蛋清。说明蛋清经碱性蛋白酶水解后清除羟自由基的能力明显增强。
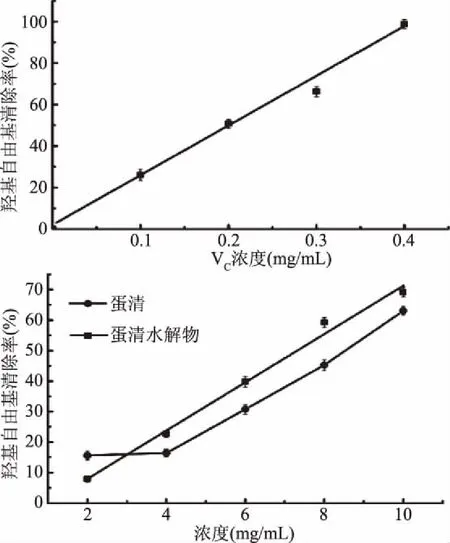
图10 蛋清蛋白酶水解物清除羟自由基实验结果Fig.10 The scavenging of the EWP antioxidant peptides on hydroxyl radical
2.3.3 DPPH自由基清除率实验结果 由图11可知,蛋清水解物和VC清除DPPH自由基的能力均随着质量浓度的增大而增大,且呈现出良好的线性关系,而蛋清的清除DPPH自由基能力较弱,且随质量浓度增加而减小。通过拟合得到蛋清水解物和VC质量浓度与DPPH自由基清除率的关系方程分别为y=6.34659x-8.68419(R2=0.98387)和y=79.05048x+46.46714(R2=0.99766)。通过计算,蛋清水解物对DPPH自由基的半抑制浓度为9.41 mg/mL,VC的半抑制浓度为0.045 mg/mL,蛋清水解物的半抑制浓度远大于VC,说明蛋清水解物清除DPPH自由基的能力远不如VC,但却明显的强于蛋清。说明蛋清经碱性蛋白酶水解后清除DPPH自由基能力得到明显提高。

图11 蛋清蛋白酶水解物清除DPPH自由基实验结果Fig.11 The scavenging of the EWP antioxidant peptides on DPPH radical
2.3.4 Fe3+还原能力实验结果 Fe3+还原能力能证明物质的抗氧化性,间接证明其清除自由基能力。由图12可知,蛋清水解物和VC对Fe3+还原能力均随着质量浓度的增大而增大,且呈现出良好的线性关系,而蛋清对Fe3+还原能力较弱,且随质量浓度的增大几乎保持不变。通过拟合得到蛋清水解物和VC质量浓度与Fe3+还原能力的关系方程式分别为y=0.03734x-0.0224(R2=0.97816)和y=4.10727x+0.03311(R2=0.99501)。通过方程计算,蛋清水解物的Fe3+还原能力远远低于VC。但在相同质量浓度时,蛋清水解物的Fe3+还原能力明显优于蛋清,所以说明碱性蛋白酶水解蛋清可以提高蛋清的Fe3+还原能力,提高血红素的载氧量。
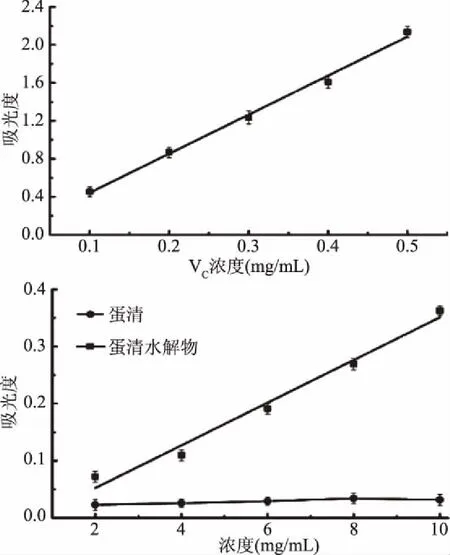
图12 蛋清蛋白酶水解物对Fe3+还原能力实验结果Fig.12 Reducing capacity of the EWP antioxidant peptides
通过以上分析,可知蛋清经碱性蛋白酶水解后其清除各种自由基的能力都得到了明显提高,说明蛋清经碱性蛋白酶水解可大大提高其保健性能。
3 结论
采用碱性蛋白酶、胰蛋白酶、中性蛋白酶,通过对比实验、电泳实验发现碱性蛋白酶是制备蛋清抗氧化肽最佳水解酶。酶用量和蛋白底物浓度对蛋清水解物的DPPH自由基清除率有显著影响(p<0.05)。碱性蛋白酶制备蛋清水解物的酶解条件优化正交实验结果表明制备蛋清抗氧化肽的最佳工艺条件是蛋清蛋白浓度在4 g/100 mL下用18000 U/g蛋白的碱性蛋白酶在pH9.0于60 ℃水解7 h,制备的蛋清多肽对DPPH自由基清除率最高,达到68.37%。
蛋清碱性蛋白酶水解多肽超微结构的电镜扫描图显示其具有明显的蜂窝状结构,且内部嵌有细小颗粒,具有较大表面积,这种特殊结构展示了其与蛋清蛋白超微结构的明显不同,使蛋清碱性蛋白酶水解多肽表现出与蛋清不同的物理化学特性。
通过体外抗氧化实验表明蛋清蛋白经碱性蛋白酶水解所得的多肽体外清除DPPH自由基、超氧阴离子、羟自由基及对Fe3+还原能力明显高于蛋清蛋白,说明蛋清蛋白经碱性蛋白酶水解能明显增强其清除自由基能力,有效提高其保健性能。
[1]W Droge. Free radicals in the physiological control of cell function[J]. Physiological Reviews,2002,82:47-95.
[2]牟旭升,李玲玲,万丽娜. 鸡蛋的营养与药用前景[J]. 中国畜禽种业,2013,9(7):129-129.
[3]Dávalos Alberto,Gómez-Cordovés Carmen,Bartolomé Begoa. Extending applicability of the oxygen radical absorbance capacity(ORAC-fluorescein)assay[J]. Journal of Agricultural and Food Chemistry,2004,52(1):48-54
[4]You SunJong. Multifunctional peptides from egg white lysozyme[J]. Food Research International,2010,43(3):848-855
[5]Xu M,Shangguan X,Wang W,et al. Antioxidative activity of hen egg ovalbumin hydrolysates[J]. Asia Pacific Journal of Clinical Nutrition,2007,16:178-182
[6]Herve G V,Rehault G S V,Magallon T,et al. Purification and characterization of avian beta-defensin 11,an antimicrobial peptide of the hen egg[J]. Antimicrobial Agents & Chemotherapy,2010,54(10):4401-4408.
[7]Epand R M,Vogel H J. Diversity of antimicrobial peptides and their mechanisms of action[J]. Biochimica et biophysica Acta,1999,1462(1-2):11-28.
[8]Mine Y. Egg proteins and peptides in human health-chemistry,bioactivity and production[J]. Curr Pharmaceut Des 2007,13:875-884.
[9]杨万根. 蛋清蛋白水解物的制备、结构及其生物活性的研究[D]. 无锡:江南大学,2008.
[10]Huang W Y,Chakrabarti S,Majumder K,et al. Egg-derived peptide IRW inhibits TNF-α-induced inflammatory response and oxidative stress in endothelial cells[J]. Journal of Agricultural and Food Chemistry,2010,58(20):10840-10846.
[11]Yu Zhipeng,Zhao Wenzhu,Liu Jingbo,et al. QIGLF,a novel angiotensin I-converting enzyme-inhibitory peptide from egg white protein[J]. Journal of the Science of Food and Agriculture,2011,91(5):921-926.
[12]Zhipeng Yu,Yongguang Yin,Wenzhu Zhao,et al. Novel peptides derived from egg white protein inhibiting alpha-glucosidase[J]. Food Chemistry,2011,129(4):1376-1382.
[13]陈杰,马美湖. 风味蛋白酶水解蛋清工艺条件的研究[J].现代食品科技,2007,23(7):43-44,47.
[14]吴谋成. 功能食品研究与应用[M]. 北京:化学工业出版社,2004.
[15]郑云. 蛋清蛋白肽生产工艺的研究[D]. 北京:北京化工大学,2006.
[16]赵新淮,冯志彪. 大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
[17]曹健,李卫林,张磊,等. 酶解胶原蛋白产物分子量的控制研究[J]. 食品工业科技,2006(8):85-88.
[18]Shahidi F. Antioxidant activity of white and black sesame seeds and their hull fractions[J].Food Chemistry,2006,99(3):478-483.
[19]朴美子,王懋存,王晓东. 中华真地鳖酶解短肽的抗氧化作用[J]. 食品科学,2013,34(5):242-245.
[20]Tsai Shu-Yao,Huang Shih-Jeng,Mau Jeng-Leun. Antioxidant properties of hot water extracts fromAgrocybecylindracea[J]. Food Chemistry,2006,98(4):670-677.
[21]GowChin Yen. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural & Food Chemistry,1995,43(1):27-32.
[22]Hoon H,Sunwoo,Naiyana Gujral. Chemical composition of eggs and egg products[J]. Handbook of Food Chemistry,2017:1-27.
[23]徐明生,杜华英,蒋艳,等. 鸡蛋清中卵转铁蛋白的分离纯化[J]. 食品工业科技,2009(6):209-211.
[24]史晓霞,金永国,黄茜,等. 鸡蛋中卵类粘蛋白的研究进展[C]. 中国蛋品科技大会. 2010.
[25]何莉萍,刘良忠. 中性蛋白酶和碱性蛋白酶对玉米蛋白水解作用的研究[J]. 食品科学,2008,29(3):152-157.
[26]黄群,杨万根,金永国,等. 卵白蛋白起泡性影响因素研究[J]. 食品与机械,2014(5):54-56.
[27]王君虹,王伟,张玉,等. 响应面法优化鸭蛋清肽酶解条件及蛋清肽功能活性研究[J]. 浙江农业科学,2017,58(10):1742-1745.
[29]Dávalos A,Miguel M,Bartolomé B,et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection,2004,67(9):1939-1944.
[30]徐明生. 鸡蛋卵白蛋白酶解物抗氧化钛研究[D]. 西安:陕西师范大学,2006.

