血尿对肾癌预后的价值分析
聂文远 马鑫 高宇 张瑜 彭程 张旭
1中国人民解放军总医院泌尿外科 中国人民解放军总医院肾脏疾病国家重点实验室 100853 北京
影响肾癌预后的最主要因素是病理分期以及Fuhrman核分级[1~3]。但以上两个因素都是基于术后的病理分析,血尿是肾癌患者的重要临床症状之一,资料显示肾癌患者血尿的发生率约为45.6%[4]。肉眼血尿往往预示着肿瘤已经侵入肾盏、肾盂,这类患者的通常伴随着更高的临床分期和病理分级,预后较差。在数据统计的过程中作者发现,仍然有部分临床分期较低的肾癌患者发生镜下血尿或者肉眼血尿,以往的研究并未对这类患者有足够的重视。对于这类患者来说血尿的发生是否意味着更差的预后?本研究旨在探讨血尿的发生是否为T1~T2期局限性肾癌患者预后的影响因素。
1 资料与方法
1.1 临床资料
收集我院泌尿外科2010年1月1日~2012年12月31日经手术治疗的肾癌患者的临床资料。纳入标准:①行肾切除术(根治性或部分切除术);②术后病理证实为肾细胞癌的患者;③术后病理诊断为T1a~T2b的患者。排除标准:①术前缺乏尿常规数据;②患有急慢性泌尿系统感染性疾病、泌尿系统结石、其他泌尿系统肿瘤;③患有免疫缺陷或血液系统疾病的患者。研究共纳入1 352例,其中男1 025例(75.81%),女327例(24.19%),年龄11~83岁,中位年龄53岁。
1.2 检测方法
患者入院后均常规行临床尿常规化验检查,包括尿镜检红细胞、尿镜检白细胞等,尿沉渣镜检每高倍镜下视野红细胞>3个即为血尿。尿常规指标为距离手术最近的一次化验检测。术后肿瘤标本在病理科行常规病理检查。
1.3 评估方法
根据尿常规检查分为血尿组和正常组。肿瘤分期根据术后病理检查结果按 2010 AJCC 版TNM 分期进行分类。
1.4 统计学方法
数据处理采用SPSS 23.0软件。计量资料采用非参数两独立样本Mann-Whitney检验;定性资料采用Pearson Ch-iSquare检验;对影响患者预后的可能因素进行单因素分析并用Cox回归模型进行影响预后的多因素分析;用Kaplan-Meier生存曲线评估血尿与正常组的无病生存率。P<0.05为差异有统计学意义。
2 结果
2.1 病例特征
1 352例患者中,血尿组患者153例占11.32%(其中镜下血尿86例占6.36%,肉眼血尿67例占4.96%),正常组患者1 199例占88.68%。T1aN0M0期900例(66.57%),T1bN0M0期347例(25.67%),T2aN0M0期74例(5.47%),T2bN0M0期31例(2.29%)。Furhman核分级:Ⅰ级20.56%(n=278),Ⅱ级69.31%(n=937),Ⅲ级9.69%(n=131),Ⅳ级0.45%(n=6)。无病生存时间9~74个月,中位无病生存时间61.5个月。
2.2 术后无病生存期的单因素及多因素分析
在单因素分析中,血尿,术后TNM分期及Furhman核分级是肾癌患者术后无病生存时间的有效影响因素,其相对危险度分别为2.8、4.6、7.8;在多因素分析中均为肾癌预后的独立影响因素(表1)。
2.3 血尿与术后无转移生存情况
本研究病例随访时间截止于2016年5月19日,无病生存时间9~74个月,中位无病生存时间61.5个月,平均无病生存时间62.9个月,血尿组和正常组的临床特征均衡性良好(表2)。Log-rank分析显示,血尿组患者的转移或者复发率高于正常组患者(P<0.01)。Kaplan-Meier分析提示,两组生存时间存在显著差异:血尿组(共153例患者,占比11.32%;平均无病生存时间65.4个月,95%CI=60.2~70.5 )与正常组(共1199例患者,88.68%占比;平均无病生存时间,70.8个月95%CI=68.4~72.6)的5年无病生存率分别为84.3%和92.9%(图1)。
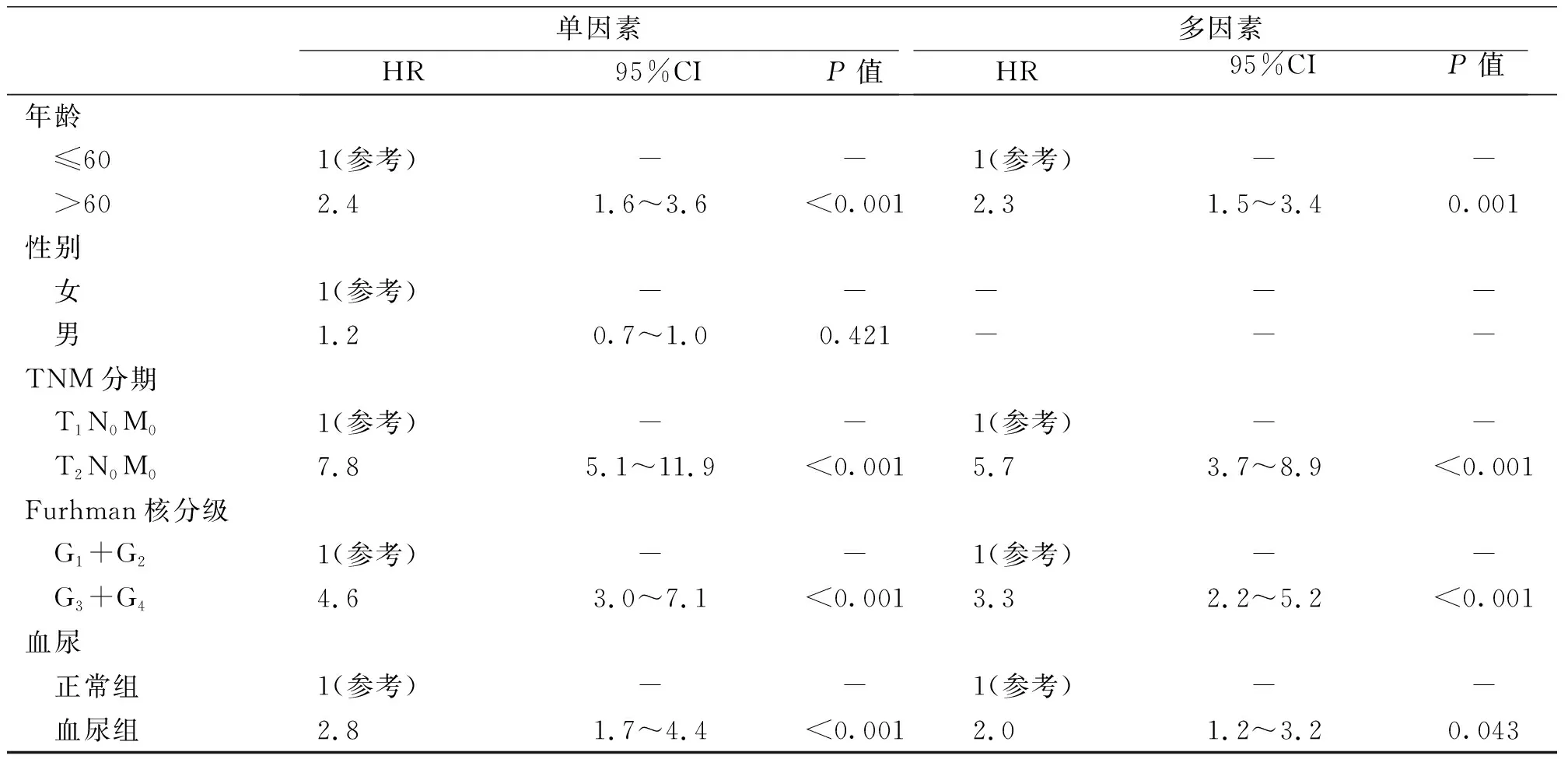
表1 1 352例肾癌患者术后无转移生存期及预后的单因素和多因素Cox风险回归分析

表2 血尿组与正常组病例特征关系
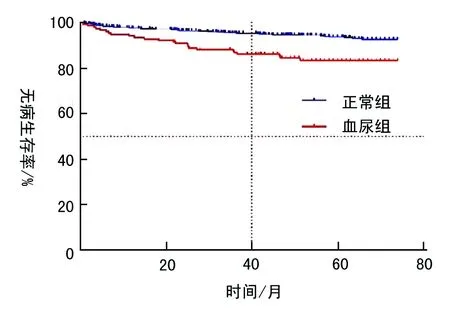
图1无病生存情况
3 讨论
血尿是泌尿系统肿瘤的常见症状,包括镜下血尿和肉眼血尿。镜下血尿是指新鲜尿液离心沉淀后每高倍镜下红细胞的数目大于3个,有研究表明无症状性镜下血尿在人群中的发生率在0.19%~16.1%;肉眼血尿是每1 000 ml尿液中含有1 ml血液,常见于泌尿系统肿瘤[4, 5]。引起血尿的病因较多,包括泌尿系统炎症、结核、结石、肿瘤、外伤、药物等,还包括一些全身性出血性疾病、内分泌疾病、心血管病[6, 7]。Sharp等[7]分析了1 305例无症状性镜下血尿的患者,发现有0.8%的血尿是由泌尿系统的肿瘤引起。
已有研究表明肥胖、切缘阳性、中性淋巴百分比、术前C反应蛋白/白蛋白比值等与肾癌的预后相关,虽然血尿在肾癌患者中并不少见,但是相关的研究并不多[8~11]。Velis等曾在596例肾癌患者的研究中报道血尿、淋巴或血管浸润、T3~T4临床分期、肿瘤坏死是局限性肾癌患者的术后无病生存期的独立影响因子[4, 12],但是报道中并未明确指出血尿对不同临床分期肾癌的影响。
随着现代影像学技术的应用,早期肾癌在入院诊治的肾癌患者中的比例越来越高,根治性或部分肾切除术是这类患者的最主要的治疗方法[13, 14]。本研究通过对2010~2012年在我院诊治的肾癌患者进行筛选,剔除了合并其他泌尿系统疾病的患者,筛选出1 352例T1~T2期局限性肾癌患者。通过系统性的分析发现,血尿在这类患者中的发生率约为11%,两组患者在发病年龄、性别、BMI上的分布差异并不显著,但是在临床分期和Furhman分级两组患者差异有统计学意义。血尿组的患者术后的临床分期和Furhman分级高于正常组,血尿组和正常组肾癌患者术后的5年转移或复发率分别为15.7%和7.1%,平均无病生存时间分别为65.4和70.8个月。通过单因素和多因素的Cox回归分析我们发现,血尿是T1~T2期局限性肾癌患者无转移生存期的独立影响因子。
综上所述,血尿是预测T1~T2期局限性肾癌患者预后的有效指标,对于发生血尿的肾癌患者可以采取一些更为优化的治疗策略,或者更密切地复查随访来确保早期发现肾癌的转移或复发。由于本研究尚未纳入T3~T4期肾癌和术前已经发生淋巴和肾外转移的患者,并且未对血尿的程度进行分层分析,因此尚需进一步的多中心研究和更为深入的探讨。
[参考文献]
[1] Capitanio U, Montorsi F. Renal cancer. Lancet, 2016,387(10021):894-906.
[2] 徐虎,王福利,袁建林.肾癌患者后腹腔镜下肾部分切除术的预后相关因素分析.中华泌尿外科杂志,2017,38(8):591-594.
[3] Krejci KG, Blute ML, Cheville JC, et al. Nephron-sparing surgery for renal cell carcinoma: clinicopathologic features predictive of patient outcome. Urology, 2003,62(4):641-646.
[4] Jung H, Gleason JM, Loo RK, et al. Association of hematuria on microscopic urinalysis and risk of urinary tract cancer. J Urol, 2011,185(5):1698-1703.
[5] Thompson IM. The evaluation of microscopic hematuria: a population-based study. J Urol, 1987,138(5):1189-1190.
[6] Cao Y, Fan Y, Chen Y, et al. Gross hematuria is more common in male and older patients with renal tuberculosis in China: a Single-Center 15-Year clinical experience. Urol Int, 2017,99(3):290-296.
[7] Sharp VJ, Barnes KT, Erickson BA. Assessment of asymptomatic microscopic hematuria in adults. Am Fam Physician, 2013,88(11):747-754.
[8] Watanabe D, Horiguchi A, Tasaki S, et al. Impact of body mass index on clinicopathological outcomes in patients with renal cell carcinoma without anorexia-cachexia syndrome. Mol Clin Oncol, 2018,8(1):47-53.
[9] 范敏,徐仁芳,陆皓,等.术前C反应蛋白/白蛋白比值在预测肾透明细胞癌患者预后方面的价值.中华泌尿外科杂志,2017,38(12):918-922.
[10] Schiavina R, Borghesi M, Chessa F, et al. [Predictors of positive surgical margins after nephron-sparing surgery for renal cell carcinoma: retrospective analysis on 298 consecutive patients]. Urologia, 2014,81(1):40-45.
[11] Templeton AJ, Knox JJ, Lin X, et al. Change in neutrophil-to-lymphocyte ratio in response to targeted therapy for metastatic renal cell carcinoma as a prognosticator and biomarker of efficacy. Eur Urol, 2016,70(2):358-364.
[12] Velis JM, Ancizu FJ, Hevia M, et al. Risk models for patients with localised renal cell carcinoma. Actas Urol Esp, 2017,41(9):564-570.
[13] Rodríguez A, Patard JJ, Lobel B. Renal cell carcinoma in young adults: incidence, disease outcome and review of the literature. Arch Esp Urol, 2002,55(8):969-975.
[14] 张旭,李宏召.腹腔镜下保留肾单位手术治疗肾肿瘤现状.中华泌尿外科杂志,2007,28(7):437-438.

