基因编辑技术在水产生物中的研究进展
王 峰 李 忠 苗贵东 1,2,
(1.贵州省化学合成及环境污染控制和修复技术重点实验室, 贵州 兴义 562400 2.民族药用生物资源研究与开发重点实验室, 贵州 兴义 562400 3.兴义民族师范学院, 贵州 兴义 562400)
水产生物特别是大型经济水产生物是人类优质蛋白的重要来源,开展水产生物基因功能研究,揭示其遗传发育规律,发掘和利用遗传资源培育高产、抗病抗逆品种,不仅具有重要的科学意义也具有巨大的经济利益。近十年来,随着第二代高通量测序技术的发展,斑马鱼(Barchydaniorerio var)、鲤鱼(Cyprinuscarpio)、斑点叉尾鮰(IetalurusPunetaus)、半滑舌鳎(Cynoglossussemilaevis)、牙鲆、草鱼、翘嘴红鲌(Erythroculterilishaeformis)、团头鲂(Megalobramaamblycephala)、尼罗罗非鱼(Oreochromisniloticus)、青鳉(Oryzias latipes)、棕刺尻鱼(CentropygevroOreochromis niloticuslikii)、佛罗里达文昌鱼(Branchiostoma floridae)、大黄鱼(Larimichthyscrocea)、大西洋鲑、大西洋鳕、石斑鱼、白鳍豚、小须鲸、扬子鳄、南美白对虾、中华绒螯蟹、虾夷扇贝、栉孔扇贝[、牡蛎(Crassostreagigas)、玻璃海鞘(Cionaintestinalis)、海胆(Strongylocentrotuspurpuratus)、海带(Saccharinajaponica)、海胆等[1-10]近百种水产生物的基因组已被测序,同时今后每年都会有多种水产生物基因组数据完成测序工作,这将为水产生物学的研究者们提供了比以往更加丰富的遗传信息资源。
随着水产生物基因组学、转录组学及全转录组研究的进步,水产生物研究也进入后基因组时代,开展功能基因组分析成为水产科技工作者迫切需要解决的重大科学问题,在反向遗传学研究的过程中诞生了基因重组,RNAi干扰、基因敲降[24]和人工核酸酶技术(锌指核酸复合酶(ZFNs)、转录激活子样效应因子核酸酶(TALEN)、成簇规律性间隔的短回文序列重复 (CRISPR)技术)。基因编辑技术的出现为快速、高效验证基因功能提供的最有效的技术手段。基因编辑是一种对基因组及其转录产物进行定点修饰、定向敲除或敲入外源的DNA序列,使之产生可遗传的改变的技术。与射线诱导和化学诱变相比,具有高效、可控和定向操作的特点。基因编辑技术被麻省理工科技评论评为2014年十大突破性科学技术,其中CRISPR还获得了2015年度生命科学突破大奖[10]。目前主流的基因编辑技术有RNA干扰(RNAi)、锌指核酸复合酶(ZFNs)、转录激活子样效应因子核酸酶(TALEN)、成簇规律性间隔的短回文序列重复 (CRISPR)技术。本文将从技术发展、原理及在水产生物领域的最新应用等方面进行阐述,并对其在水产领域的应用前景进行展望。
一、水产生物主要基因编辑技术
基因编辑技术(Gene Editing)能够让人类对目标基因进行“编辑”,实现对特定DNA片段的敲除、敲入等操作。目前水产生物基因编辑技术主要有转录水平中的转录后调控技术RNA干扰(RNAi)和核酸水平人工核酸酶技术。其中主要的人工核酸酶技术有锌指核酸酶(Zincfinger nucleases,ZFNs)技术,类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease,TALEN)技术和成簇规律性间隔的短回文序列重复(CRISPR)技术(Clustered regularly interspaced short palindromic repeats-associated protein-9 nuclease,CRISPR/Cas9)技术。
二、水产生物基因编辑技术的发展与应用
(一)RNA干扰(RNAi)技术
RNA 干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源 mRNA高效特异性降解的现象。1995年Guo和Kemphues[12]在研究中发现秀丽新小杆线虫时发现注射正义RNA(senseRNA)和反义RNA均能有效并特异性地抑制par-1基因的表达,该结果不能使用反义RNA技术的理论做出合理解释。该现象于1998年被Fire等[13]研究证实正义RNA抑制同源基因表达的现象是由于体外转录制备的RNA中污染了微量dsRNA而引发,并将这一现象命名为RNAi。1999 年和 2001 年 David Baulcombe[14]和Thomas Tuschl[15]分别在植物与动物研究中发现小干扰RNA(Smallinterfering RNA,SiRNA)现象。
RNAi干扰作用机制分两个阶段,起始阶段和效应阶段。起始阶段:外源或内源的dsRNA进入细胞后, 被Dicer酶劈成21-23个碱基的小片段(Small interfering RNA, siRNA),效应阶段:siRNA和RNA诱导沉默复合物 (RNA Induced Silencing Complex,RISC)相结合, 结合后的复合物具有核酸酶的作用,能识别并降解目标RNA。
1.RNAi在水产生物中的应用
RNAi在鱼类中的应用目前主要是在方法构建、抗病毒机制、调节生长发育与基因功能研究中。Wargelius等[16]首先通过显微注射研究了dsRNA在斑马鱼(Brachydaniorerio)胚胎中介导的RNAi效果,发现注射dsRNA后斑马鱼出现了预期的表型缺陷和mRNA水平的降低的现象,25%的胚胎表现出特异表型缺陷,同时也出现了数量相当的非特异性表型缺失。Andrews进一步发现RNAi会引发基因转录水平降低,证明RNAi通过转录后调控实现的[17]。小RNAi现象在斑马鱼[18]和硬头鳟中先后被发现。
在鱼类RNAi在抗病毒机制与应用研究方面发现,Xie等[19]研究了脂质体转染外源siRNA和商业干扰载体在鱼体内干扰病毒复制,发现外源转染siRNA能更有效的干扰目的基因,且能够有效延缓虎纹蛙虹彩病毒 (Iridovirus tiger frog virus) 在鱼细胞中的增殖过程。Dang等[20]也发现RNAi在鱼类细胞中能够有效延缓真鲷虹彩病毒(red seabream irido virus)的增殖。
在鱼类基因功能分析方面,Acosta等[21]通过显微注射dsRNA的方法研究了Myostatin基因在鱼类生长中的作用,发现沉默该基因能够促进鱼类的生长,表明该基因在鱼类中的作用与其他动物类似,均是肌肉生长的负向调控基因。Chang[22]和Huang等通过RNAi实现对斑马鱼zfPGRP6,GtHα,FSHβ,andLHβ等基因的沉默分析,并对这些基因进行了初步功能验证与分析。
黎双飞等[23]在鱼类活体实验领域通过显微注射的方法,将表达GnRH反义链的载体注射入鲤鱼(Cyprinuscarpio)受精卵获得了育性可控的转基因鱼,其极低的繁殖能力能够遗传给后代。Lin等[24]通过构建人工内含子形式的MicroRNA,经过病毒包装后侵染幼鱼或受精卵能有效的在斑马鱼体内形成组织特异性的基因沉默,且有望形成稳定遗传品系。由此将RNAi载体通过转基因的途径来开发出具有特定性状的鱼或其他水生生物具有极大的科研和应用价值。当用基因沉默的方法阻止斑马鱼GnRH2或GnRH3的mRNA翻译时,发现在中-后脑和间中脑边界处,成纤维细胞生长因子8(FGF8)或pax2.1基因的表达产生了变化。同时在斑马鱼发育过程研究中也发现GnRH基因的功能丧失会影响到早期脑和眼的形成。
RNAi在甲壳动物中研究主要体现在方法构建,抗病毒机制和基因表达调控与基因功能等方面,Su[25]和Xu[26]等分别在黑虎虾及日本对虾中构建了RNAi技术方法,表现出了基因转录后调控的基因沉默现象。
在甲壳类动物抗病毒及免疫方面,Kim等[27]首次在感染WSSV和TSV的凡纳滨对虾(Litopenaeusvannamei)中分别注射绿头鸭(Anas platyrhynchos)、鲶(Ictaluruspunctatus)和 野 猪(Susscr of a)的免疫球蛋白基因dsRNA。结果显示,注射异源物种dsRNA的实验组死亡率下降到对照组的50%-70%。Kim等进一步将VP28和VP281的长链dsRNA注射到感染WSSV的中国对虾(Fenneropenaeuschinensis)体内,也表现出比对照组更高的存活率。Xu等[26]将短链VP28的dsRNA注射到日本囊对虾(Penaeusjaponicus)体内,也发现有类似的结果。研究表明斑节对虾的Rab7可以与VP28结合,在WSSV侵染对虾的过程中发挥重要作用。Ongvarrasopone等[28]在斑节对虾中通过注射Rab7的dsRNA降低Rab7基因的表达量,从而有效抑制YHV和WSSV感染对虾,推测Rab7蛋白可能是参与了病毒复制过程中的内吞作用。在TSV侵染虾体的研究中也获得了相似的结果,Ongvarrasopone等[29]在TSV侵染凡纳滨对虾48h之后注射Rab7的dsRNA,有效地抑制TSV的复制,提高了虾的成活率。Xu等[26]同样采取基因干扰技术研究虾类白斑综合症病毒(white spotsyndrome virus)时发现siRNA能有效的提高虾类对病毒的免疫力,连续注射甚至能让染病的虾体内的病毒消失。这表明脊椎动物免疫球蛋白基因dsRNA作为外源性物质注射到凡纳滨对虾体内,激活了虾先天性的免疫反应。研究认为RNAi能够在虾类体内诱发序列特异性的基因沉默,并有可能发展成为一种新的抗病毒治疗途径。但在其他甲壳类动物中是否也存在完整的RNAi系统还需要开展进一步的研究。
在基因表达与基因功能研究领域,在对虾研究中,通过RNAi技术,在45d的长期干扰MSTN/GDF-11基因的表达,结果显示干扰组斑节对虾的增重仅为对照组的32%。在凡纳滨对虾研究中[30],经过8周的干扰,增重率显著低于对照组并且实验组出现较高的死亡率(71%)。上述结果揭示MSTN/GDF-11基因与甲壳动物的生长发育具有密切关系。
(二)人工核酸酶技术
通过转座子和同源重组技术在斑马鱼、青鱂等模式生物上实现了基因敲除,但是基因敲除效率很低;利用逆转录病毒介导法也能获得斑马鱼随机的基因突变,但该方法存在周期长、筛选困难、成本高、不能准确改变特定基因等缺点。使用RNAi技术虽然可以在短时间导致靶基因表达量降低,用以研究靶基因的功能,但该技术无法获得稳定遗传突变体。因此这些研究基因功能技术受到各自技术瓶颈制约,使得水产生物基因的研究大都停留在基因克隆和表达分析等方面,基因功能方面研究进展缓慢,人工核酸酶技术的出现为高效、低成本、高稳定性突变体构建及实现基因功能研究带来巨大的技术突破,极大促进了水产生物基因功能研究。
1.三种人工核酶技术的原理
人工核酸酶技术是最近几年发展起来的一类全新的基因编辑技术。人工核酸酶是一类人工构建的能识别特定DNA序列并能在DNA分子上形成双链切割(Double strand breaks, DSB)的核酸酶。其工作机制是受损的DNA通过两种修复机制,即同源重组(Homologous recombination,HR)和非同源末端连接(Non-homologous end jointing, NHEJ)[31,32]进行修复。在动物细胞中非同源末端连接是一种重要的易错修复机制,在修复过程中,DNA双链受损部位会插入或缺失部分碱基,当插入或缺失碱基数不为3或3的倍数并且处于基因开放阅读框内时,就会造成基因的移码突变,使这个开放阅读框的信息不能正确翻译,从而发生基因敲除的现象[33]。而在真核生物酿酒酵母细胞中,同源重组则是一种占统治地位的修复机制,二倍体酿酒酵母通过另一条染色体作为模板提供正确片段的供体来修复受损的DNA,当人工核酸酶的切割发生在单倍体酿酒酵母中时,通过提供人工设计的供体,可以实现对单倍体酿酒酵母的定点基因编辑[34]。
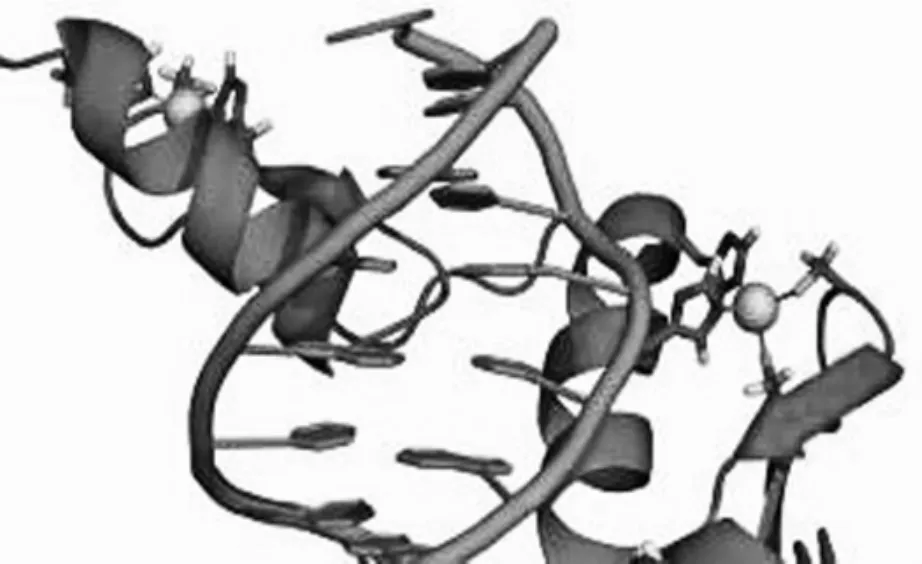
图1.结合到DNA(橙色)上的锌指核酸酶(蓝色)引自维基共享资源,thomas Splettstoesser
人工核酸酶技术目前形成3种代表性的技术,即锌指核酸酶技术 (Zinc finger nucleases,ZFNs)、类转录激活因子效应物核酸酶技术(Transcription activator-like effector nuclease,TALEN)和CRISPR/Cas9技术(Clustered regularly interspaced short palindromic repeats-associated protein-9 nuclease,CRISPR/Cas9)。
2.锌指核酸酶(Zincfinger nucleases,ZFNs)技术
锌指核酸酶(zinc finger nuclease, ZFNs),又名锌指蛋白核酸酶,不是自然存在的,而是一种人工改造的核酸内切酶(图1),由一个DNA识别域和一个非特异性核酸内切酶构成,其中DNA识别域赋予特异性,在DNA特定位点结合,而非特异性核酸内切酶赋剪切功能,两者结合就可在DNA特定位点进行定点断裂。
锌指蛋白源自转录调控因子家族(图2)DNA识别域是由一系列Cys2-His2锌指蛋白串联组成,研究还表明每个锌指蛋白识别并结合3′到5′方向DNA链上一个特异的三联体碱基以及5′到3′方向的一个碱基。
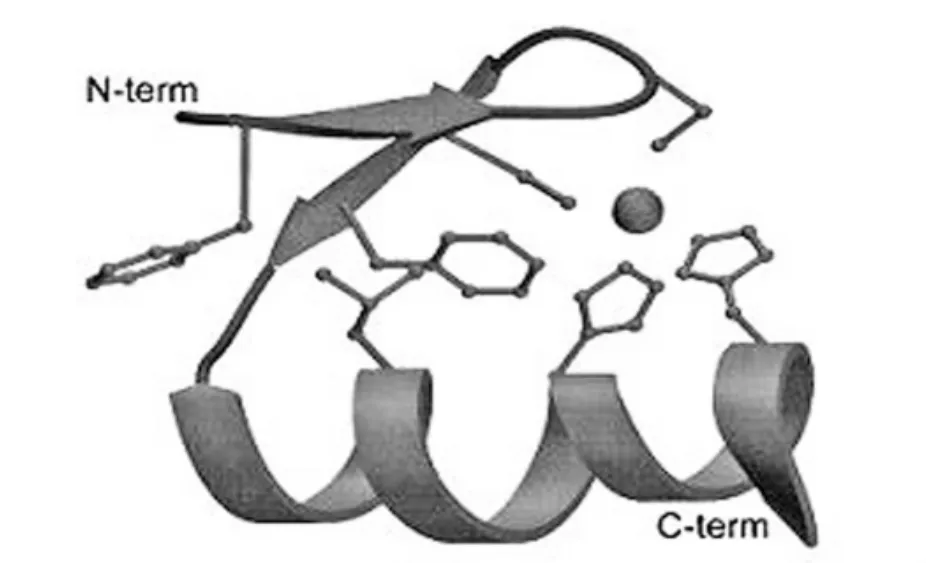
图2 Cys2-His2锌指单元首先是在TFIIIA中鉴定出的。TFIIIA含有9个大约30个氨基酸基序的串联重复。
锌指核酸酶是第一代人工核酸酶技术。1985年 Mille等[35]在研究非洲爪蟾(Xenopuslaevis)的转录因子TFIIIA中发现发现锌指蛋白。锌指核酸酶在水产领域的应用主要是方法建立,基因功能分析。Meng[36]和Doyon[37]等先后利用锌指核酸酶技术定向敲除了斑马鱼中血管内皮生长因子受体基因kdr和胚胎色素基因golden和notail基因,使斑马鱼作为模式动物开展基因的功能研究成为可能。王雯雯等[38]在利用锌指蛋白酶构建了斑马鱼基因敲除的实验体系,锌指核酸酶技术研究开始在国内起步。但是由于锌指核酸酶由技术由于于操作难度、复杂性及价格原因未能得到大规模应用,随着第二代核酸酶技术的出现,其逐步被第二代核酸酶技术所取代。
3.类转录激活因子效应物核酸酶(Transcription activator-like effector nuclease,TALEN)技术
TALEN技术是属于第二代人工核酶技术,是二聚的转录因子/核酸酶,由33至35个氨基酸模块构成,包含核定位信号的N端结构域、识别特定DNA序列的典型串联TALE重复序列的中央结构域和具有FokI 核酸内切酶功能的C端结构域。其中每模块靶定特定核苷酸序列。通过组装这些模块,研究人员可靶定他们想要的任何序列。其特点是在同一蛋白(TALEN)上,实现有序实现引导细胞进入细胞核、靶位点DNA的特异性识别和靶位点DNA的切割三个不同功能。
Hosoi等[39]在海胆]建立了TALEN基因组编辑技术,2012年Stephen Ekker[40]在Nature发表首次在斑马鱼上,构建基于TALEN技术的鱼类基因编辑方法。Qiu等[41]利用TALEN技术构建了高效敲出青鳉中转入的GFP报告基因的方法,表明TALEN技术在水产领域初步实现。
TALEN技术应用主要在鱼类功能分析领域,熊小杰等[42]和郭潇[43]等利用TALEN技术分别敲除斑马鱼 IDH 和aftpha、sertad2a、si:ch73-131e21.5、panel、si:ch211-89o9.6、rsph3及rsph4a基因。Treen等[44]通过电穿孔的方式把TALEN成功转入到海鞘里,实现了整体或者特定组织敲除,并且开发了相应的突变检测方法提高了检测效率,研究中发现在特定地敲除上皮组织里的Hox12基因和神经组织里的Fgf3基因过程中发现,在敲除Fgf3基因时发现了此基因在海鞘类幼体变态阶段的新的功能。崔忠凯[45]等利用TALEN技术成功敲除了半滑舌鳎Z染色体上的dmrt1基因,并获得了33尾基因突变鱼,确切证明dmrt1是鱼类雄性性别决定的关键基因。Lau等[46]利用TALEN技术敲除斑马鱼卵巢芳香化酶基因cyp19a1a基因,结果发现其子代由于性腺分化失败,全部表现为雄性,研究结果证明了卵巢芳香化酶基因在卵巢分化和发育过程中发挥关键性作用。进一步研究发现卵巢芳香化酶不会影响早期卵巢及初级卵细胞生成,但是该基因对于早期卵巢发育为成熟卵巢起到关键作用。
4.成簇规律性间隔的短回文序列重复(CRISPR)技术 (Clustered regularly interspaced short palindromic repeats-associated protein-9 nuclease,CRISPR/Cas9)技术
2002年荷兰乌得勒支(Utrecht)大学Jansen[47]在Molecular Microbiology杂志上发表了他们利用生物信息工具对一系列古菌和细菌的重复序列进行了分析的文章。2007年法国Danisco公司的Philippe Horvath与其同事Barrangou[48]等Science杂志上正式发表了研究论文,在文章中首次将这个重复序列命名为Clustered Regularly Interspaced Short Palindromic Repeats,简称CRISPR,同时也首次使用CRISPR-associated(Cas)这个概念。
2013年Mali[49]和Cong[50]实验室分别发表了基于CRISPR-Cas9技术在细胞系中进行基因敲除的新方法,该方法利用改造自细菌的Ⅱ型CRISPR系统,是继锌指核酸酶(ZFN)和TALEN等技术后可用于定点构建基因敲除大、小鼠动物的第三种人工核酶技术,被称为第三代人工核酸酶。相比ZFN和TALEN技术,CRISPR技术具有更加经济简便的优势,在应用中只用到Cas9蛋白和sgRNA两个元件,针对不同的靶点序列只需改变sgRNA上约20nt的识别序列即可。同时,该技术体现出的效率高、速度快、生殖系转移能力强,在动物模型构建的应用前景广阔的特点,使其出现后就迅速在多种生物中得到成功应用,并逐步取代了ZFNs和TALEN两种技术[51]。
Niu等[52]利用CRISPR/Cas9系统成功对灵长类的动物食蟹猴进行了精确的基因编辑,在该项研究中,以食蟹猴胚胎中的Nr0b1、Ppar-r和Rag1等基因作为靶位点进行实验,结果发现Ppar-r和Rag1出现突变,随后经代孕后生出的子代孪生猴也被证实存在Ppar-r和Rag1基因突变,因此研究表明CRISPR/Cas9系统不仅具有高效的特点,还能够稳定遗传给后代,这为实现生物高效的基因改造奠定技术基础。
在水产生物中2013年Hwang等[53]在斑马鱼上实现用CRISPR-Cas系统高效的基因编辑。中国学者黄军[54]首次利用CRISPR/Cas9开展人类胚胎基因编辑研究,引发学界对编辑技术的伦理思考。标志基因编辑技术实现了从模式生物到智能生物的全覆盖,也标志着基因功能研究全面进入基因编辑的新时代。
CRISPR/Cas9技术的独特优点,在水产生物研究中也逐步获得发展。由于水产生物CRISPR/Cas9基因编辑技术起步晚及胚胎操作难度大、效率较低等问题,在水产生物中的应用主要是在编辑方法建立研究方面,以斑马鱼为研究对象开展了方法优化[55]、细胞系验证[56]、多种基因和多种方法[57,58]的尝试均获得基因编辑的良好效果。同时CRISPR/Cas9技术在玻璃海鞘、海胆、海葵、大西洋角螺、、端足类动物、脊尾白虾、三角褐指藻、海七鳃鳗、大西洋鲑、青鳉[59-65]等十余种水产生物中均取得了成功,涵盖了尾索动物、棘皮动物、刺胞动物、贝类、鱼类、甲壳动物和藻类等8个生物类群。在其他物种研究中Sasaki[66]和Stolfi等[67]分别对Hox家族基因中的Hox3、Hox5、Hox12及发育过程中决定细胞命运的ebf基因进行敲除及功能验证分析,构建了玻璃海鞘引导RNA数据库,用于系统的玻璃海鞘功能基因的敲除。Chakrapani等[68]建立的鲤鱼TLR22基因的基因编辑体系,Gui等[69]在脊尾白虾(Exopalaemon carinicauda)研究中成功的利用CRISPR/Cas9技术实现了几丁质酶基因EcChi4的敲除,并观察了EcChi4敲除对脊尾白虾生长发育的影响。
三、基因编辑技术在水产生物领域应用的展望
由于水产生物技术起步较晚,目前缺乏成熟有效的基因编辑技术已成为制约开展基因功能研究的重要因素,基因组编辑技术的操作对象是基因组DNA,且主要是通过显微注射对细胞系或胚胎进行操作。而目前为止,水产生物细胞系较少,特别是甲壳类动物还未形成成熟的细胞系构建技术体系,且卵壳较硬易碎。显微注射技术及去核操作难度大,成功率低,成为制约水产生物基因编辑技术应用的主要瓶颈[10]。
RNAi、ZFN和TALEN技术在水产生物生长发育、抗病毒与免疫、基因功能及遗传研究领域发挥了积极作用,但是随着CRISPR技术出现,其系统构建简单、成本低廉的优势明显,现已广泛应用于细胞和动物模型的快速制备、转录调控及遗传性疾病的治疗[70]等。水产生物基因编辑技术主要研究各类编辑方法在不同类型水产生物方法建立,基因结构变化检测,功能基因初步分析,完善的基因编辑方法与其他模式生物相比仍存在较大差异,还需在基因编辑技术专有设备,技术手段,编辑基因类型等方面根据水产生物胚胎特点不断发展和完善,同时利用人工智能技术手段逐步提高人工智能领域在显微注射及仪器实验精度的提高,减少对胚胎的影响,提高转基因成功率及胚胎孵化效率。
美国FDA于2015年批准了转基因三文鱼上市销售,成为首例获准上市的转基因动物[71]。同年Qian等[72]在利用锌指核酸酶技术敲除了家猪(Susscr of adomestica)体内抑制肌肉生长的Mstn基因,获得了肌肉含量更加丰富的家猪品种。利用CRISPR技术的基因编辑方法育种,基因工程手段用于遗传育种有望逐渐被消费者所认可。通过基因编辑技术有望实现更好的利用基因组信息和已发掘的遗传资源,更加快速有效的获得高产、单性及抗病抗逆[73]新品种,如果在水产领域应用推广此项技术,敲除鱼、虾、贝类的肌肉抑制基因,增加抗病抗逆基因获取更高肌肉含量且具有更强适应性的的水产新品种将具有巨大的市场前景和良好的社会和经济效益,从而更好的为人们提供营养丰富水产品。基因编辑技术在水产中的应用已成为一种趋势,一定会在未来的水产生物技术研究中发挥越来越大的作用。

