不同生理阶段荷斯坦奶牛瘤胃细菌多样性研究
李子健 李大彪* 高 民 王 典 兰儒冰
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古自治区农牧业科学院动物营养研究所,呼和浩特 010031;3.内蒙古优然牧业有限责任公司,呼和浩特 010107)
奶牛瘤胃中栖息着数量庞大,种类繁多的微生物,它们能够降解动物摄取的纤维物质,使其转化成能被自身所利用的营养物质。已有研究表明,成年牛瘤胃中寄居的微生物主要包括细菌、真菌、原虫和古菌,其中细菌含量占到总体的95%,每毫升瘤胃液中活菌数量高达1011个[1-2],其在消化和转化饲料为短链脂肪酸和微生物蛋白(MCP)时起着至关重要的作用[3]。反刍动物在不同的生理阶段,瘤胃细菌组成结构可能变化,探究这种变化规律对于揭示瘤胃代谢与反刍动物生产性能的关系具有重要意义。郭伟[4]研究表明,山羊从7日龄到3月龄瘤胃细菌中拟杆菌门(Bacteroidetes)相对丰度逐渐升高,随后逐渐降低,6月龄以后达到稳定,而变形菌门(Proteobacteria)相对丰度的变化趋势与之相反。Jami等[5]研究发现,初生犊牛与成年牛瘤胃菌群组成差异显著,随着年龄的增加,瘤胃菌群多样性也随之增加。高凤等[6]研究了荷斯坦牛哺乳期、断奶期、育成期、青年期、泌乳期和干奶期的肠道菌群结构,结果显示不同生长期和生理期的荷斯坦牛肠道菌群在门水平上保持相对稳定,双歧杆菌属(Bifidobacterium)的相对丰度在泌乳期显著高于其他生长期。然而董瑞阳[7]研究得出,在同一饲粮条件下,奶牛不同生理期(泌乳期与干奶期)对瘤胃微生物菌群无显著影响。本试验采用高通量测序技术对处于不同生理阶段的荷斯坦奶牛瘤胃细菌多样性进行分析,为揭示瘤胃微生物区系与奶牛泌乳性能的关系奠定基础。
1 材料与方法
1.1 试验动物
试验动物选自内蒙古呼和浩特市某示范牧场,分别选取健康状况良好,处于围产前期(产前7~15 d)、泌乳前期(产后30~55 d)、泌乳中期(产后82~105 d)和泌乳后期(产后153~181 d)荷斯坦奶牛各4头,泌乳期奶牛产奶量均高于30 kg/d,奶牛的年龄为4~5岁,胎次为3~4胎,同一组内,体况与产犊日期接近。
1.2 试验设计
本试验采用单因素完全随机试验设计,4组奶牛分别用Ⅰ组(围产前期组)、Ⅱ组(泌乳前期组)、Ⅲ组(泌乳中期组)和Ⅳ组(泌乳后期组)来表示。奶牛自由饮水,分群饲养,每天饲喂3次,饲喂时间分别为06:00、14:00和21:00,各个阶段的奶牛饲粮由牛场提供,以全混合日粮(total mixed rations,TMR)的方式饲喂给奶牛,饲粮组成及营养水平见表1。
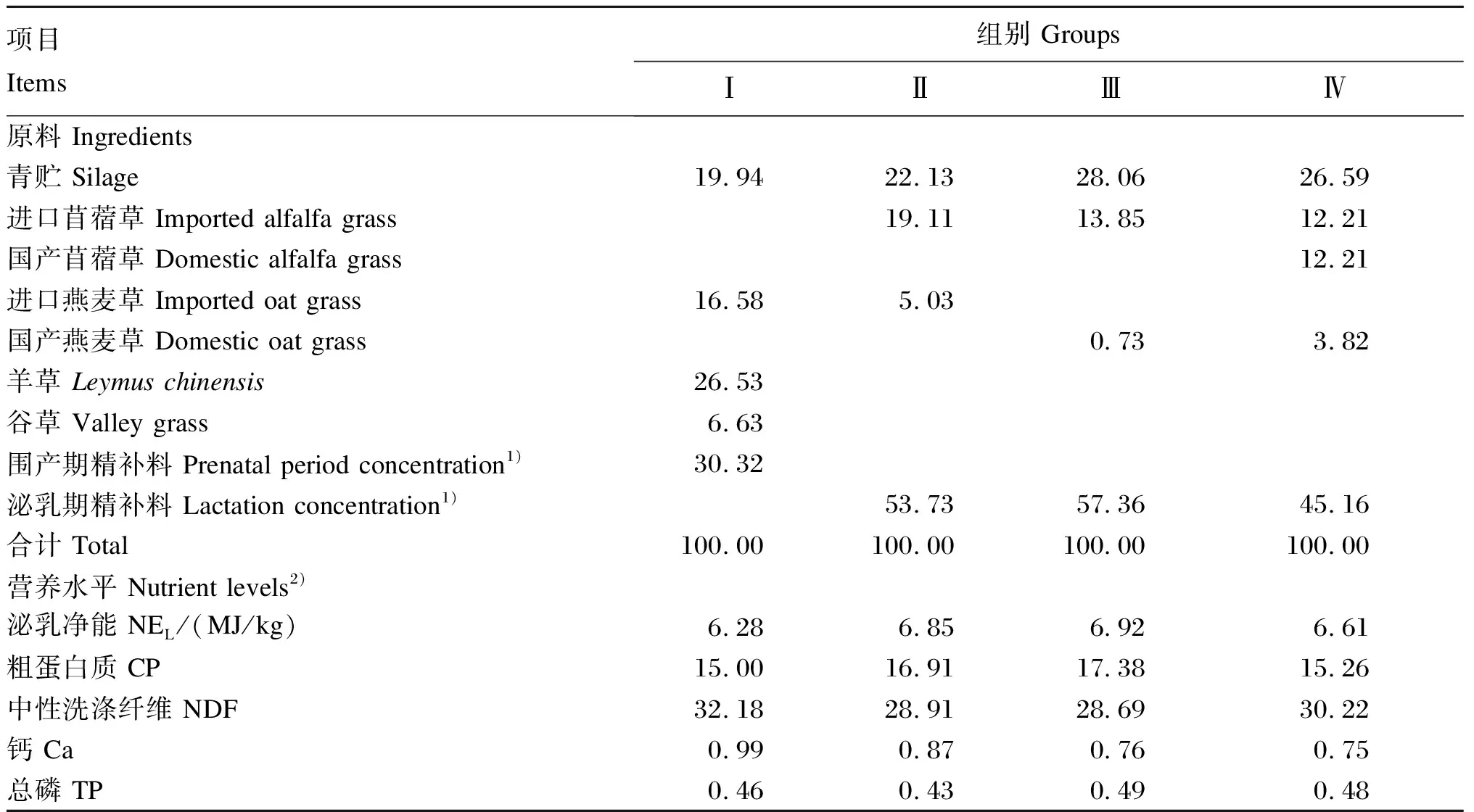
表1 饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of diets (DM basis) %
1)精补料由牧场所属公司统一提供。Concentrations were provided by the company which owned this pasture.
2)泌乳净能为计算值,粗蛋白质、中性洗涤纤维、钙和总磷为实测值。NELwas a calculated value, while CP, NDF, Ca and TP were measured values.
饲粮营养水平中的泌乳净能根据饲粮各成分的泌乳净能和其配方比例计算得出,其中精饲料的泌乳净能由牛场提供,粗饲料的泌乳净能参考NRC(2001)[8]。其余营养水平参照《饲料分析及饲料质量检测技术》(3版)[9],使用KOM-A2000i型全自动纤维分析仪(美国)测定中性洗涤纤维(NDF)含量;使用ZDDN-Ⅱ型全自动凯氏定氮仪(浙江托普云农科技股份有限公司)测定粗蛋白质(CP)含量;使用α1900S型紫外可见分光光度计(上海谱元仪器有限公司)测定总磷(TP)含量;采用高锰酸钾滴定法测定钙(Ca)含量。
1.3 样本采集
在2017年6月中旬晨饲后6 h通过口腔采样器采集瘤胃食糜,经过4层纱布过滤,保留滤液,用于测定瘤胃发酵参数与瘤胃细菌菌群多样性。
1.4 瘤胃发酵参数的测定
pH使用PHS-3S型高精度酸度计,于瘤胃食糜采集后立即测定;氨态氮(NH3-N)浓度参照冯宗慈等[10]的方法测定;MCP浓度参照Bradford[11]的方法测定;挥发性脂肪酸(VFA)浓度参照秦为琳[12]的方法测定。
1.5 瘤胃细菌菌群多样性的测定
1.5.1 DNA提取和PCR扩增

表2 测序分析采用的引物信息Table 2 Information of primer for sequencing analysis
1.5.2 Illumina Miseq PE300平台测序
使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences公司,美国)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega公司,美国)进行检测定量。根据Illumina MiSeq PE300平台(Illumina公司,美国)标准操作规程将纯化后的扩增片段构建PE 2×300的文库,并利用Illumina Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.5.3 数据处理
原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接。使用UPARSE软件根据97%的相似度对序列进行分类操作单元(OTU)聚类。使用UCHIME软件剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
1.6 数据统计与分析
测得的数据采用SAS 9.0软件的GLM程序进行单因素方差分析,多重比较采用Duncan氏法,以P<0.05作为差异显著性判定标准。
2 结 果
2.1 不同生理阶段奶牛瘤胃发酵参数
不同生理阶段奶牛瘤胃发酵参数见表3。Ⅰ组奶牛瘤胃pH显著高于Ⅲ、Ⅳ组(P<0.05),与Ⅱ组无显著差异(P>0.05),Ⅱ、Ⅲ、Ⅳ组之间无显著差异(P>0.05)。各组奶牛瘤胃NH3-N浓度无显著差异(P>0.05)。Ⅰ组奶牛瘤胃MCP浓度显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),Ⅱ组显著高于Ⅲ、Ⅳ组(P<0.05),Ⅲ、Ⅳ组之间无显著差异(P>0.05)。Ⅰ组奶牛瘤胃乙酸、丁酸、总挥发性脂肪酸(TVFA)浓度和乙酸/丙酸显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05)。与之相反,Ⅰ组奶牛瘤胃丙酸浓度显著低于Ⅱ、Ⅲ、Ⅳ组(P<0.05)。
比较不同泌乳期奶牛瘤胃VFA浓度变化时发现,Ⅳ组奶牛瘤胃乙酸浓度和乙酸/丙酸显著高于Ⅱ、Ⅲ组(P<0.05),Ⅱ、Ⅲ组之间无显著差异(P>0.05)。Ⅲ组奶牛瘤胃丙酸浓度显著高于Ⅳ组(P<0.05),与Ⅱ组无显著差异(P>0.05),Ⅳ、Ⅱ组之间无显著差异(P>0.05)。Ⅲ组奶牛瘤胃丁酸浓度显著低于Ⅱ、Ⅳ组(P<0.05),Ⅱ、Ⅳ组之间无显著差异(P>0.05)。Ⅱ、Ⅲ、Ⅳ组之间奶牛瘤胃TVFA浓度无显著差异(P>0.05)。
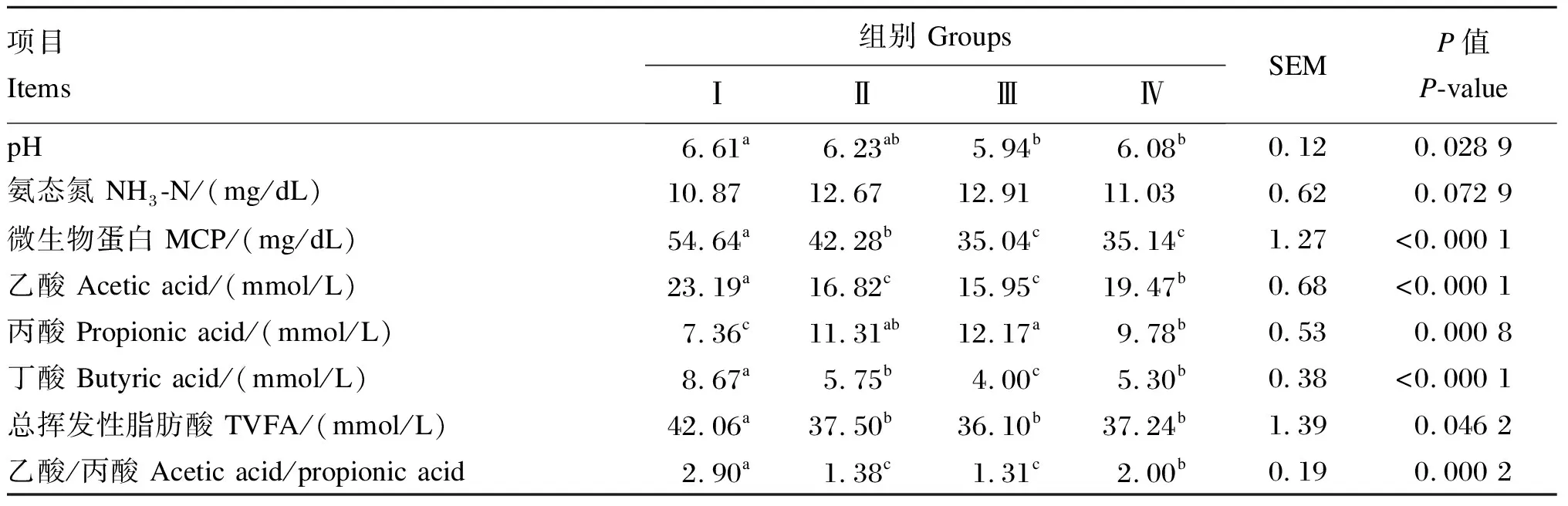
表3 不同生理阶段奶牛瘤胃发酵参数Table 3 Rumen fermentation indexes of dairy cows in different physiological phases
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2 瘤胃细菌高通量测序数据质量控制与样品多样性指数
测序数据经过质量控制后,各组瘤胃细菌的Clean reads数目、OTU数目以及物种多样性指数见表4。本试验从16个样本中共得到871 196条高质量的细菌16S rRNA基因序列,每个样本的平均Clean reads数目为54 450,各组间无显著差异(P>0.05)。平均OTU数目为1 039,其中Ⅰ组OTU数目显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),Ⅱ组显著高于Ⅲ、Ⅳ组(P<0.05),Ⅲ、Ⅳ组之间无显著差异(P>0.05)。本试验各组测序覆盖度均达到了0.99,满足后续分析要求。Ⅰ组Ace指数与Chao1指数显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),Ⅱ组显著高于Ⅲ、Ⅳ组(P<0.05),Ⅲ组又显著高于Ⅳ组(P<0.05)。各组香农指数的变化规律与OTU数目的结果相一致,即Ⅰ组显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),Ⅱ组又显著高于Ⅲ、Ⅳ组(P<0.05),而Ⅲ、Ⅳ组之间无显著差异(P>0.05)。Ⅰ组辛普森指数显著低于Ⅱ、Ⅲ、Ⅳ组(P<0.05),Ⅱ、Ⅲ、Ⅳ组之间无显著差异(P>0.05)。
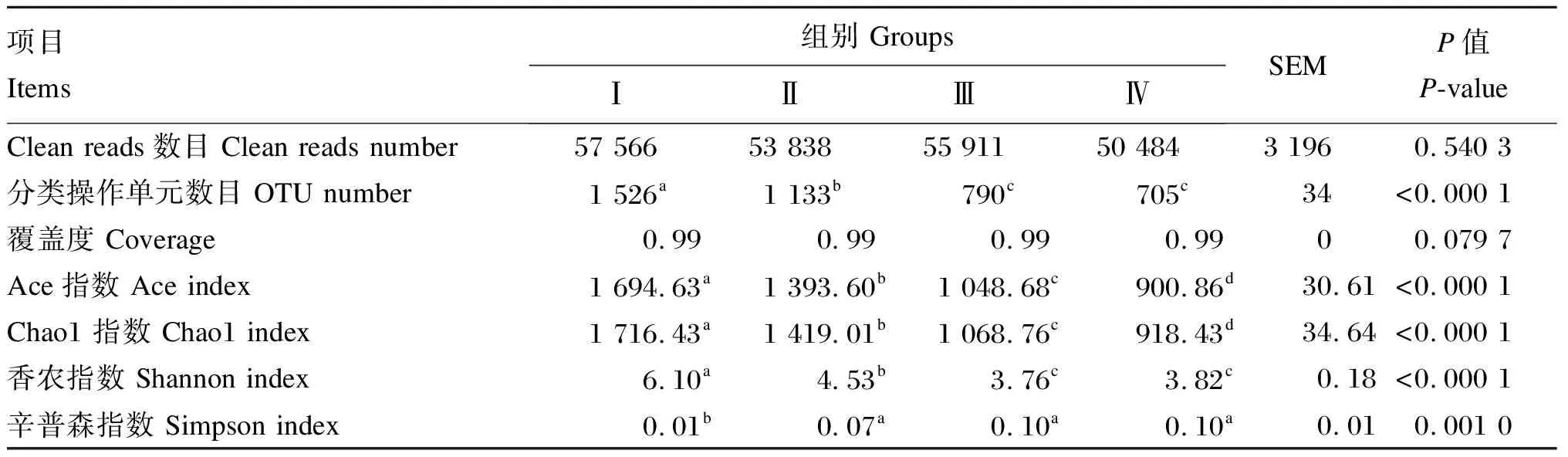
表4 瘤胃细菌高通量测序质量控制与样品多样性指数Table 4 Rumen bacteria high-throughput sequencing quality control and diversity index of samples
2.3 不同生理阶段对奶牛瘤胃细菌区系的影响
从表5可以看出,各组瘤胃细菌在门水平物种组成上存在差异,Ⅰ组的优势菌门为拟杆菌门和厚壁菌门(Firmicutes),而Ⅱ、Ⅲ、Ⅳ组的优势菌门为拟杆菌门、变形菌门和厚壁菌门。此外,Ⅰ组奶牛瘤胃细菌中的拟杆菌门、SR1细菌、蓝菌门(Cyanobacteria)、柔膜菌门(Tenericutes)、TM7细菌和纤维杆菌门(Fibrobacteres)的相对丰度显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),而Ⅱ、Ⅲ、Ⅳ组之间差异不显著(P>0.05)。与之相反,Ⅰ组奶牛瘤胃细菌中的变形菌门的相对丰度则显著低于试验Ⅱ、Ⅲ、Ⅳ组(P<0.05)。各组之间奶牛瘤胃细菌中的厚壁菌门的相对丰度无显著差异(P>0.05)。
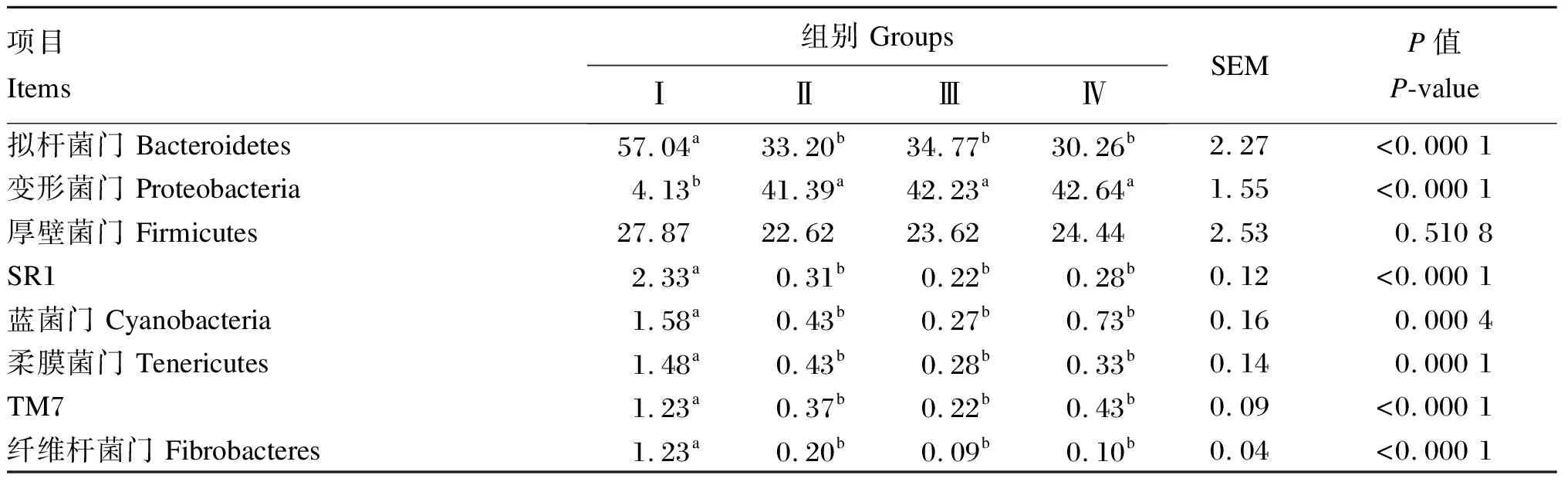
表5 瘤胃细菌门水平上的物种比例(占总细菌比例大于1%)Table 5 Species proportion of rumen bacteria at phyla level (proportion of total bacteria higher than 1%)
从表6可以看出,各试验组瘤胃细菌在科水平物种组成上存在差异,Ⅰ组的优势菌科为普雷沃氏菌科(Prevotellaceae),而Ⅱ、Ⅲ、Ⅳ组的优势菌科为琥珀酸弧菌科(Succinivibrionaceae)和普雷沃氏菌科。Ⅰ组奶牛瘤胃细菌中普雷沃氏菌科、瘤胃菌科(Ruminococcaceae)、理研菌科(Rikenellaceae)、BS11细菌、RF16细菌、SR1细菌、Gastranaerophilales、克里斯滕森菌科(Christensenellaceae)、TM7细菌、RF9细菌和纤维杆菌科(Fibrobacteraceae)的相对丰度显著高于Ⅱ、Ⅲ、Ⅳ组(P<0.05),与之相反,Ⅰ组奶牛瘤胃细菌中琥珀酸弧菌科、毛螺菌科(Lachnospiraceae)和韦荣球菌科(Veillonellaceae)的相对丰度显著低于Ⅱ、Ⅲ、Ⅳ组(P<0.05)。Ⅰ组奶牛瘤胃细菌中丹毒进菌科(Erysipelotrichaceae)的相对丰度显著低于Ⅲ、Ⅳ组(P<0.05),而S24-7细菌的相对丰度显著高于Ⅲ、Ⅳ组(P<0.05)。各组奶牛瘤胃细菌中氨基酸球菌科(Acidaminococcaceae)的相对丰度无显著差异(P>0.05)。
不同泌乳期比较发现,Ⅱ、Ⅲ、Ⅳ组之间奶牛瘤胃细菌中普雷沃氏菌科、琥珀酸弧菌科、毛螺菌科、瘤胃菌科、韦荣球菌科、RF16细菌、SR1细菌、克里斯滕森菌科、TM7细菌和RF9细菌的相对丰度无显著差异(P>0.05)。Ⅱ组奶牛瘤胃细菌中理研菌科、S24-7细菌、BS11细菌和纤维杆菌科的相对丰度显著高于Ⅲ、Ⅳ组(P<0.05),Ⅲ、Ⅳ组之间差异不显著(P>0.05)。与此相反,Ⅱ组奶牛瘤胃细菌中丹毒进菌科的相对丰度显著低于Ⅲ、Ⅳ组(P<0.05),Ⅲ、Ⅳ组之间差异不显著(P>0.05)。此外,Ⅱ组奶牛瘤胃细菌中Gastranaerophilales的相对丰度与Ⅲ、Ⅳ组无显著差异(P>0.05),但Ⅳ组显著高于Ⅲ组(P<0.05)。
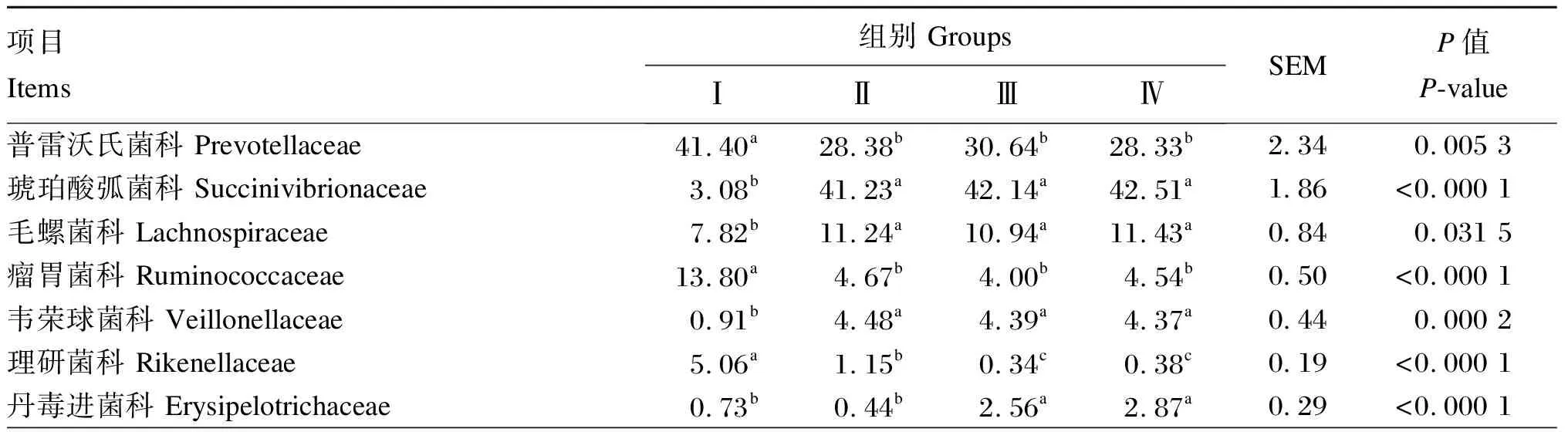
表6 瘤胃细菌科水平物种组成(占总细菌比例大于1%)Table 6 Species proportion of rumen bacteria at family level (proportion of total bacteria higher than 1%)
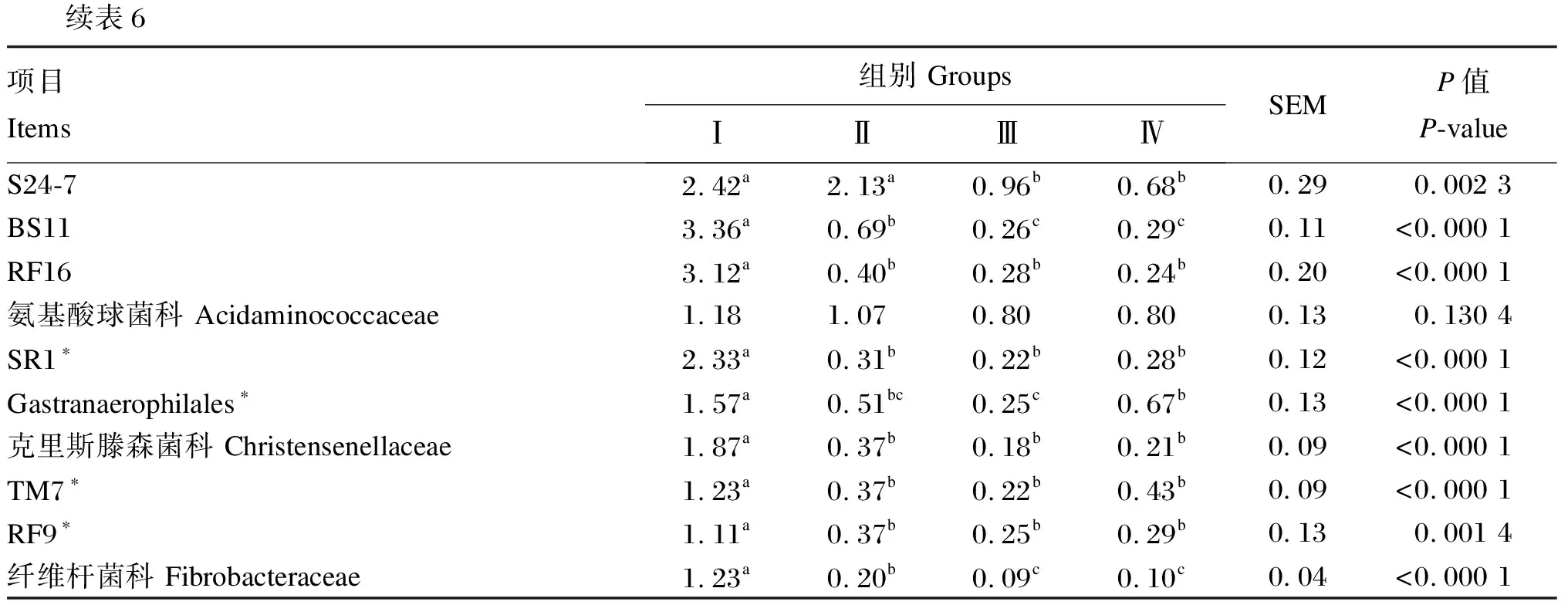
续表6项目Items组别 GroupsⅠⅡⅢⅣSEMP值P-valueS24-72.42a2.13a0.96b0.68b0.290.002 3BS113.36a0.69b0.26c0.29c0.11<0.000 1RF163.12a0.40b0.28b0.24b0.20<0.000 1氨基酸球菌科 Acidaminococcaceae1.181.070.800.800.130.130 4SR1∗2.33a0.31b0.22b0.28b0.12<0.000 1Gastranaerophilales∗1.57a0.51bc0.25c0.67b0.13<0.000 1克里斯滕森菌科 Christensenellaceae1.87a0.37b0.18b0.21b0.09<0.000 1TM7∗1.23a0.37b0.22b0.43b0.09<0.000 1RF9∗1.11a0.37b0.25b0.29b0.130.001 4纤维杆菌科 Fibrobacteraceae1.23a0.20b0.09c0.10c0.04<0.000 1
*表示细菌分类只进行到了门、纲、目水平,在科水平未分类。
* mean that the taxonomy of bacteria only went to the level of the phyla, class and order, bacteria was not classified at the level of family.
图1为样本OTU水平偏最小二乘法判别分析(PLS-DA),样本点的空间距离代表样本间的距离。由图可知,主成分COMP1和COMP2在样品差异性贡献率上分别为42.60%和7.35%,其中Ⅰ组与其他3组被主成分COMP1所分开;Ⅱ组与Ⅲ、Ⅳ组被主成分COMP2所分开;Ⅲ组与Ⅳ组样本具有一定的相似性。
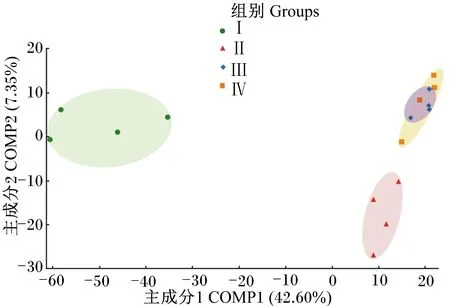
图1 瘤胃细菌OTU水平PLS-DAFig.1 PLS-DA of rumen bacteria at OTU level
3 讨 论
前人研究发现,反刍动物在不同生理阶段瘤胃细菌的多样性和丰度会发生改变。郭伟[4]研究山羊从7日龄到1.5岁瘤胃细菌丰度与多样性变化时发现,山羊在7日龄时瘤胃细菌OTU数目、Chao1指数与香农指数最高,即物种丰度与多样性最高,在3月龄时香农指数最低,在1岁时Chao1指数最低。而Jami等[5]研究发现,荷斯坦牛从1日龄到2岁瘤胃细菌OTU数目与香农指数逐渐增加。本试验通过多样性分析得出围产前期奶牛瘤胃细菌的OTU数目、Ace指数、Chao1指数与香农指数显著高于泌乳期奶牛,辛普森指数显著低于泌乳期奶牛,这可能由于围产前期与泌乳期饲粮组成与营养水平不同所致。与之相比,奶牛在泌乳期各个阶段的饲粮组成与营养水平变化较小,尤其在泌乳前期与泌乳中期饲粮泌乳净能(6.85 MJ/kg vs. 6.92 MJ/kg)、粗蛋白质(16.91% vs. 17.38%)和NDF含量(28.91% vs. 28.69%)接近,但泌乳前期奶牛瘤胃细菌丰度指数中的Ace指数和Chao1指数以及多样性指数中的香农指数却显著高于泌乳中期奶牛,这可能与奶牛在不同泌乳阶段体内激素水平不同有密切的关系。此外,通过综合分析奶牛各生理阶段营养水平与瘤胃MCP浓度的变化规律可以看出,奶牛在泌乳前期与泌乳中期营养水平接近,但泌乳前期瘤胃MCP浓度显著高于泌乳中期,这表明泌乳阶段的改变会影响奶牛瘤胃微生物区系。
反刍动物在不同生理阶段瘤胃细菌组成存在较大差异。郭伟[4]研究山羊从7日龄到1.5岁瘤胃细菌组成结构变化时发现,拟杆菌门的相对丰度先逐渐升高,后逐渐下降,最后趋于平稳,而变形菌门相对丰度的变化趋势与之相反,厚壁菌门的相对丰度无显著差异。Jami等[5]研究指出,荷斯坦牛从1日龄到2岁瘤胃细菌拟杆菌门的相对丰度逐渐升高,变形菌门的相对丰度逐渐降低,厚壁菌门的相对丰度先降低后升高。家畜在妊娠阶段由于子宫的生长会影响胃动力以及肠道运动,引发胃肠道功能紊乱[13],胃肠道内的微生物组成结构也随之发生改变。研究表明,随着动物妊娠的进行,肠道细菌的多样性随之降低[14-16]。Kong等[16]研究环江香猪在不同妊娠阶段肠道细菌组成时发现,随着妊娠的进行,肠道细菌中棒状杆菌属、不动杆菌属与Allobaculum细菌的相对丰度显著降低。但也有证据表明,动物在某些特定的生理阶段之间肠道细菌组成差异较小。Koren等[15]研究表明,女性在妊娠前3个月肠道细菌组成与未妊娠期十分接近。Jost等[17]研究指出,女性妊娠晚期与泌乳早期肠道微生物组成差异很小。本试验得出奶牛在不同生理阶段瘤胃细菌优势菌门为拟杆菌门、变形菌门和厚壁菌门,且厚壁菌门的相对丰度在各个生理阶段无显著变化,此结果与郭伟[4]研究结果相似。泌乳期各个阶段瘤胃细菌组成十分接近,此结果与Koren等[15]研究结果相似。
饲粮结构的改变将直接影响奶牛瘤胃细菌的组成。前人研究表明,随着饲粮精料比例的提高,纤维降解菌和真菌数量逐渐减少,当精料增加到一定比例时,瘤胃内的低pH环境会使纤维降解菌的生长受到抑制[18-19]。Mao等[20]研究表明,在饲喂高精料饲粮的奶牛瘤胃内,厚壁菌门和放线菌门细菌的比例则较高,而变形菌门和拟杆菌门细菌的比例较低。Kocherginskaya等[21]研究得出,在高精料饲粮条件下,奶牛瘤胃细菌中的变形菌门占据优势地位。林波等[22]比较研究了饲喂全粗料、低精料和中等精料的水牛瘤胃细菌组成差异,结果表明随着精料比例的增加,瘤胃细菌中厚壁菌门和变形菌门的相对丰度随之增加,而拟杆菌门的相对丰度随之降低;在科的水平上,随着精料比例的增加,普雷沃氏菌科、毛螺菌科和瘤胃球菌科的相对丰度随之升高。在本试验中,泌乳期奶牛瘤胃细菌在门水平上相对丰度最高的是变形菌门,这与前人的研究报道相一致。此外,泌乳期奶牛与围产前期奶牛相比,瘤胃细菌中变形菌门的相对丰度显著升高,拟杆菌门的相对丰度显著降低,此结果表明在泌乳期高精料的饲粮条件下,利于变形菌门细菌繁殖,不利于拟杆菌门细菌繁殖。在科的水平上,本试验中奶牛瘤胃内普雷沃氏菌科是各个生理阶段的优势菌科,且其相对丰度在围产前期显著高于泌乳期。其原因可能是普雷沃氏菌科中含有较多高活性的半纤维素降解菌,对分解蛋白质和碳水化合物有较强能力[23],普雷沃氏菌科在高粗饲料中含量较高,表明该科的细菌与纤维消化密切相关,在围产前期粗饲料较高的饲粮条件下,该菌科大量繁殖。而泌乳期奶牛瘤胃细菌中琥珀酸弧菌科的相对丰度显著高于围产前期,原因可能是琥珀酸弧菌科中存在较多淀粉降解菌和蛋白质降解菌,可在高精料饲粮条件下大量繁殖。
4 结 论
奶牛从围产前期进入到泌乳期,瘤胃细菌多样性显著降低;泌乳期各阶段瘤胃细菌组成差异较小。

