黄曲霉毒素B1对断奶仔猪生长性能、肝脏组织及肠道健康的影响
毕小娟 陈代文 余 冰 何 军 毛湘冰 郑 萍 黄志清 罗钧秋 罗玉衡 虞 洁
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,成都 611130)
黄曲霉毒素B1(AFB1)是一类毒性极强的霉菌毒素[1]。AFB1污染造成的饲料原料浪费和动物生产性能下降给畜牧业带来了巨大的经济损失。动物采食被AFB1污染的饲粮后,80%黄曲霉毒素在胃肠道前端快速通过被动运输被机体吸收,后转入肝脏进行代谢,从而出现肝脏损伤、食欲降低以及生长性能下降等中毒现象[2]。肠道作为AFB1吸收的主要部位,毒素浓度远高于其他部位,但是关于AFB1对胃肠道的影响研究知之甚少。肠道健康是人和动物健康的关键因素,AFB1降低动物生产力是否是通过损伤肠道健康来实现还有待研究。而目前关于AFB1研究所用材料多数采用自然霉变玉米,其中含有多种毒素可相互作用,不利于深入认识AFB1的毒性效应和机理。而对单一AFB1研究还较少,且所得结果差异较大。因此,本试验将培养黄曲霉菌制备的AFB1添加到断奶仔猪饲粮中,旨在考察饲粮添加0.3 mg/kg AFB1对断奶仔猪生长性能、肝脏组织及肠道健康的影响,以期为深入认识AFB1毒性机理研究提供参考资料。
1 材料与方法
1.1 黄曲霉毒素的培养和检测
黄曲霉毒素的培养包括菌种活化、接种、发酵和收毒4个过程。1)活化:采用购自中国工业微生物菌种保存中心的黄曲霉产毒菌株ATCC28539经过马铃薯葡萄糖琼脂(PDA)培养基于28 ℃培养箱中培养5~8 d活化长出绿色孢子;2)接种:用10 mL 0.05%灭菌的吐温20溶液冲洗PDA培养基中的黄曲霉孢子成孢子悬液,吸取4 mL孢子悬液接种于灭菌的大米培养基中;3)发酵:搅拌均匀后,25~28 ℃静置培养8~12 d至绿色孢子长出,培养前3 d需隔8~12 h搅拌1次。4)收毒:所得黄曲霉毒素培养完毕后,向锥形瓶内加入三氯甲烷淹没和打湿长满黄曲霉的培养基,4 ℃避光保存24 h或过夜后,于通风橱65 ℃挥干氯仿,最后将培养基烘干、粉碎、装袋,避光保存(此过程需要佩戴口罩或防毒面具)。
1.2 含黄曲霉毒素饲粮的制备和检测
参照国标法将培养的黄曲霉毒素进行检测,具体操作方法依照酶联免疫吸附试验(ELISA)试剂盒(购自江苏省苏微微生物研究有限公司)说明书进行,发酵所得AFB1的含量为400 mg/kg。
然后按比例将培养的AFB1添加至基础饲粮中,按照0.3 mg/kg AFB1计算,每吨饲粮中需加入0.75 kg发酵黄曲霉毒素替代部分玉米与之逐级混匀。饲粮中毒素含量则用高效液相色谱法测得,其中黄曲霉毒素含量用GB/T 30955—2014免疫亲和柱净化-高效液相色谱法测定;呕吐毒素(脱氧雪腐镰刀菌烯醇)含量用GB/T 30956—2014免疫亲和层析净化-高效液相色谱法测定;玉米赤霉烯酮含量用GB/T 28716—2012免疫亲和层析净化-高效液相色谱法测定;赭曲霉素A含量用GB/T 30957—2014免疫亲和层析净化-高效液相色谱法测定;伏马毒素含量用GB/T 25228—2010免疫亲和层析净化-高效液相色谱法测定;T-2毒素含量用GB/T 23501—2009免疫亲和层析净化-高效液相色谱法测定。经测定,饲粮中AFB1含量为363.3 μg/kg,黄曲霉毒素B2(AFB2)含量为34.6 μg/kg,黄曲霉毒素G1(AFG1)和黄曲霉毒素G2(AFG2)未检测到,而常见霉菌毒素都未超标,检测具体结果见表1。
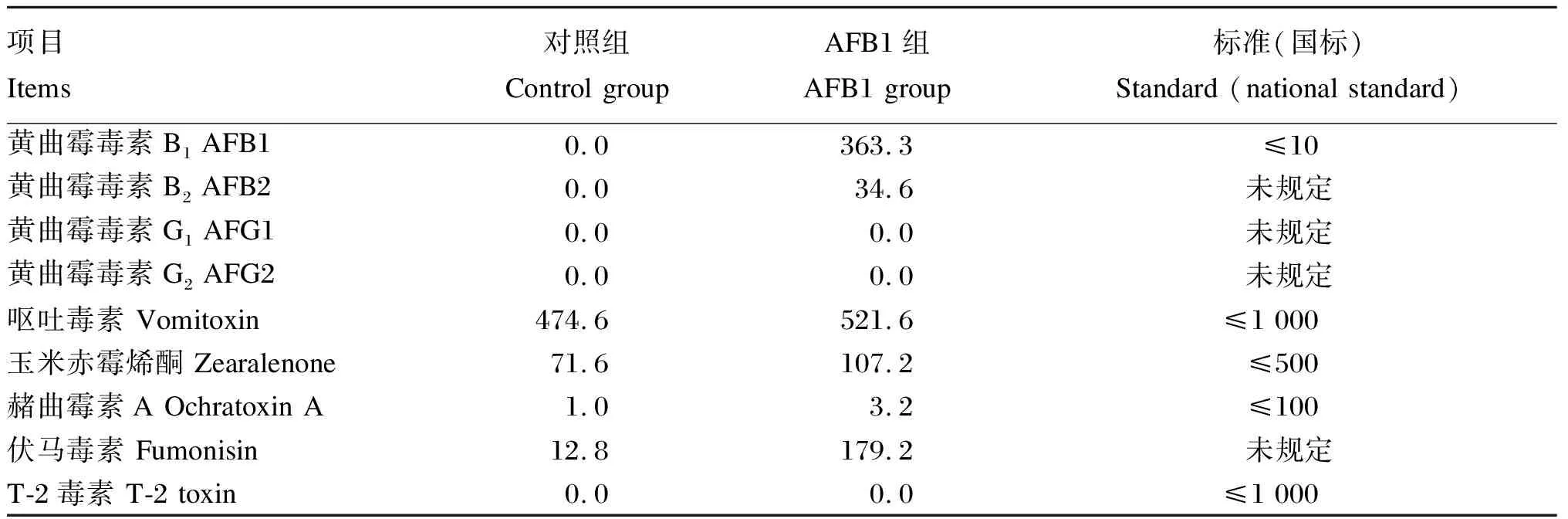
表1 饲粮中常见霉菌毒素的含量(实测值)Table 1 Common mycotoxin contents in diets (measured values) μg/kg
1.3 试验动物与试验设计
试验选用32头胎次相近、21日龄的“杜长大”断奶仔猪,根据体重相近原则随机分为2组(每组16个重复,每个重复1头猪),分别饲喂基础饲粮(对照组)和含有0.3mg/kgAFB1的饲粮(AFB1组)。预试期3 d,正试期21 d。
1.4 基础饲粮
基础饲粮参照NRC(2012)仔猪营养需要标准并结合实际配制,其组成及营养水平见表2。
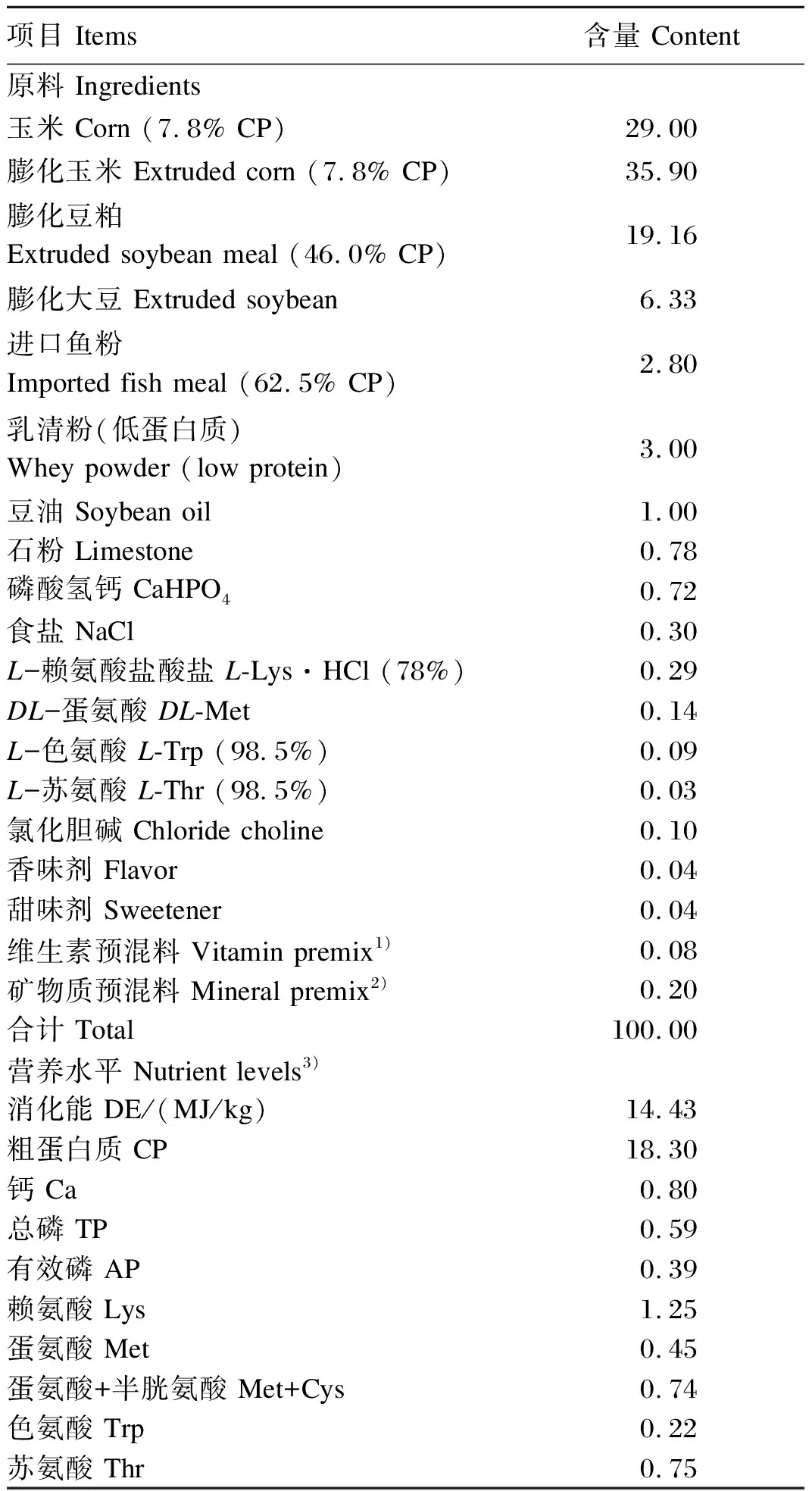
表2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet (air-dry basis) %
1)维生素预混料为每千克饲粮提供 Vitamin premix provided the following per kg of the diet:VA 8 000 IU,VD32 000 IU,VE 20 IU,VK32 mg ,VB11.5 mg,VB25.6 mg,VB120.02 mg,VB61.5 mg,D-泛酸D-pantothenic acid 10 mg,烟酸 nicotinic acid 15 mg,生物素biotin 0.1 mg,叶酸 folic acid 0.6 mg。
2)矿物质预混料为每千克饲粮提供 Mineral premix provided the following per kg of the diet:Fe (FeSO4·H2O) 100 mg,Cu (CuSO4·5H2O) 150 mg,Mn (MnSO4·H2O) 20 mg,Zn (ZnSO4·H2O) 100 mg,I (KI) 0.3 mg,Se (Na2SeO3) 0.3 mg。
3)营养水平为计算值。Nutrient levels were calculated values.
1.5 饲养管理
试验在四川农业大学动物营养研究所科研基地仔猪舍进行。动物饲养管理按断奶仔猪饲养管理方式进行。预试期3 d,正式试验每天饲喂4次(08:00、12:00、16:00和20:00),每次喂料量以吃饱后饲槽内略有余料为宜,采用自由饮水、自由采食和少喂勤添的原则。于正式试验当天早晨空腹称重分组,正式试验后在第22天早上进行称重。每组选取6头和全组平均体重相近的猪只进行采血屠宰取样。
1.6 样品采集
饲粮样品:通过四分法采集饲粮样品,每组取300 g左右,装入样品袋并标记,送给北京中检维康公司检测黄曲霉毒素、玉米赤霉烯酮和呕吐毒素等6种常见霉菌毒素的含量。
肝脏样品:全部试验仔猪屠宰后迅速将肝脏完整取出称重,同时对肝脏同一部位取基因样迅速置于液氮中,后转移至-80 ℃保存待测。对肝脏另一部位取切片样置于4%多聚甲醛中保存待测。
肠道样品:将全部试验仔猪小肠的肠系膜解剖干净,并立即放在冰块上,从幽门到Treitz韧带的部分认为是十二指肠,小肠末端接近回盲连接部的10 cm为回肠,而小肠剩下的部分为空肠。取十二指肠、空肠、回肠和盲肠食糜,装于灭菌冻存管迅速置于液氮中,后转移至-80 ℃保存待测。取十二指肠、空肠、回肠中部部分(各4 cm),放置在4%多聚甲醛中保存检测。
1.7 检测指标及方法
1.7.1 生长性能
于试验的第1天和第22天08:00空腹称量全部试验猪只体重,准确记录好每天的给料量、剩余料和浪费料量,计算仔猪的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.7.2 肝脏指数
肝脏指数(g/kg)=肝脏重量(g)/活体重(kg)。
1.7.3 组织形态学观察
将置于4%多聚甲醛固定液中的肝脏、十二指肠、空肠和回肠组织经干燥脱水、浸蜡包埋及切片等处理,再经苏木精-伊红(HE)染色,采用Leica DM1000显微成像系统对结果进行拍照,观察组织病理学变化,用ImageProPlus 6.0选取10个最典型的视野测定肠道绒毛高度和隐窝深度进行测量在显微镜下进行观察,并计算绒毛高度/隐窝深度(V/C)值。样品在成都里来生物公司测定。
1.7.4 肝脏代谢相关基因mRNA表达量测定
提取肝脏总RNA,具体参照TaKaRa RNAiso Plus说明书进行,然后进行反转录,具体参照TaKaRaPrimeScriptTMRT reagent Kit说明书进行,实时荧光定量PCR则参照SYBR Premix Ex Taq Ⅱ说明书、采用10 μL体系进行,包括SYBR Premix Ex Taq Ⅱ(TliRNaseH Plus)(2×) 5.0 μL,ROX Reference Dye Ⅱ(50×) 0.2 μL,DNA模板1.0 μL,上、下游引物各0.4 μL和3.0 μL ddH2O。实时荧光定量PCR的反应条件:95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;40个循环。熔解曲线反应程序为,95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。β-肌动蛋白(β-actin)作内参基因,采用2-△△Ct方法计算各基因的相对表达量。
引物序列设计利用NCBI搜索目的基因片段,运用Primer 3进行引物设计,于生工生物工程(上海)股份有限公司合成。各基因具体引物序列见表3。

表3 基因引物序列Table 3 Primer sequences of genes
1.7.5 肠道食糜微生物菌群的数量
测定回肠、盲肠食糜微生物菌群数量采用反转录-PCR(RT-PCR)技术,以每克内容物为检测单位,通过Ct值与标准曲线计算得出每份样品所含拷贝数,结果用每克内容物中细菌拷贝数的常用对数[lg(CFU/g)]表示。食糜DNA提取采用E.Z.N.A Stool DNA Kit试剂盒(Omega,美国)进行。PCR条件:95 ℃,10 s;95 ℃,5 s;最佳退火温度,25 s;40个循环;95 ℃,10 s。熔解曲线:65~95 ℃,温度以0.5 ℃/s提升。检测乳酸杆菌、大肠杆菌和芽孢杆菌采用20 μL反应体系,包括Probe Ehance Solution 1 μL,Real Mater Mix 8 μL,上、下游引物各1 μL,DNA模板1 μL,探针0.3 μL和ddH2O 7.7 μL;检测双歧杆菌采用20 μL反应体系,包括Probe Ehance Solution 1 μL,Real Mater Mix 8 μL,DNA模板1 μL,上、下游引物各1 μL、探针0.8 μL和7.2 μL ddH2O;检测总菌采用25 μL反应体系:SYBR Premix Ex Taq(2×) 12.5 μL,上、下游引物各1 μL,DNA模板1 μL和9.5 μL ddH2O。以上Probe Ehance Solution和Real Mater Mix是北京天根生化科技有限公司的探针Mix试剂盒里的2种试剂。
1.8 数据处理
试验数据采用Excel 2007进行整理,采用SPSS 19.0软件进行t检验,结果以平均值±标准误表示,P<0.05表示差异显著。
2 结 果
2.1 AFB1对断奶仔猪生长性能的影响
由表5可知,与对照组相比,AFB1组试验猪ADG降低了23.81%,差异显著(P<0.05),ADFI降低了15.66%(P=0.09),F/G显著提高(P<0.05)

表4 RT-PCR引物序列及退火温度Table 4 Primer sequences and annealed temperature for RT-PCR[3]
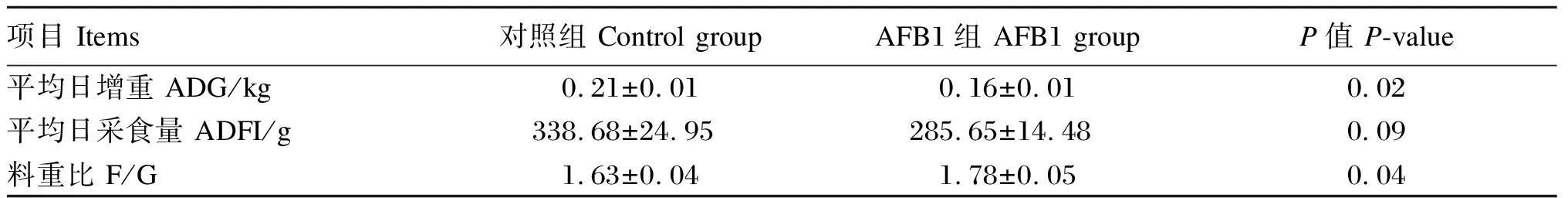
表5 AFB1对断奶仔猪生长性能的影响Table 5 Effects of AFB1 on growth performance of weaned piglets
2.2 AFB1对断奶仔猪肝脏的影响
2.2.1 AFB1对断奶仔猪肝脏指数的影响
由图1可知,与对照组相比,AFB1组断奶仔猪肝脏指数显著提高(P<0.05)。
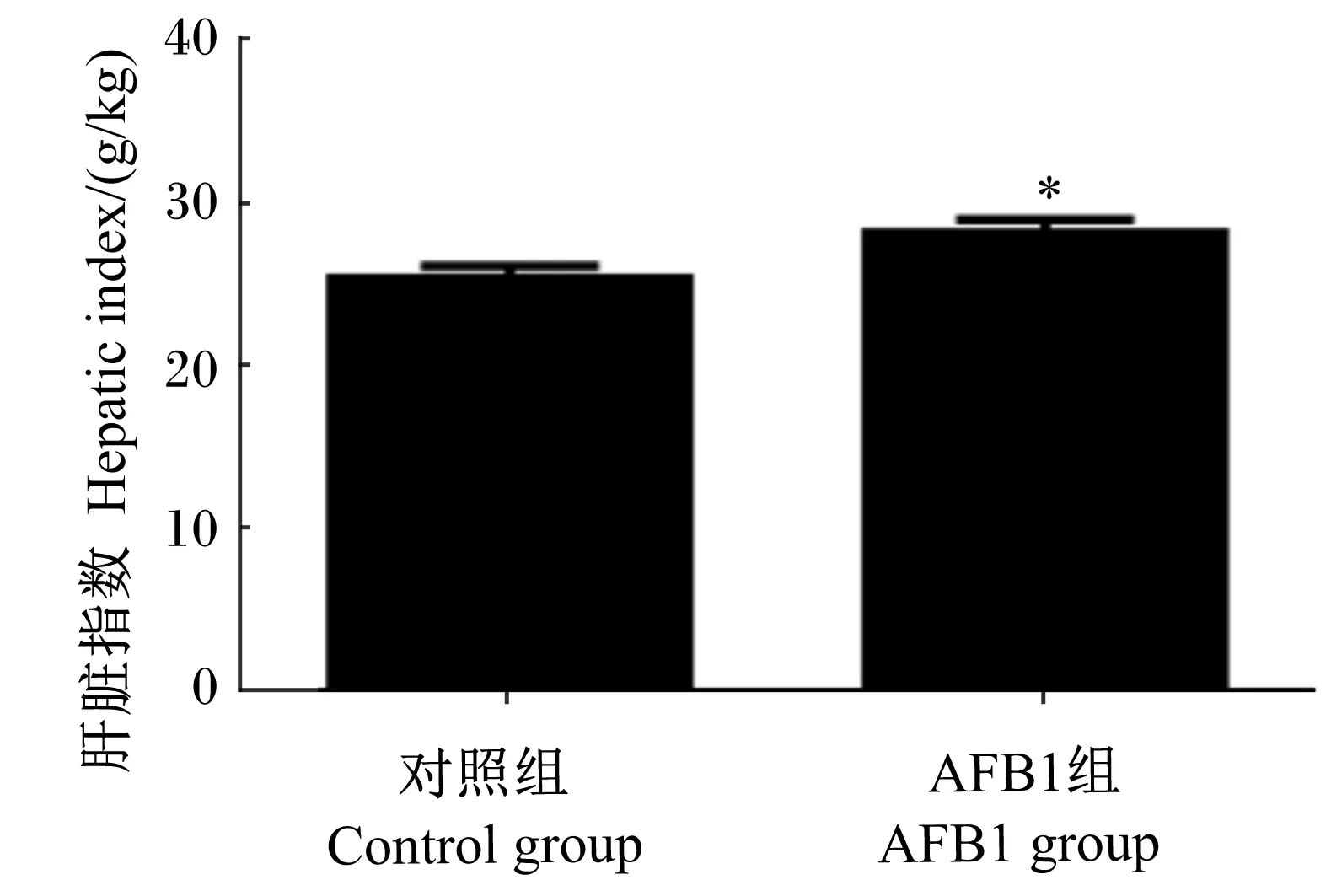
*表示差异显著(P<0.05)。* mean significantly different (P<0.05).
图1AFB1对断奶仔猪肝脏指数的影响
Fig.1 Effect of AFB1 on hepatic index of weaned piglets
2.2.2 AFB1对断奶仔猪肝脏形态的影响
由图2可知,与对照组相比,AFB1组仔猪肝小叶结构不清晰,肝细胞中度水肿变性,部分出现中、重局灶状坏死,肝纤维组织增生明显。
2.2.3 AFB1对断奶仔猪肝脏脂肪代谢相关基因mRNA表达量的影响
由表6可知,与对照组相比,AFB1组乙酰辅酶A羧化酶-1(ACC-1)、脂肪酸合成酶(FAS)、肉毒碱棕榈酰转移酶-1(CPT-1)、脂蛋白脂肪酶(LPL)和过氧化物酶体增殖物激活受体α(PPARα)的mRNA表达量无显著差异(P>0.05)。
2.3 AFB1对断奶仔猪肠道健康的影响
2.3.1 AFB1对断奶仔猪肠道形态结构的影响
由表7可知,与对照组相比,AFB1组十二指肠绒毛高度和隐窝深度显著增加(P<0.05),空肠隐窝深度显著降低(P<0.05),回肠的绒毛高度、隐窝深度和V/C值都无显著差异(P>0.05)。
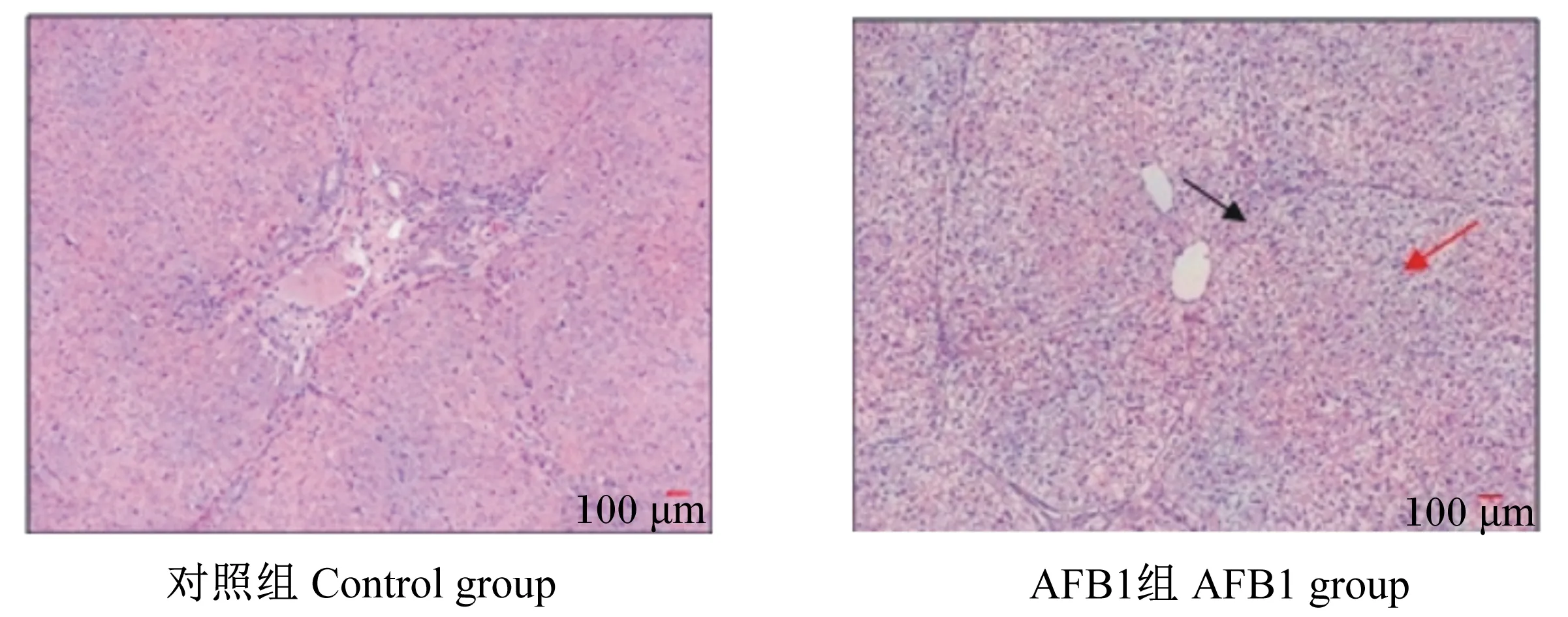
AFB1组上方箭头表示肝小叶,下方箭头表示肝细胞。
Upper arrow of AFB1 group mean hepatic lobule, and lower arrow mean hepatocyte.
图2AFB1对断奶仔猪肝脏组织结构的影响
Fig.2 Effect of AFB1 on organizational structure of liver of weaned piglets
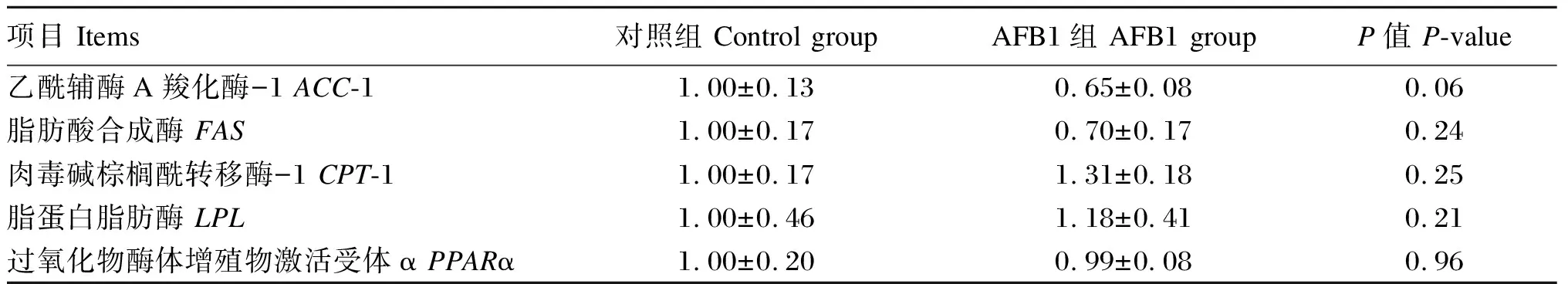
表6 AFB1对断奶仔猪肝脏脂肪代谢相关基因mRNA表达量的影响Table 6 Effects of AFB1 on lipometabolism-related gene mRNA expression in liver of weaned piglets
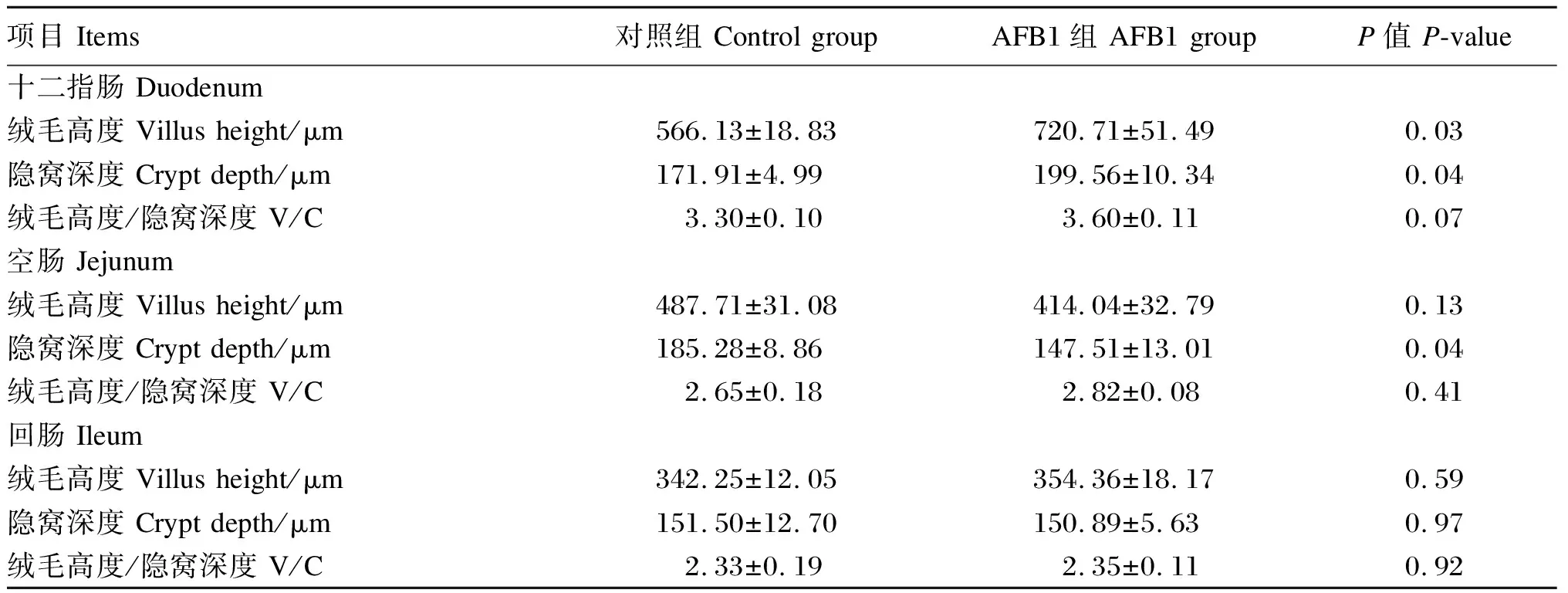
表7 AFB1对断奶仔猪小肠形态结构的影响Table 7 Effects of AFB1 on intestinal morphology of weaned pigs
2.3.2 AFB1对断奶仔猪肠道微生物数量的影响
由表8可知,与对照组相比,AFB1组盲肠双歧杆菌数量显著降低(P<0.05),但盲肠总菌、大肠杆菌、乳酸杆菌和芽孢杆菌数量均无显著差异(P>0.05),且回肠微生物数量均无显著差异(P>0.05)。
3 讨 论
Grenier等[4]用Meta分析得出现在研究AFB1时常用剂量为0.3~2.0 mg/kg,其中0.3 mg/kg是介于正常情况和天气不佳时容易发生AFB1的临界值,故本试验选用的AFB1剂量为临界值0.3 mg/kg。此外,本试验在Shotwell等[5]的发酵方法上进行条件改造所得AFB1,其含量用目前国际上普遍采用的定量检测黄曲霉毒素方法(免疫亲和柱净化-高效液相色谱法)测定[6]。结果表明试验所用毒素91%黄曲霉毒素为AFB1,饲粮中其他霉菌毒素都未见超标,说明此发酵培养方法获得的AFB1纯度很高且不适宜其他霉菌毒素生长,适合单一AFB1研究。
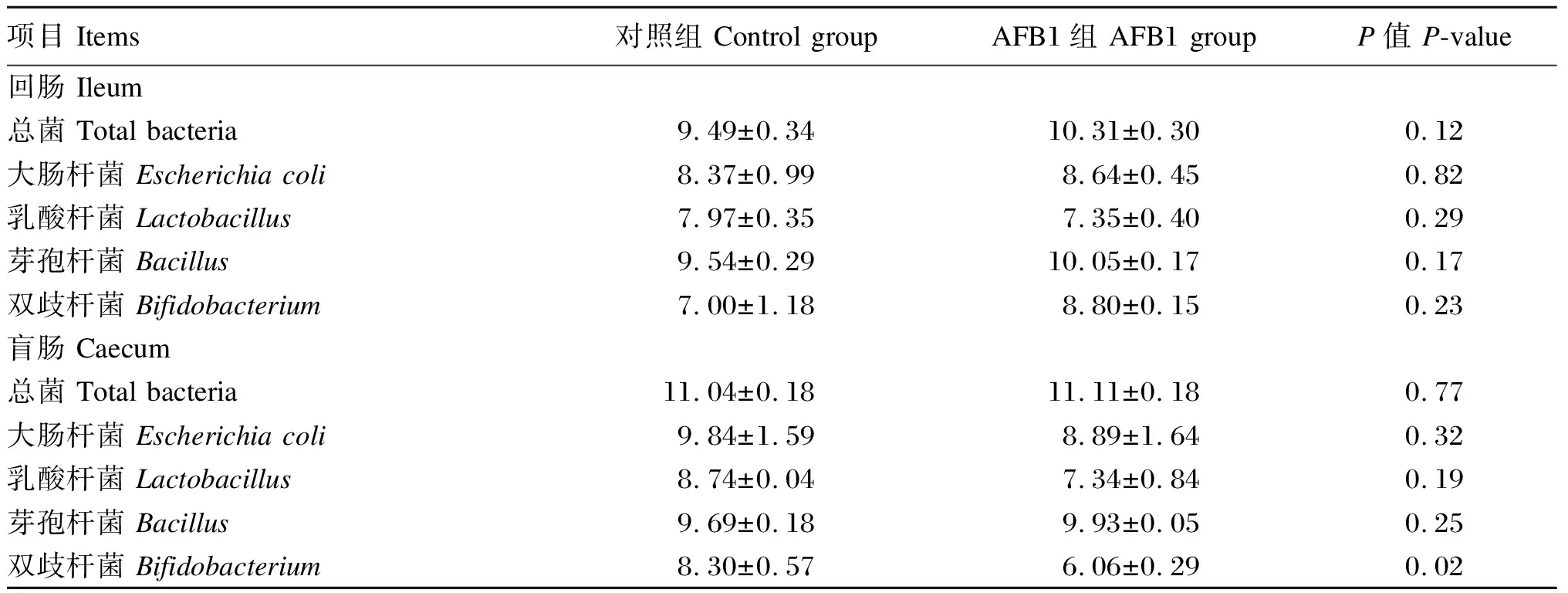
表8 AFB1对断奶仔猪肠道微生物数量的影响Table 8 Effects of AFB1 on intestinal microflora amounts of weaned piglets lg(CFU/g)
AFB1作为一级致癌物质,其中毒主要症状是阻碍猪的生长发育和对营养物质的吸收,造成动物亚健康导致饲料的浪费和上市时间的延长,从而造成经济损失[7]。研究表明,AFB1能不同程度降低猪ADFI和ADG,提高饲料转化率,且年龄越小、剂量越高、时间越长,AFB1对动物损伤就越大[2]。本试验结果表明AFB1显著降低仔猪ADG,有降低ADFI的趋势,且显著提高F/G,说明0.3 mg/kg AFB1会抑制仔猪的生长。但本试验结果与Rustemeyer等[8]用剂量0.25 mg/kg饲喂生长阉公猪的结果不一致,其在第5周开始出现ADFI显著下降,对ADG无显著影响,而本试验中,0.3 mg/kg AFB1的毒性效应在前2周就体现,可能原因是动物日龄越大,对AFB1的耐受力越强。
肝脏是代谢的主要场所,也是AFB1的主要靶器官。有研究表明,AFB1会通过增加肝脏的重量,影响肉鸡的生长性能[9]。本试验AFB1显著增加了肝脏指数,且病理切片结果发现,AFB1造成肝小叶结构不清晰,肝细胞中度水肿变性,部分出现中、重局灶状坏死,肝纤维组织增生明显,说明AFB1对肝脏造成了病理损伤。此外,有研究表明,AFB1降低脂肪代谢基因PPARα的表达,可能导致脂肪代谢紊乱而增加肝脏脂肪的堆积[10]。所以本试验测定了肝脏代谢相关基因,但结果无显著差异。结合HE染色结果(图2)分析,AFB1造成肝脏相对重量增加可能是线粒体氧化酶系统受损的组织学变化结果。当肝脏受损时,肝细胞的线粒体氧化酶系统被破坏,ATP生成减少,细胞膜的钠泵障碍,导致细胞内钠离子增多,水分进入细胞增多,细胞肿大或形成水泡变性[11-12]。
小肠绒毛高度、隐窝深度、V/C值是衡量小肠消化吸收能力的重要指标。隐窝深度可以反映隐窝细胞的增殖率和成熟度,而肠道绒毛高度则可以间接反映肠黏膜吸收细胞和分泌细胞比例及肠黏膜对营养物质的吸收能力[13]。本试验中,AFB1能显著增加十二指肠绒毛高度和隐窝深度,对V/C值也有增加的趋势,显著降低空肠的隐窝深度,表明AFB1能改变肠道形态,影响肠道正常发育和功能,这与冯光德[13]结果一致。这可能是由于80% AFB1在胃肠道前端通过被动运输被机体吸收,其中50%在十二指肠被吸收[4]。为降低细胞内外AFB1浓度差,十二指肠绒毛高度增加。但是AFB1会降低细胞的合成[13],所以隐窝细胞生成率和分泌率下降,增加十二指肠隐窝深度。而本试验中AFB1能降低空肠隐窝深度,可能是AFB1造成机体代谢紊乱的一种补偿效应。
肠道微生物对动物健康有重要影响,破坏其生态平衡可能会损害宿主的健康。有研究表明,250 μg/kg BW的AFB1能显著降低雄性昆明小鼠盲肠食糜乳酸菌、双歧杆菌和总厌氧菌等肠道有益菌的数目,从而造成肠道菌群失调[12]。本试验结果与Ezz El-Arab等[14]研究结果一致,其发现AFB1能显著降低后肠双歧杆菌的数目,说明AFB1对肠道微生物稳态的影响可能主要是降低有益菌的数目。此外,肝脏的功能状态与肠道微生态平衡息息相关[13],它能够代谢转化来自肠道的有害物质以及分泌游离型胆汁酸调节后肠pH,维持肠道菌群平衡[15-16],所以肠道微生物的变化也可能与AFB1损伤肝脏有关。
4 结 论
饲喂含有0.3 mg/kg AFB1的饲粮会导致断奶仔猪生长性能下降,肝脏组织和肠道健康轻微受损。

