微生物中苹果酸脱氢酶研究现状及展望
肖景惠,张庆芳,于 爽,逄 飞,迟乃玉,王梦雨*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
苹果酸脱氢酶(malate dehydrogenase,MDH)是三羧酸循环(tricarboxylic acid cycle,TCA)中重要的氧化还原酶,催化L-苹果酸脱氢变成草酰乙酸的酶。至今已有多种MDH得到分离纯化并获得晶体结构[1]。根据MDH亚细胞定位、辅酶特异性以及功能的不同,MDH被分为三大类:第一类是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)-线粒体苹果酸脱氢酶(mitochondrial malate dehydrogenase,mMDH)类型,主要参与真核微生物线粒体中的三羧酸循环或乙醛酸循环;第二类是NAD-胞质苹果酸脱氢酶(cytosol malate dehydrogenase,cMDH)类型,主要参与原核生物细胞质中的TCA循环或乙醛酸循环,并且参与真核微生物细胞质苹果酸-天冬氨酸穿梭途径,负责将细胞质中还原态烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)的H+传递给草酰乙酸,使草酰乙酸转变为苹果酸[2]。第三类是烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)NADP-MDH类型,主要存在于谷氨酸棒状杆菌(Corynebacterium glutamicum)和黄曲霉属微生物[3]。除以上类别的MDH外,研究发现古细菌中的MDH对NAD+和NADP+都具有亲和力[4]。动力学特性分析显示,细胞质MDH活性高于线粒体MDH,而线粒体MDH活性高于细胞质MDH,且不同细胞器中的MDH有各自不同的生理作用[5]。研究发现,在真核微生物中,MDH只有同源二聚体一种结构形式[6],但除了部分革兰氏阳性菌和古细菌中的MDH以四聚体形式存在外[3],在大部分细菌的MDH以同源二聚体形式存在[7]。
MDH除进行氧能量代谢作用外,还参与C4循环,糖异生,脂肪酸的氧化,氮同化,氨基酸的合成等各种代谢活动[8]。由于其在多种生化代谢中发挥作用,MDH广泛应用于心肌梗塞、急性实质性肝损伤、肝癌、肺癌的早期诊断,是常用的临床诊断用酶,并在生物制药、化工检测等领域也具有广泛应用。该文介绍了微生物中MDH的蛋白结构、催化机制以及活性调节,并对其酶学性质、医疗诊断及免疫领域的应用、工业领域的应用以及生产方面,阐述了苹果酸脱氢酶的研究进展,以期为苹果酸脱氢酶的进一步开发和利用提供参考。
1 微生物苹果酸脱氢酶的三级结构
研究表明[9],MDH的氨基酸序列在一级结构上表现出较低的相似性,多数相似性不到20%。结合核酸、催化底物以及与亚基的界面结构相关的几个功能性结构会由较少的几个保守的残基决定。但与较低的氨基酸序列相似不同,原核微生物和真核微生物MDH的晶体结构非常相似[10],MDH的晶体结构见图1。
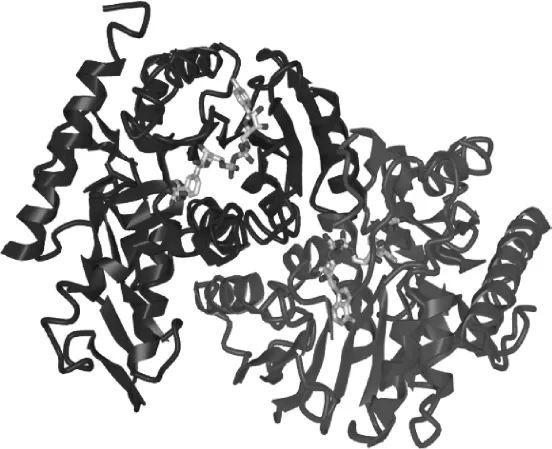
图1 苹果酸脱氢酶的三维结构[9]Fig.1 Three-dimensional structure of malate dehydrogenase
2 微生物苹果酸脱氢酶的催化机制
酶动力学研究显示[11],MDH所催化L-苹果酸与草酰乙酸的反应过程中,MDH先结合NAD(H)+,再结合二羧酸底物苹果酸或者草酰乙酸。MDH催化苹果酸羟基的H+定向地结合到NAD(P)+,实现L-苹果酸与草酰乙酸二者之间的可逆转换。
不同来源的MDH一级结构氨基酸序列相似性较低,但辅酶结合位点、核苷酸结合位点及催化活性位点高度保守[12]。其中MDH每个亚基的N端为辅酶核苷酸结合结构域(structurally domain),C端结构域是底物结合位点和催化位点在内的功能域(functionallydomian)。这两个结构之间的疏水裂缝存在MDH的活性中心,包含了底物和辅酶的结合位点[8]。当MDH与底物或辅酶在其特异性活性位点通过疏水性结合形成蛋白复合物,蛋白质构象发生改变,MDH空间的改变使得底物能够被最小化暴露在溶剂中并识别其附近的关键位点。其中三种关键的氨基酸残基分别为组氨酸(His)、天冬氨酸(Asp)和精氨酸(Arg),属于催化基团。在这个变化过程中,His与Asp结合形成离子对,位于活性中心,在反应过程中提供质子,Arg则主要起保护底物的作用[7]。具体机制见图2。
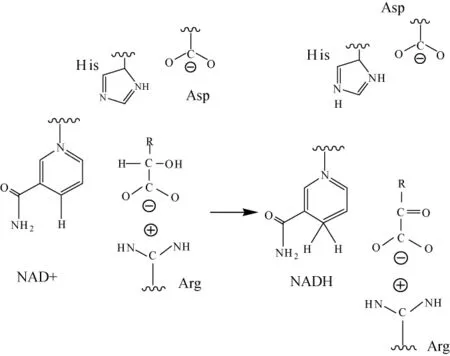
图2 苹果酸脱氢酶的催化机制[13]Fig.2 Catalytic mechanism of malate dehydrogenase
3 MDH活性调节
MDH活性受反馈抑制的调节,过量的草酰乙酸和NADH强烈抑制MDH活性。SETOYAMA C等[14]研究发现,来自闪烁古生球菌Archaeoglobus fulgidus,Salinibacter ruber和多糖孢菌Saccharopolyspora erythraea的MDH活性可以被高浓度草酰乙酸所抑制,当红霉菌在果糖中生长时,MDH活性在培养72 h达到最大值,而MDH在葡萄糖为碳源的培养过程中保持稳定。THOMPSON H等[15]研究发现,在产甲烷古细菌(Methanogenic archaea),嗜热古细菌(A.fulgidus)和大肠杆菌(Escherichia coli)中,NADH具有相同的抑制作用。此外,碳源的种类也是MDH活性调节的因素之一:MOLENAAR D等[16]研究发现,在谷氨酸棒杆菌中,MDH的活性均对以淀粉与蔗糖为碳源起反应,其中MDHs的活性分别比以葡萄糖为碳源时高3.4倍和3.1倍。在一些微生物中,MDH可与TCA循环中的其他酶相互作用,来促进底物与底物结合,从而增加活性。BARTHOLOMAE M等[17]在枯草芽孢杆菌(Bacillus subtilis)中研究发现,MDH与两种TCA循环酶:异柠檬酸脱氢酶和柠檬酸合成酶相互作用,酶活力大幅度提高。
4 微生物苹果酸脱氢酶的酶学性质
4.1 最适pH值
MDH广泛存在于自然界生物体内,具有较大的pH适应范围,研究显示在pH2.0~11.5范围内,MDH都具有一定的活性[18-20]。酵母的MDH在pH 8.1的时候酶活力最高,金霉素链霉菌(Streptomyces aureofaciens)的MDH最适pH一般在9.0左右,在假单胞菌(Pseudomonas)中,MDHs氧化苹果酸的最适pH为10左右[18]。李倩[19]以大肠杆菌基因组为模板克隆表达的MDH,在pH 2~6的范围内,其酶活比较稳定。刘俊[20]从嗜热栖热菌(Thermus thermophilus)HB27基因组中克隆了MDH的基因,并在大肠杆菌中成功地表达,纯化的酶具有pH的偏好性。在碱性环境中相对较稳定,它的最适反应pH值为11.5。结果表明,MDH具有较大的pH适应范围,且不同菌种中MDH的最适pH值具有显著差异。
4.2 最适温度及热稳定性
研究表明,大部分的MDH在温度为37~65℃范围内,都具有一定的活性[11-12]。如深黄被孢霉(Mortierellaisabllina)的MDH在37℃时酶活最高并较为稳定[11];大肠杆菌的MDH的最适反应温度为37℃。MDH在42℃以下较稳定,水浴保温1 h后酶活能保留50%以上[19];枯草芽孢杆菌的MDH最适温度约为50℃,但MDH的热稳定性较差,嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)的MDH在65℃有较好的稳定性并且酶活最高[12]。在趋向较高或较低温度时,大多数种属的MDH活力都有降低的趋势。而极端环境下的微生物在低温或高温环境中依然可以保持较高活力。研究表明[20-21],MDH的热稳定性与氢键数目、盐桥数目以及分子内部结构有关,增加二硫键或氢键可以改善MDH的热稳定性。如嗜热细菌Chlorobium tepidum和嗜温细菌Chlorobium vibrioforme的MDH热稳定存在差异,是由于嗜热细菌MDH的极性氨基酸残基在亚基之间形成更多的氢键。此外,研究显示醇类物质对MDH的热稳定也有一定程度的影响。在低温环境下,甘油可以作为维持MDH活性的优良稳定试剂。在高温环境下,环多醇和山梨醇能够有效维持MDH的活性。这可能是由于羟基基团和酶分子的相互作用,从而加强了MDH分子的疏水作用,使MDH受水分子的影响减小,进而提高了其热稳定性。
4.3 金属离子对MDH影响
通过对大肠杆菌MDH的影响研究表明[22],不同的金属离子对MDH活性的影响具有特异性。K+对酶活有明显的提高作用,Fe3+、Co2+和Ni2+对酶活的提高作用次之,Ca2+、Ba2+和Mg2+对酶活影响小。而Pb2+、和Cu2+表现出不同程度的抑制酶活作用,Ag2+、Hg2+和Zn2+对酶活有强烈的抑制作用。尤其需要提到的是,Ag2+和Hg2+抑制水平最强烈,当金属离子浓度为1 mol/L时,97%的MDH活性受到抑制。对嗜盐古菌的MDH研究显示[23],当电荷密度高时,MDH的折叠结构能被阴离子能有效稳定,而在低盐浓度下,MDH的折叠结构能被阳离子稳定,发挥与前者相同的作用。
5 微生物苹果酸脱氢酶的应用
5.1 医疗诊断及免疫领域的应用
MDH可测定血清中门冬氨酸氨基转移酶的活性以及血清中总CO2的含量,广泛用于心肌梗塞,急性实质性肝损伤,肝癌,肺癌的早期诊断。MDH作为一种重要的代谢酶,其作用并不局限于代谢调节,其还可与p53蛋白相互作用,影响肿瘤细胞周期、衰亡和凋亡[24]。此外,真菌MDH还可作为可筛选抗原表位和靶基因在疫苗开发和分子生物学诊断中得到了深入研究。董永亮[25]研究发现,布鲁氏菌的MDH是免疫原性蛋白,MDH抗体对布鲁氏菌入侵细胞有明显的抑制作用,推测MDH参与了布鲁氏菌入侵与黏附宿主细胞过程,这为布鲁氏菌相关诊断、治疗药物及疫苗的研发提供了理论基础。此外,钟毅[26]研究发现,白念珠菌耐药株MDH蛋白表达量低于敏感菌株,表明其表达水平与菌种耐药性存在一定关系,可作为白念珠菌感染人体的特异性检测靶点。HERNANDO F L等[27]研究发现,致病念珠菌病人感染血清可与白念珠菌抗原结合,而在正常人对照中没有此现象。综上所述,MDH是一种重要的医学诊断用酶,并且在疫苗研发和基因检测领域具有广阔的应用前景。
5.2 工业领域的应用
工业方面,MDH主要可应用于发酵过程中L-苹果酸、醋酸、柠檬酸的等有机酸的检测。
5.2.1 定量测定L-苹果酸
L-苹果酸广泛存在于各种酒制品、面包、果汁以及菜蔬制品中,是果酸中的最重要的成分之一。对于葡萄酒和啤酒的酿造工业中,L-苹果酸和L-乳酸是两项极为重要的监测指标。在葡萄酒和啤酒的发酵过程中,需要对发酵液中的L-苹果酸含量进行实时监测[28],在生产中,要对发酵进程进行全程监控。
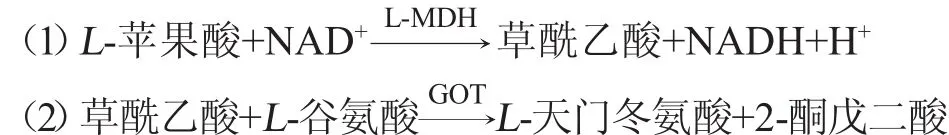
在L-苹果酸脱氢酶(MDH)的催化作用下,烟酰胺腺嘌呤二核苷酸(NAD+)氧化L-苹果酸,随后生成草酰乙酸,然后在反应体系中加入过量的L-谷氨酸,并在谷草转氨酶(glutamic-oxalacetic transaminase,GOT)的作用下,生成L-天门冬氨酸和2-酮戊二酸。利用上述(1)、(2)式进行偶联反应,以及在波长340nm处,NADH有特异性的吸收峰的特点,通过测定反应体系在波长340 nm处吸光度值的增加值,得到样品中L-苹果酸的含量。
5.2.2 定量测定发酵液中的醋酸[29]
醋酸作为工业生产中极其重要的影响参数,广泛存在于食品、饮料果汁、造纸、制药等其他工业产品中。因此,能够准确测定工业生产中醋酸的含量是关键。MDH便可以作为辅酶用于对其含量的测定。
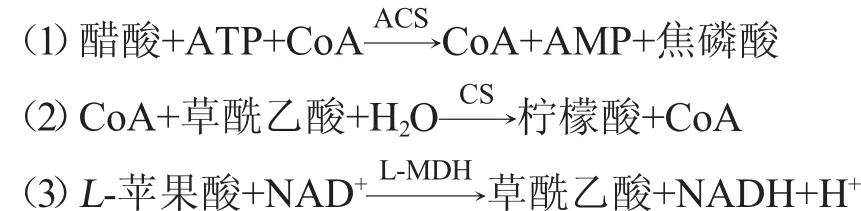
在乙酰辅酶A合成酶(acetyl-coenzymesynthetase,ACS)催化作用下,辅酶A催化醋酸转化为乙酰辅酶A(coenzyme A,CoA),并生成腺嘌呤核糖核苷酸(adenineribonucleotide,AMP)和焦磷酸,在乙酰辅酶A的作用下,乙酰辅酶A催化草酰乙酸生成柠檬酸,反应中的草酰乙酸是由L-苹果酸与NAD+在L-MDH催化下产生,其中NAD+被还原成NADH,生成的NADH的量与醋酸的量成正比,通过在波长340 nm条件下测定NADH的吸光度值计算醋酸的含量。
5.2.3 定量测定发酵液中的柠檬酸[30]
柠檬酸是一种常见的酸化剂,欧盟规定工业上酸化剂使用浓度的最高上限为1 g/L。同时,柠檬酸也可作为食用香料和防腐剂,现已经被广泛的应用于食品、果汁饮料、肉制品、造纸以及制药等工业生产中。此外,柠檬酸也是临床检验的一项重要指标。
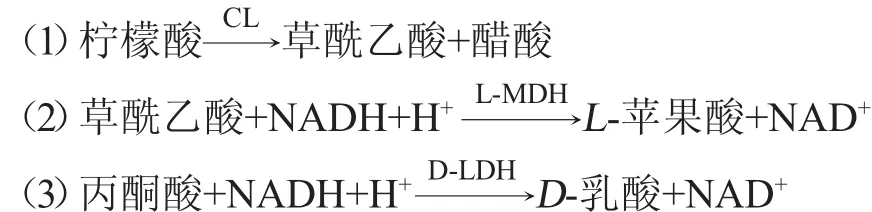
在柠檬酸裂解酶(citratelyase,CL)的催化作用下,使柠檬酸生成了草酰乙酸和醋酸。生成的草酰乙酸在L-MDH和NADH的共同作用下,生成L-苹果酸和NAD+。如果所测样品中存在草酰乙酸脱羧酶,一部分草酰乙酸在该酶的催化作用下转化生成丙酮酸。为了更加准确的测定柠檬酸的含量,需要使用D-LDH催化丙酮酸转化为D-乳酸和NAD+,生成的NAD+与柠檬酸的含量成反比,通过在波长340 nm处测定NADH吸光度值变化计算出柠檬酸含量。
6 微生物苹果酸脱氢酶的生产
微生物由于具有来源广泛、生长周期短等优点,是理想的MDH生产来源。现阶段,研究者一方面通过菌株诱变、优化菌株发酵条件等方法,获得MDH高产菌株;另一方面,通过基因重组等方法获得MDH高产菌株,并深入研究MDH的理化特性。BROWN S H等[31]在米曲霉(Aspergillus oryzae)和酿酒酵母(Saccharomyces cerevusiae)等微生物中,成功地高表达MDH,并发现其可以提高D-苹果酸的产量。刘俊[20]从嗜热菌株HB27中克隆获得Tt-MDHs基因,并在大肠杆菌中成功表达,并获得了高纯度并具热稳定的MDH蛋白。李倩[19]以大肠杆菌基因组为模板,分子克隆了939bp的MDH基因表达重组菌,获得比酶活高达112.5U/mg的高产菌株。王俊[6]通过对深黄被孢霉的MDH基因的cDNA序列进行克隆,研究发现该MDH是一个新的苹果酸脱氢酶基因,重组蛋白酶活为379.28 U/mg。以上研究工作为微生物MDH产业化制备提供了大量参考。
7 展望
MDH作为生物体中心代谢途径的关键酶,在遗传变异和个体发育等具有重要的研究价值[25],并在临床诊断、工业检测具有广泛应用,市场需求量与日俱增,价值巨大。自上世纪50年代,就已经有学者从动物心肌中分离出MDH。现阶段,市场上商业化的MDH来源主要是从猪、兔、牛的心肌、肝脏、骨骼肌中提取。原料成本低、来源广,但提取工艺繁琐,产品酶活较低。因此,深入了解微生物MDH的生化特性、结构功能及催化机制,构建具有高活力的MDH表达工程菌,优化生产菌种发酵条件具有重要研究意义和应用价值。

