不同耕作方式对当归根际土壤细菌群落多样性的影响
霍庆迪 赵庆芳 马艳 李巧峡

摘 要: 該研究以甘肃省中部渭源县大豆—当归轮作地、连作3年的当归地和荒地植物根际土为材料,采用 PCR-RFLP法研究不同耕作方式下根际土壤细菌的群落多样性。应用CTAB-SDS法提取土壤微生物总DNA,建立土壤菌群16S rRNA基因克隆文库。用Hae Ⅲ, Hha Ⅰ和Hinf Ⅰ对阳性克隆子进行酶切指纹图谱分析,测序并绘制系统进化树。经过初步分析,荒地、轮作地和连作地三者之间根际土壤细菌群落在种群数量和多样性上无显著差异,但在组成结构上存在明显差异,尤其是轮作和连作地。结果表明:轮作地和荒地的优势种群均为变形菌门,连作地的优势种群是拟杆菌门。进一步分析发现,对农作物有利的鞘脂单胞菌属(属于变形菌门)仅在轮作和荒地中出现,而在其他作物连作障碍中出现的无色杆菌属(属于拟杆菌门)仅在当归连作地中出现。因此,不同耕作方式对土壤细菌的群落组成结构影响较明显,土壤细菌群落组成结构的变化可能是当地当归连作障碍的重要原因之一;而轮作可有效提高根际土壤中细菌群落组成的多样性,并使有益细菌种群增加,改善土壤微生态环境,有效防止当归根腐病的发生。
关键词: 当归, 连作障碍, 根际微生物, 16S rDNA, PCR-RFLP
中图分类号: Q948
文献标识码: A
文章编号: 1000-3142(2018)02-0241-09
Effects of different cultivation methods on bacterial community diversity in rhizosphere soil of Angelica sinensis
HUO Qingdi, ZHAO Qingfang*, MA Yan, LI Qiaoxia
( College of Life Sciences, Northwest Normal University, Lanzhou 730070, China )
Abstract: Angelica sinensis is a genuine regional drug in the Gansu Province of China, continuous cropping obstacles seriously affect the yield and quality of angelica in recent years. In this paper, the rhizosphere soil was sampled from the fields of Angelica-soybean rotated, angelica continuous cultivations and wasteland in Weiyuan County of Gansu Province. We aimed to know the differences of community structure and diversity of bacteria population in the three sampling sites, and provide some useful advises for the reasonable planting of angelica. The method of 16s rRNA PCR-RFLP (polymerase chain reaction-restriction fragment length polymor-phism) was used for the comparative analysis of rhizosphere bacterial community structure and diversity. The total DNA was extracted from the soil microbes by CTAB-SDS method and 16S rRNA gene cloning library was established. The fingerprints were analyzed by restriction fragment length polymorphism (RFLP) by using the Hae Ⅲ, Hha Ⅰ and Hinf Ⅰ restriction enzymes, respectively. Then phylogenetic tree was set up according to the 16S rRNA sequences. After preliminary analysis, there was no significant difference in bacteria population quantity and diversity indices of rhizosphere soils among wasteland, rotated planted fields and continuous cultivation fields, but there was very obvious difference in community structure of bacteria among the three fields, especially in rotated planted fields and continuous cultivation fields. The results showed that the dominant population of bacteria was Proteobacteria in rotation fields and wasteland, while the dominant population of bacteria was Bacteroidetes in continuous cultivation fields of angelica. The strains of Sphingomonas that belonged to Proteobacteria, which were beneficial to the growth of crop, appeared only in the rotation fields and wasteland, and the Achromobacter that belonged to Bacteroidetes associated with the continuous cropping obstacle appeared only in the continuous cropping fields. Our results suggested that the different ways of angelica cultivation play an important role in bacteria community structure. Meanwhile, the continuous cropping obstacle might be associated with the changes of bacterial community structure in rhizosphere soils of cropped angelica. In conclusion, we think that the rotation can effectively enhance the composition of the bacterial community structure, increase the beneficial bacterial population, improve the soil microenvironment, and prevent the root rot of angelica.
Key words: Angelica sinensis, continuous cropping obstacle, rhizosphere microbe, 16S rDNA, PCR-RFLP
當归(Angelica sinensis)是重要的大宗交易中药材,以甘肃所产品质最佳,常用于贫血、高血压、慢性支气管炎、哮喘和心血管疾病的治疗。随着人们生活水平的提高及其适用范围扩大,需求量逐年增加,但高品质中药材产地的地域性严重限制了当归种植业快速增长。在实际农业生产中常用连作来解决类似的矛盾,而当归长期连作却容易导致连作障碍,常常表现为当归的生长势变弱,单位面积年产量逐年降低,中药品质下降,易感染病虫害,市场竞争能力不断下降(马瑞君等,2008)。
土壤细菌群落组成和结构可作为土壤生态系统的健康情况、生产力大小及环境干扰程度的新指标(Mendes et al, 2011;Hermans et al, 2017)。长期研究发现土壤微生物各菌种的比例关系失衡及种群数量变化较大是传统耕地连作障碍的主要原因之一(Ling et al, 2009;刘星等,2015),单一物种长时间的连作后微生物区系由适宜作物稳定生长的“细菌型”土壤逐步向对植物生长不利或者直接抑制其快速生长“真菌型”土壤转变,抵抗和应对生物和非生物胁迫的能力降低,使作物更容易染病(韩剑等,2011)。分子生物学手段与传统微生物群落生态研究相互渗透和交叉,为研究连作障碍耕地微生物群落组成和变化提供了强有力的技术支持。本文以当归连作地、大豆—当归轮作地和荒地为样地,将PCR-RFLP技术和细菌的16S rDNA基因测序手段相结合,比较了不同耕作方式下细菌群落结构的变化差异,阐明了耕作方式对细菌数量和组成结构的影响,以探讨根际细菌多样性和连作障碍之间的关系。
1 材料与方法
1.1 土壤样品采集
土壤采样地会川镇位于甘肃省中部渭源县境内。用五点采样法收集大豆—当归轮作地、3年连作的当归连作地(该区域地根腐病严重)和荒地的土壤,按李国庆(2009)的方法收集根际土后用消毒毛刷收集根表土,两者混合即为本研究所用根际土壤,消毒纸袋收集密封后保存于-20 ℃冰箱内。
1.2 样地微生物总DNA的提取及目的片段扩增
参照陈旭玉等(2008)的CTAB-SDS法提取土壤微生物总DNA,选用细菌通用引物799F /1492R对提取的总DNA特异性扩增(兰阿峰等,2014),并获得目的片段。PCR反应体系为20 μL,包括2 μL模板DNA,10 μL 2×Taq Master Mix,上下游引物各1 μL(浓度为10 μmol·L-1),6 μL ddH2O。反应程序为95 ℃预变性5 min,94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1.5 min,共30个循环。PCR产物经0.8%的琼脂糖电泳检测,用StarPrep快速DNA胶回收试剂盒(康润生物)进行纯化。
1.3 PCR-RFLP分析
目的片段与PTG19-T vector连接后转入Trans5α中,经蓝白斑实验筛选后,使用通用引物M13-47/M13-48对阳性克隆进行检验。菌液PCR产物分别用内切酶Hae Ⅲ/Hha Ⅰ/Hinf Ⅰ消化(1 μL消化酶,3 μL 10×Quick Cut Buffer,10 μL PCR产物,16 μL ddH2O,37 ℃水浴30 min)。酶切产物用1.5%的琼脂糖凝胶电泳分离,染色凝胶成像后分析带型。统计酶切图谱上经内切酶处理后片段的大小并进行“0-1”分析结合Ntsys2.02对结果进行统计。定义经两种酶切条带形都相同的克隆子为一个OTU(Operational Taxonomic Unit,操作分类单位),通过统计单个样地OUT总数及单个OTU所包含的克隆子数,计算土壤中细菌的多样性。
(1)克隆文库覆盖率(Coverage):
C=1-nN
式中,n为克隆文库中仅一个序列的OTU数,N为单文库中的OTU数。
(2)辛普森多样性指数(D-Simpson index):
D=1-i=ni=1[ni(ni-1)]/N(N-1)
式中,N为单个文库中序列数,ni为第i种OUT中包含的序列数,n为单文库中序列数。
(3)香农指数(H-Shannon index):
H=si=1pilnpi
式中,pi为第i种OUT中序列数在单文库序列总数中的比例,n为单文库中OUT个数。
(4)均匀度指数(Evenness index):
E=HlnS
式中,H为香农指数,S为单文库中总序列数。
(5)丰富度指数(Schaol index):
Schaol=Sobs+F1(F1-1)2(F2+1)
式中,Sobs为单文库中OUT个数,F1和F2分别为克隆文库中只包含1个和2个序列的OUT个数。
1.4 克隆文库系统发育分析
在各样地中分别取30个具有代表性的OTU测序,测序结果使用VecScreen和Bellerophon(Venter & Smith,2004)去除载体序列和嵌合体,通过BLAST进行序列比对。选取相似度不小于95%的序列,在MEGA6.0中使用N-J法聚类(Bootstrap-1000)构建系统发育树。所得序列的登录号为KR133580-KR133626。
2 结果与分析
2.1 总DNA的提取及16S rDNA基因选择性扩增
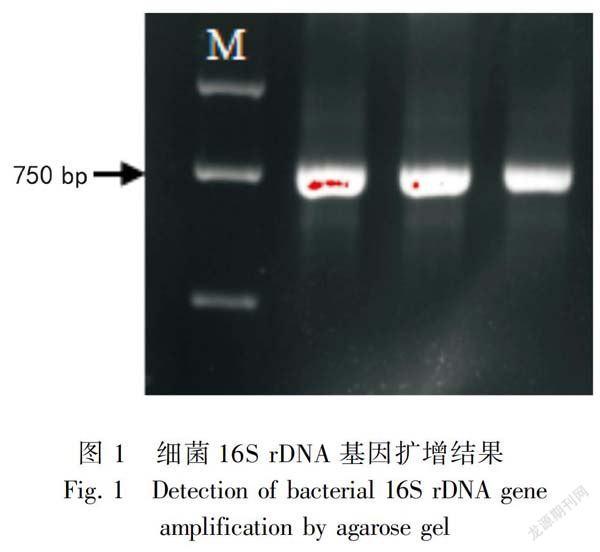
通用引物扩增的目的片段大小约为730 bp,如图1所示,目的条带单一,扩增效果良好,可以用于后续的实验。
2.2 细菌16S rDNA的酶切结果
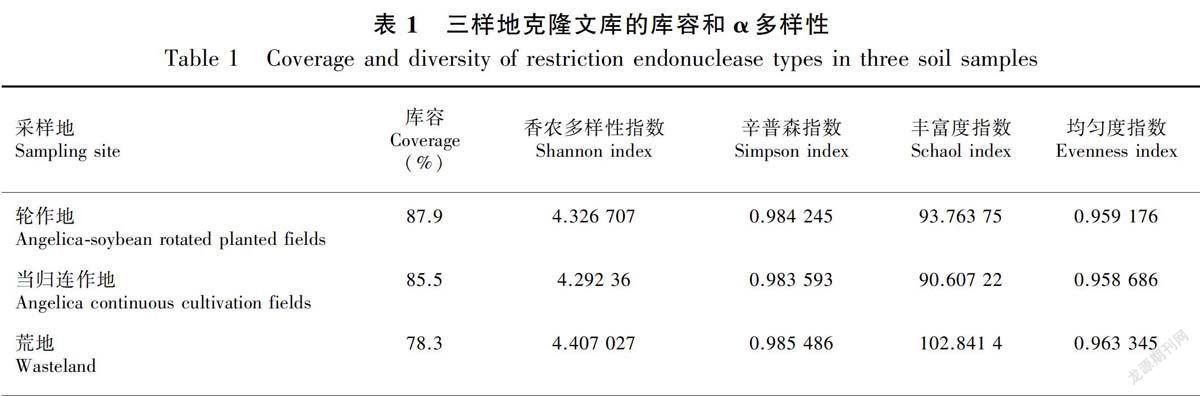
土壤微生物群落的丰富度、多样性、均匀度与优势度大体呈负相关,能较好地表征了群落的综合特征。荒地产生97种OTU类型,大豆—当归轮作地91种,連作地最少为88种。单一克隆所占比例为荒地8.21%,当归连作地4.55%,轮作地最少只有3.15%。
从表1可以看出,三个采样地的库容值都不小于70%,说明该文库能较全面反映三样地细菌群落的α多样性(游偲等,2014)。均匀度指数、辛普森指数、香农多样性指数和丰富度指数均为荒地最大连作地最小,说明荒地中细菌物种丰富分布均匀但物种优势度最不明显,连作地则相反。
2.3 细菌16S rDNA基因系统发育分析
使用在线工具VecScreen、Bellerophon处理测序结果,使用BLAST进行序列比对,通过MEGA 6.0中构建系统发育树,结果如图2至图4所示。
三样地共有8个类群,其中轮作与连作对酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes)的组成和数量有比较大的影响。其中变形菌门(Proteobacteria)是轮作地和荒地的优势菌群(38.5%和38.9%)。本研究中α-变形菌纲只包含A18、C3、C13和C14,其余均为β-变形菌纲。A1和A11属于β-变形菌纲草酸杆菌科(Oxalobacteraceae)。B13和B21属于β-变形菌纲无色杆菌属(Achromobacter)。拟杆菌门为当归连作地的优势菌群(20.0%),拟杆菌门在轮作地中未出现,A21和27属于浮霉菌门,未培养细菌占总OUT数的39.1%。值得指出的是连作地B4、B22、B25在BLAST分析中分别属于Denitratisoma属(93%,变形菌门)、Gemmatimonas属(90%,芽单胞菌门)和Terrimonas属(99%,拟杆菌门),B4和B22未达到95%皆为未培养细菌,但B25为何不能归属为拟杆菌门尚无法解释。
3 讨论
随着不同领域对连作障碍研究的深入,特别是多元组学和系统生物学算法的应用,为人们从整体上了解和研究农作物连作障碍发生的机制提供了更好的帮助。连作障碍的发生并不是单个或是少数几个因素的简单组合导致的,而是涉及到农作物-土壤微生态环境-农作物之间非常复杂的相互作用,此观点得到了大多数学者的认同。
不同作物发生连作障碍的原因不一,但是土壤微生态环境的变化是导致连作障碍的主要原因之一,其中以农作物根际的变化尤为显著。很多研究学者将改变土壤微生物群落结构和组成作为调节根际微生态环境的重要手段,并以此来改善长期连作对农作物的影响。黄瓜连作研究显示,拮抗菌木霉菌(Trichoderma spp.)种群数量逐年下降,具有致病潜力的尖孢镰孢菌(Fusarium oxysporium)则渐渐成为优势菌群(胡元森等,2006)。针对棉花(李锐等,2015)不同连作年限的研究表明随着年限的不断延长,细菌菌落组成越发单一,多样性也逐年降低。与黄瓜连作不同,镰刀菌和枯草芽孢杆菌随棉花连作年限的增加呈先下降后升高,这可能与棉花连作年限较长有关。本实验将分子实验技术应用到当归的连作障碍研究中,与Trabelsi et al(2012)和Larkin et al(2010)用不同农作物分别与连作马铃薯进行轮作的实验结果不同,土壤细菌种群数量和多样性在大豆当归轮作地和当归连作地之间差异不显著。主要原因可能有以下两个方面:一方面是生物因素,细菌本身的特性和不同植物根分泌物的差异对根际细菌的影响;另一方面是非生物因素,如泥土类型、泥土温度、有机质含量、泥土湿度、酸碱度等。除上述原因之外,不同菌种之间竞争能力差异和对生存适应性能力大小(Philippot et al,2013;Jordan et al,2013)都会对根际微生物群落结构产生影响。
耕作方式的改变对分布于该区域土壤内的细菌种群数量和多样性影响不显著,但对细菌群落组成结构具有明显的影响。文库中不少序列来自未纯培养细菌,表明该研究区域可能存在很多新细菌。拟杆菌门是连作地的优势种群,轮作地和荒地的均为变形菌门,本研究结果同付琳等(2012)对不同施肥条件下香蕉根际土可培养细菌区系变化相似。α-变形菌纲均为具固氮能力的鞘氨醇单胞菌属,对西瓜(王志刚等,2015)连作障碍研究中发现该属的细菌具有较高的解磷能力,可分泌IAA对改善根系组成具有一定作用。无色杆菌属在三七根腐病病根和黄瓜枯萎病植株中出现(张智慧等,2014;高玉亮等,2015),间接说明了当归根腐病的发生和无色杆菌属也具有一定联系。芽单胞菌门和浮霉菌门只在轮作地中存在,说明与荒地相比大豆—当归轮作可以使这一类群数量增加而连作会使这一类群数量减少,该现象显示轮作地的微生物环境有利于此种细菌的生长。
对不同耕作方式下当归耕地土细菌的多样性研究表明,土壤微生态环境的变化同当归连作障碍发生或危害加重之间存在直接或者间接的联系,长期连作导致土壤细菌的多样性、组成结构和数量均发生变化。同时,微生态环境的变化也加重了连作障碍对植物的危害。因此,根据目前的研究结果,在耕地面积较少的情况下,我们建议在当归种植过程中采取以下措施:(1)尽量采用轮作的耕作方式,轮作的作物尽量采用具有地上生产力与经济价值的植物(如大豆、小麦、玉米等),避免与根茎生产力的作物轮作(如马铃薯、萝卜等);(2)投放生物菌剂,通过人为的投放有益细菌,提升土壤微生物的多样性,维持土壤微生态环境的动态平衡,增强当归的抵抗力;(3)改变土壤的理化性质,例如深耕30 cm以上可以明显改善土壤的水、气、热状况,促进作物根系深扎,增强当归对不利因素的抵抗力;(4)培育高品质的耐连作当归品种,这是对抗连作障碍最经济的办法;(5)生物消毒法,通过人为添加易降解有机物改变增强土壤还原性从而抑制病原微生物的生长,目前有关此类方法的田间研究主要集中在少数经济作物上(Ebihara & Uematsu, 2014;Butler et al,2014)。
参考文献:
BUTLER DM, KOKALIS-BURELLE N, ALBANO JP, et al,2014. Anaerobic Soil Disinfestation (ASD) combined with soil solarization as a methyl bromide alternative: vegetable crop performance and soil nutrient dynamics [J]. Plant Soil, 378(1-2):365-381.
CHEN XY, ZHOU YK, ZHENG FC, 2008. Comparison of two extracting methods for soil microbial total DNA [J]. Chin J Trop Agric, 28(3):41-43. [陈旭玉,周亚奎,郑服丛,2008. 橡胶林土壤微生物2种DNA提取方法的比较 [J]. 热带农业科学,28(3):41-43.]
EBIHARA Y, UEMATSU S, 2014. Survival of strawberry-pathogenic fungi Fusarium oxysporum f. sp. fragariae, Phytophthora cactorum, and Verticillium dahliae, under anaerobic conditions [J]. J Gener Plant Pathol, 80(1):50-58.
FU L, RUAN YZ, SHEN ZZ, et al, 2012. Effects of bio-organic fertilizer on the community structure of culturable bacteria in the rhizosphere soil of a continuous-cropping banana filed [J]. J Nanjing Agric Univ, 35(6):82-88. [付琳, 阮云泽, 沈宗专, 等, 2012. 生物有机肥对连作香蕉根际土壤可培养细菌区系的影响 [J]. 南京农业大学学报,35(6):82-88.]
GAO YL, MIAO ZQ, SUN MH, et al, 2015. Investigation on Fusarium oxysporum f. sp. cucumerinum Owen suppressed by soil actinomycetes in Yanbian [J]. J Agric Sci Yanbian Univ,37(4):321-325. [高玉亮,缪作清,孙漫红,等, 2015. 延边地区抑制黄瓜枯萎病菌土壤放线菌的调查研究 [J].延边大学农学学报,37(4):321-325.]
HERMANS SM,BUCKLEY HL,CASE BS, et al, 2017. Bacteria as emerging indicators of soil condition [J]. Appl Environ Microbiol, 83(1): e02826-16.
HU YS, LIU YF, WU S,et al,2006. Variation of microbial community structure in relation to successive cucumber cropping soil [J]. Chin J Soil Sci,37(1):126-129. [胡元森,刘亚峰,吴坤,等, 2006. 黄瓜连作土壤微生物区系变化研究 [J].土壤通报,37(1):126-129.]
HAN J, ZHANG JW, XU WX, et al, 2011. Dynamics analysis of culturable soil microflora and microbial activity in continuous and rotation cropping systems of Xinjiang cotton [J]. Cotton Sci, 23(1): 69-74. [韓剑, 张静文, 徐文修,等, 2011. 新疆连作、轮作棉田可培养的土壤微生物区系及活性分析 [J]. 棉花学报, 23(1): 69-74.]
JORDAN V, GUILHEM D, MARIE-LARA B, et al, 2013. Plant growth-promoting rhizobacteria and root system functioning [J]. Front Plant Sci, 4: 356.
LAN AF, YANG M, GUO SF, et al, 2014. Culture-independent analysis of intestinal microbial diversity from Chinese giant salamander [J]. Microbiology,41(7): 1342-1349. [兰阿峰,杨曼,郭素芬,等, 2014. 免培养法对大鲵肠道微生物多样性的研究 [J].微生物学通报,41(7):1342-1349.]
LARKIN RP, GRIFFIN TS, HONEYCUTT CW, 2010. Rotation and cover crop effects on soil-borne potato disease,tuber yield, and soil microbial communities [J]. Plant Dis, 94: 1491-1502.
LI GQ,2009. Effects of Solidago canadensis on microbial community diversity in rhizosphere soil [D]. Fuzhou: Fujian Agriculture Forestry University. [李国庆, 2009. 入侵植物加拿大一枝黄花对根际土壤微生物群落多样性的影响研究 [D]. 福州:福建农林大学.]
LI R, LIU Y, CHU GX, et al,2015. Response of soil enzyme activity and microbial community structure,diversity to continuous cotton cropping in Northern Xinjiang [J]. Chin J Ecol Agric,23(4):432-440. [李锐,刘瑜,褚贵新,等, 2015. 棉花连作对北疆土壤酶活性、致病菌及拮抗菌多样性的影响 [J]. 中国生态农业学报,23(4):432-440.]
LING N, WANG QJ, YANG XM, et al, 2009. Control of Fusarium wilt of watermelon by nursery application of bio-organic fertilizer [J]. Plant Nutr Fert Sci, 15(5): 1136-1141.
LIU X, QIU HZ, WANG D, et al, 2015. Evaluation on fungal community structure of rhizosphere soils of potato under rotation and continuous cropping systems in Yellow River Irrigation Areas of Middle Gansu Province [J]. Acta Ecol Sin,35(12): 3938-3948. [刘星,邱慧珍,王蒂,等, 2015. 甘肃省中部沿黄灌区轮作和连作马铃薯根际土壤真菌群落的结构性差异评估 [J]. 生态学报,35(12):3938-3948.]
MA RJ, HUI JR, ZHU H, et al, 2008. Allelopathy of Angelica sinensis at vegetative stage [J]. Chin J Ecol Agric,16(6):1483-1488. [ 马瑞君,惠继瑞,朱慧,等, 2008. 当归营养期的化感作用 [J]. 中国生态农业学报,16(6):1483-1488.]
MENDES R, KRUIJT M, DE BRUIJN I, et al, 2011. Deciphering the rhizosphere microbiome for disease-suppressive bacteria [J]. Science,332(6033): 1097-1100.
PHILIPPOT L, RAAIJMAKERS JM, LEMANCEAU P, et al, 2013. Going back to the roots: the microbial ecology of the rhizosphere. [J]. Nat Rev Microbiol, 11(11):789.
TRABELSI D, AMMARB HB, MENGONI A, et al, 2012. Appraisal of the crop-rotation effect of rhizobia inoculation on potato cropping systems in relation to soil bacterial communities [J]. Soil Biol Biochem, 54:1-6.
VENTER JC,SMITH HO, 2004. Environmental genome shotgun sequencing of the Sargasso Sea [J]. Science,304(5667):66-74.
WANG ZG, HU HL, XU WH, et al, 2015. Isolation and identification of Sphingomonas sp. CL01 and its promoting effects on watermelon (Citrullus lanatus) in continuous cropping soil [J]. Chin J Agric Biotechnol, 23(10): 1360-1367 [王志剛,胡云龙,徐伟慧,等, 2015. 鞘氨醇单胞菌菌株CL01的分离鉴定及其对连作西瓜的促生效应 [J].农业生物技术学报,23(10):1360-1367]
YOU C, ZHANG LM, JI SG, et al, 2014. Impact of biocontrol agent Bacillus subtilis on bacterial communities in tobacco rhizospheric soil [J] Chin J Appl Ecol,25(11):3323-3330. [游偲,张立猛,计思贵,等, 2014. 枯草芽孢杆菌菌剂对烟草根际土壤细菌群落的影响 [J].应用生态学报,25(11):3323-3330.]
ZHANG ZH, ZHANG QR, FU XP, et al, 2014. Cultivable bacterial diversity in rotting roots of Panax notoginseng based on 16S rDNA sequence analysis [J]. Chin Trad Herb Drugs, 45(3): 415-419. [ 张智慧,张倩茹,付晓萍, 等, 2014. 基于16S rDNA 序列分析研究根腐病三七根内可培养细菌的多样性 [J].中草药,45(3):415-419.]

