鲫鳃出血病2种病原菌的分离及鉴定
朱 潜,姚雪梅,沈 锋,张世驰,于 娜,高茂林
(海南大学海洋学院,海口 570228)
鲫(Carassiusauratus)属鲤形目鲤科,肉质细嫩营养价值较高,是我国重要食用鱼类之一。鳃出血病是淡水鱼较严重的一种恶性传染病,主要特征为鳃部肿胀、出血,严重者体表点状充血、鳍基部发红、肠道有炎症、腹腔积水、肝脏发白。该病最初在2009-2010年零星发生于江苏省苏北射阳县鲫养殖池塘;次年夏末在盐城地区出现较大面积的暴发,引起大量死亡,甚至蔓延至江苏各省,对江苏地区的水产养殖业造成了严重的经济损失。近几年,该病不仅流行于整个苏北地区,同时在东北地区、华中地区也零星发生[1-2]。为避免造成更大的经济损失和社会影响,应查明鳃出血病的起因,从而有效地预防和防治这种疾病。孟思好等[3]2011年8-11月和2012年4-10月,从苏北地区部分水产养殖基地患“鳃出血病”银鲫体内分离出5个菌株,但人工感染致病菌的试验鱼却并未出现与自然条件下 “鳃出血病”相同症状,因此提出鳃出血病可能由病毒与细菌混合感染引起。王会聪等[4]调查江苏省射阳县盐场区域的100个养殖场,发现鲫鳃出血病与温度密切相关。吴霆等[5]通过组织病理学、回归感染试验、分子生物学诊断等研究方法,证实异育银鲫鳃出血病病原为鲤科疱疹病毒-Ⅱ型(Cyprinid herpesvirus 2,CyHV-2)。
2013年6月,黑龙江省哈尔滨市某鲫养殖区暴发严重的鳃出血症。从典型病症鱼体的鳃部中分离到2种致病细菌(Q-120和B-15),对健康鲫进行人工腹腔注射感染和体外溶血试验,确定其具有致病性。结合16S rRNA 基因序列比对及进化树结构分析,确定了该致病菌的种类和分类地位,旨在为鲫鳃出血病的发病机理、流行规律、药物与免疫预防技术等研究奠定基础。
1 材料与方法
1.1 材料和试剂
病鲫:取自哈尔滨某养殖场。经解剖观察,发现病鱼皮肤溃烂有白点,体表、各鳍基部、眼眶等处出血,肛门红肿;其鳃丝整齐并附有粘液,掀开鳃盖后发现有特别明显的凝血现象。镜检发现鳃丝充血肿胀严重或伴有烂鳃,未见寄生虫的存在(图1)。
回归感染试验鱼:健康鲫体重100 g左右,购于哈尔滨某养殖场。
分离与检测用噬纤维菌培养基、PCR所用引物及试剂、细菌基因组DNA提取试剂盒均由上海生工生物工程有限公司提供。药敏纸片购自北京天坛中国药品生物制品检定所。
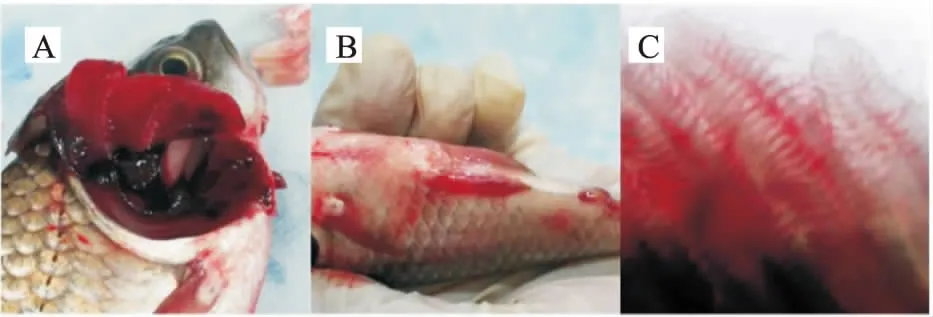
图1 病鱼主要特征Fig.1 The major characteristics of diseased fish (A 鳃部具有明显的凝血现象,B 体表、 各鳍基部等处出血且肛门红肿,C 镜检鳃丝充 血肿胀严重并伴有烂鳃(10×))
1.2 致病菌的分离和培养
用75%酒精对具有明显症状病鱼表面进行消毒处理,从鳃部取少量组织研磨成糊,加入10 mL 0.5%的无菌生理盐水混匀,取菌液1 mL,依次制成10-1、10-2、10-3、10-4、10-5等稀释度备用。取100 μL上述每个稀释度(每个稀释度取3个平行)接种于噬纤维菌培养基(蛋白胨0.18%,酵母膏0.09%,牛肉膏0.09%,葡萄糖0.09%,碳酸氢钠0.18%,氯化钠0.3%,琼脂2.0%,pH7.0~7.4)平板上,置于28 ℃恒温箱培养24 h。对初筛的各个单菌落进行纯化培养,并记录单菌落的形态特征。
1.3 病原菌的鉴定
1.3.1 细菌形态学鉴定
将平板上两种优势的典型菌落,分别命名Q-120和B-15菌落。将两种菌落的细菌进行革兰氏染色,在光镜下检查细菌的形态特征和染色结果。另取病鱼鳃丝压片观察鳃丝粘液中致病细菌的形态特征,并与从菌落中挑取细菌的形态特征进行比对。
1.3.2 16S rRNA序列测定和进化树构建
将2种细菌接种于噬纤维菌培养基中,28 ℃震摇 24 h后离心收集菌体,按照细菌基因组 DNA 提取试剂盒说明书提取细菌总 DNA,作为 PCR 模板。利用特异性引物Bac-F2:5 aga gtt tga tca tgg ctc ag 3和Bac-R2:5 acg gct acc ttg tta cga ctt 3进行16S rRNA 基因片段扩增。PCR 反应条件均为:94 ℃预变性 4 min;94 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸 1 min 20 s,共34个循环; 最后 72 ℃延伸 10 min。PCR 产物经纯化后进行序列测定。将所测序列与GenBank中的序列进行Blast比对,然后从匹配度高的序列中选取部分相关的16S rRNA序列,用Mega 5.0软件采用最大似然法(ML法)构建系统发育树。
1.4 回归感染试验
将分离出的两株优势菌Q-120和B-15,纯培养于噬纤维菌培养基斜面上,24 h后用无菌生理盐水制成浓度2.0×108个/mL 的菌悬液进行腹腔注射。取体重100 g左右的健康鱼40尾,分成4组进行感染试验。感染组为3组,分别为Q-120、B-15与两种菌的混和感染组,注射量为菌悬液0.2 mL/尾;对照组注射无菌生理盐水0.2 mL/尾。试验鱼饲养在25 ℃的充气水族箱中,观察鱼的生活及发病情况。致病后对出现典型病鱼的鳃部再进行细菌的分离纯化培养,与养殖场的病鱼分离菌进行对照。
1.5 致病菌的体外溶血试验
2%红细胞悬液的制备:健康鱼心脏采血5 mL,置放在有玻璃珠的小试管中,轻微搅拌去除纤维蛋白。将血移入装有10 mL生理盐水的离心管中,混匀后2 500 r/min离心5 min,弃去上清液,重复3~4次至上清液呈无色透明为止。将洗涤好的红细胞用生理盐水配制成2%的细胞悬液,备用。
体外溶血测定:取9支10 mL的试管编号分成9组,其中第1~8组为实验组,第9组为对照组。每组首先各加入2%红细胞悬液2.5 mL。第1~4组再依次加入2.5、1、0.5、0.1 mL的Q-120菌悬液(浓度为2.0×108CFU/mL );第5~8组再按上述浓度梯度依次加入B-15菌悬液(浓度为2.0×108CFU/mL ),最后用无菌生理盐水将9支试管定容至5 mL,室温下静置30 min后,观察并记录各组的溶血情况。
1.6 药物敏感实验
28 ℃培养过夜的Q-120和B-15液体培养物涂布于噬纤维菌平板,适当干燥后贴药敏纸片,每皿6片,每种药物2片平行,28 ℃培养24 h 后测定抑菌圈直径,按产品说明书判定对药物的敏感度。
2 结果
2.1 病原菌的鉴定
2.1.1 病原菌的分离和形态观察
将2种优势菌Q-120、B-15在噬纤维菌培养基平板上28 ℃培养24 h后,观察发现Q-120菌落颜色与培养基的颜色接近呈微黄色,菌落直径约2 mm,培养48 h后菌落颜色加深为浅黄色,菌层增厚似水滴状,中间厚,边缘向四周微扩散,菌落直径可持续增大至4 mm左右;菌株B-15菌落颜色为白色,菌落直径较小约1~2 mm,48 h后菌落颜色为白色,表面光滑,菌落也似水滴状,菌落直径可增大至3 mm左右。
试验分离的2种优势菌Q-120、B-15均为革兰氏阴性杆菌,菌体两端钝圆,稍弯,多数单个排列,无芽孢,有鞭毛,能运动。在显微镜下观察菌株Q-120长约0.5~2.0 μm,菌株B-15长约0.6~2.5 μm。这与活体鳃丝压片观察结果基本一致。
2.1.2 两种病原菌16S rRNA基因序列及系统进化关系
以菌株Q-120的基因组为模板,扩增获得16S rRNA部分序列,长度为1 451 bp(不计引物长度),并在Genbank上注册(登录号KP313244)。Blast比对后,发现该序列与维氏气单胞菌(Aeromonasveronii)16S rRNA同源性在99%以上,且与登录号KJ704986.1的维氏气单胞菌序列同源性达到100%。采用ML法所构建的系统进化树,Q-120菌株与维氏气单胞菌、维氏温和气单胞菌生物变种(A.sobria)聚类处于同一进化分支,可确定该分离菌为维氏气单胞菌(图2)。
以B-15的两个菌株(B-15-1和B-15-2)基因组为模板,扩增获得16S rRNA部分序列,长度为1 462 bp(不计引物长度),分别在Genbank上注册(登录号:KU949379和KU949380)。Blast比对后,发现该序列与GenBank上登录号为JN644526.1、KC660137.1和KC990811.1的阴沟肠杆菌(Enterobactercloacae)16S rRNA同源性高达99%以上,且位于进化树同一分支,可确定该分离菌为阴沟肠杆菌(图3)。

图2 基于16S rRNA 序列构建的气单胞菌系统发育树Fig.2 Phylogenetic tree of Aeromonas based on 16S rRNA (★为本研究的维氏气单胞菌,刻度尺上的数字为遗传距离)
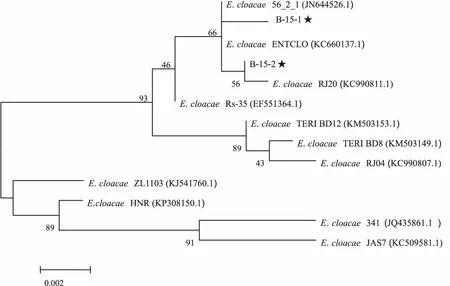
图3 基于16S rRNA 序列构建的阴沟肠杆菌系统发育树Fig.3 Phylogenetic tree of Enterobacter cloaca based on 16S rRNA (★为本研究的阴沟肠杆菌,刻度尺上的数字为遗传距离)
2.2 回归感染试验
腹腔注射致病菌的健康鱼均出现典型的自然发病症状。感染维氏气单胞菌(Q-120)病鱼起初体表大量溃烂,摄食下降,游动缓慢,尾部明显短小;3 d后鱼开始死亡,解剖发现肾脏呈褐色,胆囊肿大,鱼鳃肿胀或鳃边缘溃烂,少数病鱼伴有鳃出血现象,死亡率为90%。感染阴沟肠杆菌(B-15)的病鱼起初摄食下降,游动缓慢,头部、躯干部、尾部等多处溃烂,鳍、鳃部出血;3 d后鱼开始死亡,解剖发现鳃颜色发红并伴有明显凝血现象,肠道萎缩,腹部渗出大量黄色液体,死亡率也为90%,其引起的鳃出血现象较维氏气单胞菌更为明显。维氏气单胞菌与阴沟肠杆菌混合感染的病鱼出现了两种菌感染的所有症状,死亡率高达100%。因此可确认维氏气单胞菌、阴沟肠杆菌两菌株均为致病菌,而阴沟肠杆菌引起的鳃出血和凝血症状更明显,且两菌株有协同作用,即二者混合感染时致病率及死亡率增高。
2.3 致病菌的体外溶血试验
本试验考验不同浓度的维氏气单胞菌(Q-120)、阴沟肠杆菌(B-15)对健康鱼红细胞的影响。溶血实验结果如表1:注射Q-120组0.5 h后就开始溶血,菌浓度越高,溶血程度越高,其1号组出现全溶。与维氏气单胞菌组相比,阴沟肠杆菌组溶血速率明显慢很多,12 h后才开始溶血,其溶血程度也是随菌体浓度增高而加快。对照组未出现溶血。
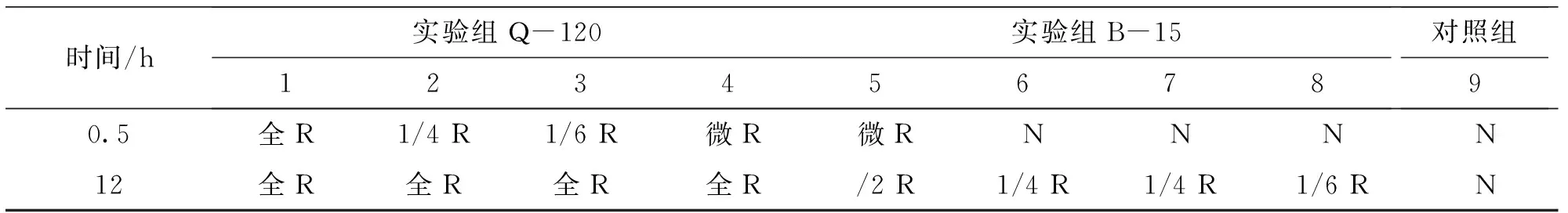
表1 溶血实验结果Tab.1 The result of hemolysis test
注:R-溶血,N-表示不溶
2.4 药物敏感实验结果
从5种药物的敏感实验得出,Q-120(维氏气单胞菌)对氟苯尼考与诺氟沙星敏感,而对其他3种药都具有耐药性。Q-120较B-15(阴沟肠杆菌)出现了更强的耐药性(表2)。
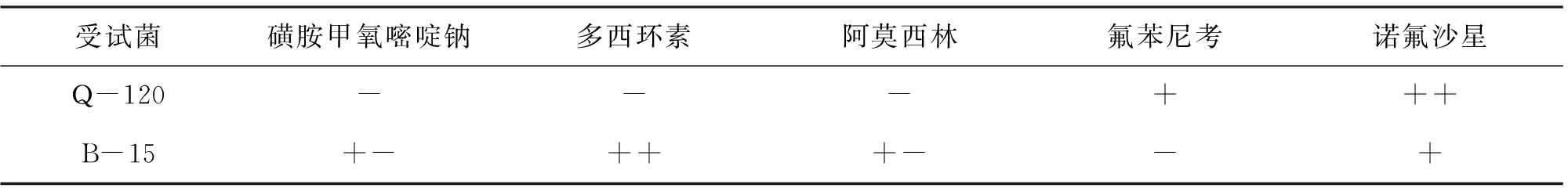
表2 分离菌株的药物敏感性试验结果Tab.2 The sensitivity of the isolated strains to test chemotherapentants
注:-为耐药;+-:弱敏感;+为中度敏感;++为强敏感
3 讨论
鲫鳃出血病是近年来新出现的流行范围广、死亡率高、危害和损失大的急性病。本研究表明,分离的Q-120、B-15菌株在人工感染试验中具有较强的致病力,感染的病鱼出现与自然患病鱼相似的鳃出血等症状,本实验鉴定Q-120为维氏气单胞菌(A.veronii)、B-15为阴沟肠杆菌(E.cloacae),两者均为鲫鳃出血病的致病菌。
维氏气单胞菌(A.veronii),隶属于弧菌科(Vibrionaceae)气单胞菌属(Aeromonas),是一类革兰氏阴性杆菌。该菌普遍存在于淡水、污水、淤泥及土壤中,其主要致病因子为气溶素(aerolysin)、肠毒素(enterotoxin)等,致病范围极其广泛,可引起中华绒鳌蟹、锦鲤、斑点叉尾鮰及包括人在内的多种哺乳动物感染病症,已逐渐对水产养殖业和人类健康构成严重的威胁[6-8]。本研究通过人工感染和体外溶血实验也证明维氏气单胞菌对鲫具有很强的致病性。从药敏试验也发现,维氏气单胞菌比阴沟肠杆菌具有更强的耐药性。这说明鲫的大量快速死亡可能更多是因为维氏气单胞菌的溶血作用。
阴沟肠杆菌(E.cloacae),属肠杆菌科 (Enterobacteriaceae)肠杆菌属(Enterobacter),广泛存在于自然界中,在人和动物的粪便、水、泥土、植物中均可检出阴沟肠杆菌,属人类肠道正常菌种之一,但该种菌也是一种条件致病菌,产毒素,可引起败血症等[9]。该种菌容易出现较强的耐药性,而且可能又是由六个菌群复合组成[10]。目前国内外未见阴沟肠杆菌在鱼类上感染致病的报道,本研究首次发现阴沟肠杆菌可寄生于鲫,并能引起出血及腹腔腹水等症状。我们的药敏试验表明该菌对目前的5种常用药,1种出现耐药性,2种是弱敏感。因只是检测了5种药敏试纸,所以还需要更大量的药敏实验来说明其是否具有多重耐药性。另外最新的研究显示这种菌在人类肠道的大量出现可引起非酒精性脂肪肝及肥胖[11],该研究提示可能这种菌的出现与鱼体内脂肪的代谢失调有一定的关系。
此外体外溶血实验表明,两种菌均对鱼的红细胞有较强的溶血作用。人工感染实验结果表明两种病菌均能引起健康鱼体表大量溃烂、鳃部凝血、肠道炎症、腹腔积水等,但阴沟肠杆菌引起的鳃出血症状(尤其出现鳃部出血、凝血现象)要比维氏气单胞菌要明显很多。混合感染时,出现典型的鲫鳃出血病的症状(鳃部肿胀、出血、凝血,鳍基部发红、肠道有炎症、腹腔积水),与养殖场现场采集病鱼的症状吻合,这表明阴沟肠杆菌很可能是一种潜在的机会型致病菌,可协同其它致病性细菌引起“鳃出血病”综合征。这一结果为鱼类出血病的有效防治提供了重要的依据。

