SLC22A12瞬时转染HEK293细胞模型的建立与鉴定
刘 亭,杨友辉,刘香香,冯 瑾,陈 雅,刘春花
1)贵州医科大学贵州省药物制剂重点实验室;贵州医科大学药用植物功效与利用国家重点实验室 贵阳 550004 2)贵州医科大学药学院 贵阳 550004 3)贵航贵阳医院药剂科 贵阳 550009
嘌呤代谢紊乱或尿酸排泄受阻常常会引起高尿酸血症,进而可引起肾功能损伤以及痛风等疾病[1]。嘌呤在体内被黄嘌呤氧化酶氧化成尿酸,尿酸需要经过肾小球滤过、肾小管重吸收、肾小管再分泌及分泌后重吸收等过程排出体外[2]。尿酸排泄量受肾小管尿酸转运体的种类、活性及数量的影响,常见的尿酸转运体包括尿酸盐转运体(hUAT)和SLC22A12基因编码的尿酸盐阴离子转运体(hURAT1)[3]。尿酸盐从胞内转运到胞外需要hUAT的参与[4-5],肾近端小管对尿酸盐的重吸收及尿酸盐的转运主要靠hURAT1的作用,原尿中90%左右的尿酸是被hURAT1重吸收入血的[6-7]。目前临床上治疗尿酸血症过高的药物主要是通过抑制尿酸的合成及抑制黄嘌呤氧化还原酶的活性来降低尿酸的生成[8],但这些药物如苯溴马隆、丙磺舒、别嘌醇等[9]常会引起胃肠道反应、肝肾功能损伤等毒副作用或者产生变态反应、Stevens Johnson综合征等严重不良反应[10],限制了其应用。鉴于hURAT1在尿酸重吸收中的重要作用,其逐渐成为抗高尿酸药物研发的重要靶点。构建一个体外尿酸转运细胞模型,成为抗高尿酸新药筛选的迫切需要。目前所构建的细胞模型多是采用稳定转染法,虽然可以得到稳定表达外源蛋白的细胞株,但是时间、人力和资源花费较多。作者首先构建了SLC22A12重组质粒,并用该质粒转染HEK293细胞,构建模型细胞SLC-HEK293,通过qRT-PCR、Western blot检测模型细胞中SLC22A12 mRNA和hURAT1蛋白的表达量,并使用超高效液相色谱-质谱/质谱联用仪(UPLC-MS/MS)考察其对尿酸钠的摄取能力,确证模型是否建立成功。
1 材料与方法
1.1细胞、主要试剂和仪器人胚肾细胞HEK293购自中国生命科学院细胞库,货号GNHu43。SLC22A12基因(NM_144585.3)和BM无缝克隆试剂盒(批号CL116-01)由博迈德基因技术有限公司提供;GV142质粒(批号V79020)购自上海吉凯基因技术有限公司;胰蛋白酶(批号25300-054)和DMEM高糖培养基(批号8778619)购自Gibco公司;胎牛血清(批号P30-3302)购自PAN公司;FuGENE®6转染试剂(批号0000254749)、MTS(批号G3582)和Eastep®Super总RNA提取试剂盒(批号7020001018)购自Promega公司;PrimeScriptTM逆转录试剂盒(批号AK5301)、SYBR®Premix Ex TaqⅡ(批号A7005-1)购自TaKaRa公司;PCR引物由生物工程上海股份有限公司合成;抗hURAT1抗体(批号ab198791)、抗GAPDH抗体(批号ab8245)及相应二抗购自Abcam公司。倒置荧光显微镜(型号TS100)购自Nikon公司;凝胶成像仪(Syngene型号)购自G-BOX公司;凝胶分析软件(版本号Quantity One 4.6.2)、电泳仪(型号PowerpacTMBasic)、实时荧光定量PCR仪(型号CFX96)购自Bio-Rad公司;核酸蛋白紫外测定仪(型号BioMate 3S)、高速冷冻离心机(型号Fresco17)购自Thermo公司。
1.2质粒GV142-SLC22A12的构建与鉴定用Hind Ⅲ andEcoRⅠ 酶对GV142质粒和SLC22A12片段双酶切,切胶回收后用BM无缝克隆试剂盒将载体与SLC22A12连接。将重组质粒转化到TOP10菌株(批号C1210-1,购自北京索莱宝科技有限公司),于37 ℃培养箱中、在含氨苄青霉素(100 mg/L)的LB琼脂培养基上培养12 h。挑取单克隆于含氨苄青霉素(100 mg/L)的LB液体培养基中,于37 ℃、180 r/min的条件下培养12 h。利用质粒抽提试剂盒抽提质粒,用Hind Ⅲ 和EcoRⅠ酶对其进行双酶切鉴定,并用10 g/L的琼脂糖电泳检测酶切结果。同时挑取阳性克隆送检测序。
1.3HEK293细胞的培养用含体积分数10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素的DMEM高糖培养基培养,于37 ℃、体积分数5% CO2恒温培养箱中培养,细胞融合度达80%时,用胰蛋白酶消化后按1∶4比例传代。
1.4SLC22A12瞬时转染HEK293细胞条件的优化
1.4.1 转染比例的优化 选取生长状态良好的HEK293细胞,用2.5 g/L胰蛋白酶消化后,将细胞稀释成1×105mL-1,以2 mL/孔接种于6孔板中,置于37 ℃、体积分数5% CO2恒温培养箱中培养。待细胞的融合度达70%时,进行转染。取4支1.5 mL无核酸离心管,每管加入100 μL DMEM高糖培养基后,再分别加入FuGENE®6 转染试剂10、8、6、4 μL,混合均匀。静置5 min后分别加入GV142-SLC22A12质粒2 μg,使其转染比例[试剂(μL)∶质粒(μg)]分别为5∶1、4∶1、3∶1和2∶1,混合均匀静置15 min。6孔板换液后,加入混合物,于37 ℃、体积分数5%CO2细胞培养箱中培养24 h,于倒置荧光显微镜下观察绿色荧光强度。
1.4.2 质粒量的优化 取生长状态良好的HEK293细胞,胰蛋白酶消化后,调整细胞密度至1×105mL-1,铺6孔板,置于37 ℃、体积分数5% CO2恒温培养箱中培养。待细胞融合度达到65%时,按照转染比例为3∶1进行转染,具体转染条件:9 μL试剂∶3 μg质粒、6 μL试剂∶2 μg质粒和3 μL试剂∶1 μg质粒。转染后置于37 ℃、体积分数5% CO2细胞培养箱中培养24 h,于倒置荧光显微镜下观察绿色荧光强度。
1.5细胞中SLC22A12mRNA表达的qRT-PCR检测取生长状态良好的HEK293细胞,分为两组,分别转染GV142空质粒(HEK293组)和GV142-SLC22A12质粒(SLC-HEK293组)。转染24 h后,利用Eastep®Super总RNA提取试剂盒提取RNA,逆转录成cDNA。cDNA稀释10倍后作为模板进行qRT-PCR。反应体系:模板cDNA 1 μL,上、下游引物(10 μmoL/L)各0.8 μL,SYBR®Premix Ex TaqⅡ10 μL,ddH2O 7.4 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火60 s,40个循环;72 ℃延伸60 s。SLC22A12上游引物5’-AGTCGGCACGATGGCTCCTC-3’,下游引物5’-CCGCATGGCTGAAAGCAAGA-3’;GAPDH上游引物5’-GGTCCTGGTTCTCATTCCT-3’,下游引物5’-TTTGAGGGTGCAGCGAACTT-3’。以GAPDH为内参,以2-ΔΔCt方法计算目的mRNA的相对表达量。
1.6细胞中hURAT1蛋白表达的Westernblot检测细胞分组和处理同1.5。转染24 h后,裂解细胞,用BCA试剂盒测定蛋白浓度。取30 μg蛋白进行SDS-PAGE凝胶电泳分离,半干转仪恒压25 V转膜30 min,封闭30 min,分别用抗hURAT1抗体(按1∶200稀释)和抗GAPDH抗体(按1∶2 000稀释)孵育1 h,洗膜后加入二抗(按1∶4 000稀释)孵育1 h,洗膜后用ECL显影,凝胶成像系统成像,Quantity One软件分析灰度值。以GAPDH为内参,计算hURAT1和GAPDH条带灰度值的比值。
1.7SLC-HEK293细胞功能的验证
1.7.1 尿酸钠对SLC-HEK293细胞的安全浓度 参照Shin等[11]的方法,稍作调整。将SLC-HEK293和HEK293细胞接种于6孔板,分别用100、200、400、600、800和1 000 μmol/L的尿酸钠(样品组)于37 ℃、体积分数5% CO2恒温培养箱中培养2 h。弃培养上清,用无血清培养基以100 μL/孔洗板2次,加入无血清培养基100 μL和MTS 5 μL,于37 ℃、体积分数5% CO2恒温培养箱中继续孵育2 h。于490 nm波长下测定其吸光度(A)。以不加尿酸钠的细胞作为对照组,以无血清培养基的A为背景值,计算细胞存活率。细胞存活率=(A样品组-A背景值)/(A对照组-A背景值)×100%。
1.7.2 尿酸钠摄取速率的测定 参照Shin等[11]的方法,稍作调整。将SLC-HEK293和HEK293细胞接种于6孔板,分别用10、20、40、80、160和320 μmol/L的尿酸钠于37 ℃、体积分数5% CO2恒温培养箱中孵育2 h,PBS清洗2次后,用RIPA裂解细胞。取裂解液按1∶6的体积比加入甲醇沉淀蛋白,于4 ℃以12 000g离心30 min,取上清用UPLC-MS/MS测定两种细胞对尿酸钠的摄取速率[尿酸摄取总量/(蛋白总量·摄取时间)]。
1.7.3 色谱与质谱条件 Waters Van Guard BEH C18色谱柱(2.1 mm × 50 mm, 1.7 μm)柱和保护柱(2. 1 mm × 50 mm,17 μm);柱温:45 ℃;进样体积:2.0 μL;流速:0.3 mL/min;流动相:A含体积分数0.1%甲酸的乙腈,B含体积分数0.1%甲酸的水;梯度洗脱:10% B(0~2 min),10%~90% B(1.5~4 min),100% B(4~6 min)。质谱采用选择离子监测(SIR)和电喷雾离子源(ESI)检测。锥孔电压为30 V、50 V;碰撞电压分别为15 V、40 V,以5-氟尿嘧啶为内标用于定量正离子对(m/z):166.8(尿酸钠),126.75(5-氟尿嘧啶)。
1.8统计学处理采用SPSS 22.0进行分析,应用两独立样本t检验比较两组细胞中SLC22A12 mRNA、hURAT蛋白水平的差异,应用单因素方差分析比较不同浓度尿酸钠对细胞存活率的影响,应用2×6析因设计的方差分析比较两组细胞对尿酸钠摄取能力的差异。检验水准α=0.05。
2 结果
2.1质粒GV142-SLC22A12的酶切鉴定结果见图1。由图可知,重组质粒的大小在7 kb左右,双酶切后产生了2条条带,1.6 kb为目的基因片段,5.4 kb为GV142载体片段,均与理论大小符合。阳性克隆测序结果显示插入片段与目的基因序列一致。
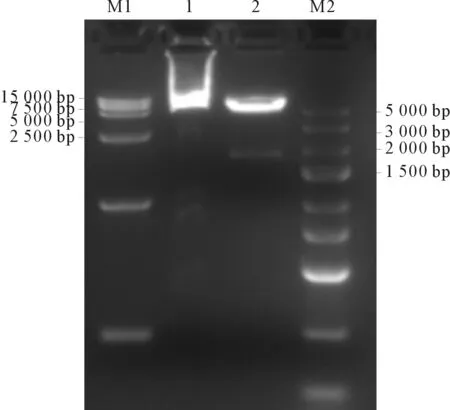
M1、M2:DNA Marker;1:GV142-SLC22A12;2:双酶切图1 质粒GV142-SLC22A12的鉴定
2.2转染条件优化
2.2.1 转染比例的优化 随着转染比例的增加,转染细胞中绿色荧光强度先增加后降低;当转染比例为3∶1时,荧光强度最强(图2),说明3∶1为最佳转染比例。
2.2.2 质粒量的优化 在转染比例为3∶1条件下,随着质粒量的增加,绿色荧光强度先增加后减小;当质粒量为2 μg时,荧光强度最高(图3),说明质粒量为2 μg时,转染效率最高。
2.3两种细胞中SLC22A12mRNA和hURAT1蛋白的表达见表1。由表1可知,与HEK293相比,SLC-HEK293细胞中SLC22A12 mRNA和hURAT1蛋白的表达水平显著增加(P<0.001)。
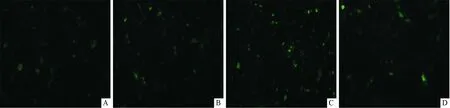
A:5∶1;B:4∶1;C:3∶1;D:2∶1图2 不同转染比例的转染效果(×100)

A:3 μg;B:2 μg;C:1 μg图3 试剂和质粒不同用量的转染效果(×100)
表1两种细胞中SLC22A12mRNA和hURAT1蛋白的表达
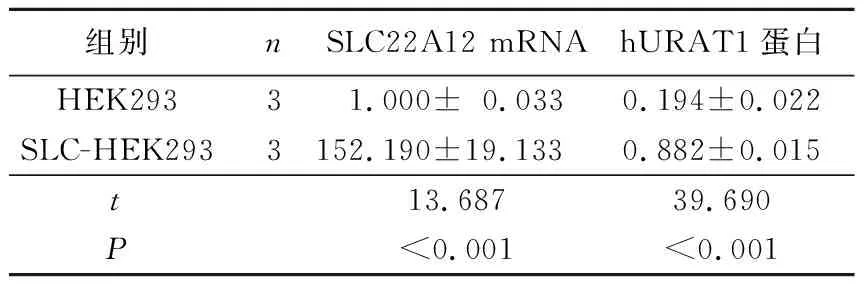
组别nSLC22A12 mRNAhURAT1蛋白HEK29331.000±0.0330.194±0.022SLC-HEK2933152.190±19.1330.882±0.015t 13.68739.690P<0.001<0.001
2.4SLC-HEK293细胞的尿酸钠摄取功能
2.4.1 不同浓度尿酸钠对两种细胞存活率的影响
见表2。当尿酸钠的浓度大于400 μmol/L时,尿酸钠降低了SLC-HEK293细胞的存活率(P<0.05)。因而在后续实验中,尿酸钠浓度均低于400 μmol/L。
2.4.2 两种细胞对尿酸钠摄取能力的比较 见表3。随着尿酸钠浓度的增加,HEK293和SLC-HEK293细胞对尿酸钠摄取速率增加。和HEK293相比,SLC-HEK293细胞尿酸钠摄取速率明显增高(P<0.001)。
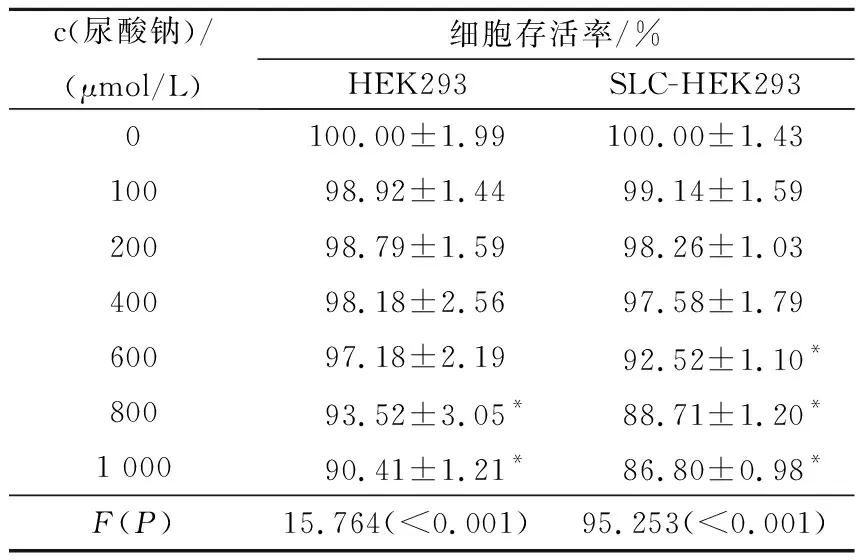
表2 不同浓度尿酸钠对两种细胞存活率的影响(n=6)
*:与0 μmol/L组相比,P<0.05

表3 两种细胞对尿酸钠摄取能力的比较(n=3) nmol/(g·min)
F组别=4 695.610,F浓度=1 891.206,F交互=854.103,P均<0.001
3 讨论
国内高尿酸血症发病率高, 但能有效用于降尿酸的药物种类较少,尤其是促尿酸排泄的药物。虽然苯溴马隆排尿酸效果明显,但毒副作用大,具有严重的肝脏毒性[12-13]。迄今为止,美国 FDA仍未批准苯溴马隆上市,但由于没有更好的排尿酸药物,我国临床上仍在使用苯溴马隆[11]。促尿酸排泄新药的开发,已经成为一个紧迫的任务。
肾脏尿酸清除过低是90%的原发性高尿酸血症的病因。研究[14]表明,SLC22A12基因编码的hURAT1是肾小管上皮细胞最主要的尿酸重吸收转运体,抑制hURAT1活性将极大阻碍尿酸重吸收,从而促进尿酸排泄;hURAT1也逐渐成为降尿酸药物开发的热门靶点。目前国内常用动物模型来进行排尿酸活性成分的筛选。动物实验周期长,用药物量大,成本高,不适合用于活性成分的初筛。因此,为了加快实验进程,降低筛选成本,本文制备了一个SLC22A12瞬转细胞模型。
在细胞选择上,常用的肾源细胞有犬肾细胞MDCK和人胚肾细胞HEK293。由于MDCK不是人源细胞,并且预实验中作者发现MDCK细胞的消化时间较长,且不容易制备成单个细胞,不利于后续实验的开展。而HEK293细胞生长快、易消化,也容易被吹散为单个细胞,并且该细胞的转染效率很高。因此,本实验最终选择了HEK293来构建细胞模型。
在转染方法的选择上,常用的转染方法一般分为病毒法和非病毒法。病毒法是以病毒为载体将目的基因导入受体细胞的方法,该方法具有易引起免疫原性、成本高、对实验环境要求较高和插入细胞核中位置的不固定等缺点。非病毒介导的转染方法中常用的有磷酸钙沉淀法、电穿孔法、脂质体法和非脂质体法,其中非脂质体法介导的转染因具有高效低毒,无需去除血清或培养基,导入非脂质体-DNA 复合物后也无需洗涤或更换培养基等优点而被广泛应用。因此,本实验采用了非脂质体制剂FuGENE介导转染。
从qRT-PCR和Western blot结果来看,SLC-HEK293细胞中SLC22A12 mRNA和hURAT1蛋白表达水平远高于HEK293细胞,说明SLC22A12基因在SLC-HEK293中得到了高表达。尿酸钠摄取实验表明,SLC-HEK293细胞的尿酸钠摄取速率高于HEK293细胞,表明SLC-HEK293细胞中高表达的hURAT1蛋白能发挥正常功能。
综上所述,本实验成功建立了SLC22A12瞬时转染HEK293细胞模型,该模型制备过程简单,易于操作,是促尿酸排泄有效成分筛选的一个便利工具。
——一道江苏高考题的奥秘解读和拓展