载亚硒酸钠壳聚糖微球的制备、表征及缓释性能研究
张 驰商龙臣吴少魏李光大刘信平
(1. 湖北民族学院生物科学与技术学院,湖北 恩施 445000;2. 湖北民族学院化学与环境工程学院,湖北 恩施 445000;3. 河南科技大学医学技术与工程学院,河南 洛阳 471003)
近年来,被誉为“长寿元素”和“抗癌之王”的人体生命活动必需营养微量元素硒[1-3],因世界许多地区(中国72%的地区)严重缺乏[4],使得全民补硒热潮在国内外悄然兴起。目前补硒方式主要有食补、摄入富硒保健品和药补[5],补硒模式受价格昂贵和盲目进补两大瓶颈因素的制约。特别是盲目进补,硒与其他人体必需微量元素一样具有两重性[6-7],适量有益,超量中毒有害,成人每日摄人硒量高达400~800 mg/kg·体重可导致急性中毒,每天摄入2 400~3 000 μm 硒数月即出现慢性中毒症状。亚硒酸钠已作为重要的补硒物被列为食品添加剂,如何把控补硒量的尺度,实现科学补硒成为关键。
天然高分子阳离子多糖——壳聚糖,以其良好的吸附性、成膜性和生物相容性,被用作药物缓释载体材料的研究已有相关报道[8-10],但可控缓释硒材料的研究国内外尚少见报道,文献[11]报道将单质硒或亚硒酸离子直接涂层成镀硒钛材料,用作载硒骨修复材料,但该硒的负载方式存在突释效应,短时间易引发硒中毒。本研究以壳聚糖为壁材,采用乳化交联法[12-13]制备壳聚糖载硒微球,让硒长时间缓慢释放有效作用浓度,实现硒剂量的控制,以期开辟科学补硒的新途径。
1 材料与方法
1.1 材料与试剂
壳聚糖(Chitosan,CS):脱乙酰度>90%,上海伯奥生物科技有限公司;
亚硒酸钠、乙酸、盐酸、戊二醛、液体石蜡、Span-80、石油醚、丙酮、无水乙醇、氯化钠、碳酸氢钠、氯化钾、三水合磷酸氢二钾、六水合氯化镁、氯化钙、硫酸钠、三羟甲基氨基甲烷等:分析纯,上海国药集团化学试剂有限公司;
硒标准溶液:100 μg/mL,中国计量科学研究院。
1.2 仪器与设备
低速台式离心机:TDL-80-2B型,上海安亭科学仪器厂;
pH计:PHSJ-3F型,上海精密科学仪器有限公司;
移液枪:MicroPette型,Dragon Laboratory Instruments Limited;
傅里叶红外光谱仪:Nicolet iS10型,美国ThermoFisher Scientific公司;
微波消解仪:MARS HACKER 型,美国CEM Corporation公司;
双道原子荧光光度计:AFS-9760型,北京海光仪器公司;
SEM扫描电镜:JSM-7001F型,日本电子株式会社。
1.3 方法
1.3.1 载硒、空白CS微球的制备
(1) 水相制备:称取一定量的壳聚糖粉末于体积分数2%的醋酸溶液中,磁力搅拌使壳聚糖完全溶解,得质量浓度2%的壳聚糖醋酸溶液,静置过夜使其澄清透明,此为制备空白壳聚糖微球所需水相;准确称取一定质量的亚硒酸钠于体积分数2%的醋酸溶液中,配制成不同质量分数的含硒醋酸溶液,再将一定质量的壳聚糖粉末置于此溶液中,磁力搅拌使壳聚糖完全溶解,配制成含硒量不同的壳聚糖溶液,静置过夜使其澄清透明,此为制备载硒微球所需的水相。
(2) 油相制备:量取一定量的Span-80于液体石蜡中,搅拌均匀,配制成含5 mL/100 mL Span-80的石蜡油体系,此为制备微球所需油相。
(3) 载硒、空白CS微球的制备:在一定温度条件下(空白微球35 ℃条件下),按水∶油体积比1∶5将水相缓慢滴加到油相中,边滴加边搅拌,待水相滴加完全后,继续搅拌1 h,使水油两相充分乳化,缓慢滴加一定量的交联剂(12.5%的戊二醛),继续搅拌1 h,使戊二醛与壳聚糖充分交联,静置分层,去除上层液相,收集沉淀物,用石油醚和无水乙醇分别抽滤洗涤数次直至滤液澄清透明,此即为载硒、空白壳聚糖微球。滴加数滴丙酮,使微球颗粒相互分散,于45 ℃烘箱中烘干,得载硒和空白壳聚糖微球成品。
1.3.2 载硒CS微球制备的单因素试验 固定交联剂用量为5%,反应温度35 ℃,投入Na2SeO3量为0.2%,乳化时间1 h,交联时间1 h,分别在壳聚糖浓度为0.5%,1.0%,2.0%,3.0% 的条件下进行试验,考察壳聚糖浓度对微球载药量、包封率[11]的影响;固定交联剂用量为5%,反应温度35 ℃,壳聚糖浓度为2%,乳化时间1 h,交联时间1 h,分别在Na2SeO3质量浓度为0.2%,0.4%,0.8%,1.6%的条件下进行试验,考察Na2SeO3浓度对微球载药量、包封率的影响;固定交联剂用量5%,Na2SeO3质量浓度为0.2%,壳聚糖浓度为2%,乳化时间1 h,交联时间1 h,改变反应温度为35,45,55,65 ℃的条件下进行试验,考察温度对微球载药量、包封率的影响;固定反应温度35 ℃,Na2SeO3质量浓度为0.2%,壳聚糖浓度2%,乳化时间1 h,交联时间1 h,分别在交联剂用量为2.5%,5.0%,10.0%,15.0%的条件下进行试验,考察交联剂用量对微球载药量、包封率的影响。微球的载硒量、包封率按式(1)、(2)计算:
(1)
(2)
式中:
c——微球的载硒量,%;
d——微球的包封率,%;
m1——微球的质量,g;
m2——微球中硒的含量,g;
m3——投入微球中的硒质量,g。
1.3.3 载硒壳CS微球制备的正交试验 根据单因素试验结果,选择Na2SeO3浓度、壳聚糖浓度、反应温度及交联剂用量4个因素为自变量,包封率和载硒量为因变量,设计L9(34)正交试验优化微球制备工艺。
1.3.4 载硒CS微球体外缓释试验 参照文献[14~15]方法在聚乙烯烧杯中配制pH为7.40的模拟体液(SBF)。准确称取0.04 g含硒微球于10 mL聚乙烯样品管中,并向管中加入10 mL模拟体液(SBF),置于37 ℃恒温水浴锅中,定期从各管中取缓释液且采用原子荧光光谱法测硒含量[14],并立即向管中添加缓释液保证缓释体系体积恒定不变。
2 结果与分析
2.1 单因素对载硒CS微球制备的影响
2.1.1 壳聚糖浓度对载硒CS微球制备的影响 壳聚糖浓度对载硒CS微球制备的影响见图1。由图1可知,壳聚糖浓度在0.5%~3.0%内,随着浓度的升高,微球包封率与之呈正比关系,而载硒量却呈负相关关系,随之降低,而0.5%的壳聚糖溶液制备的微球壁薄不利于硒缓释,故舍弃该变量水平作正交试验。
2.1.2 Na2SeO3浓度对载硒CS微球制备的影响 Na2SeO3浓度对载硒CS微球制备的影响见图2。由图2可知,在Na2SoO2质量浓度为0.2%~1.6%时,随着Na2SeO3浓度的升高,微球的包封率随之降低,载药量随之升高,Na2SeO3浓度为1.6%时微球包封率相对太低,故正交试验变量选0.2%,0.4%,0.8%三水平。
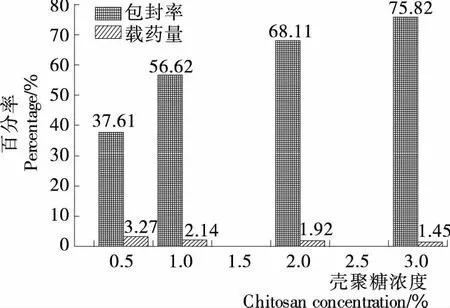
图1 壳聚糖浓度对微球包封率和载药量的影响Figure 1 Effects of CS concentration on encapsulation Efficiency and selenium loading capacity
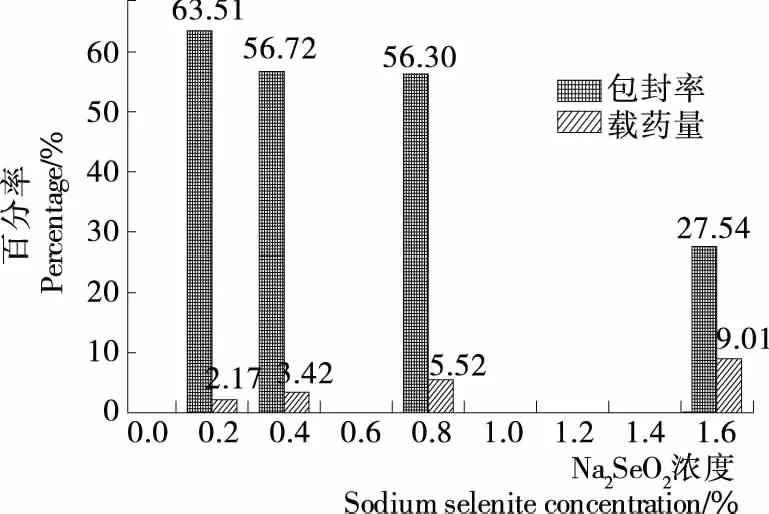
图2 亚硒酸钠浓度对微球包封率和载药量的影响Figure 2 Effects of Na2SeO3 concentration on encapsulation Efficiency and selenium loading capacity
2.1.3 交联温度对载硒CS微球制备的影响 温度对载硒CS微球制备的影响见图3。由图3可知,在温度为35~65 ℃ 时,不同温度对微球得率略有影响,55 ℃时微球的包封率较好,而微球载药量的峰值则出现在45 ℃,35 ℃时微球不仅包封率较低,且微球间黏连较多,正交试验选择45,55,65 ℃三温度水平。
2.1.4 交联剂用量对载硒CS微球制备的影响 交联剂用量对载硒CS微球制备的影响如图4所示,由图4可知,在交联剂用量为2.5%~15%时,随着交联剂用量的增加,微球的包封率和载药量都呈先升高后降低的趋势,当交联剂的用量为水相用量的10.0%时,微球包封率都达到最大值。当交联剂的用量为水相用量的5.0%时,微球的载药量达到最大值,综合考虑,正交试验交联剂用量选5%,10%,15%三水平。
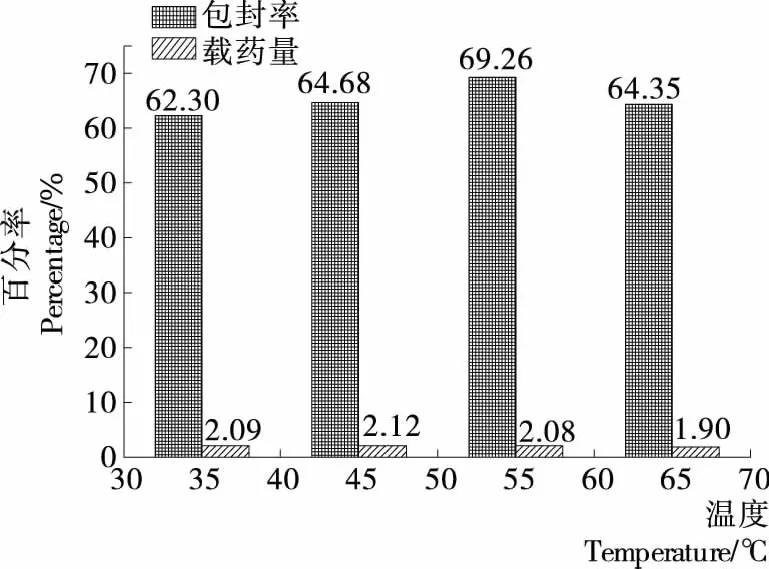
图3 温度对微球包封率和载药量的影响
图3 Effects of different temperature on encapsulation efficiency and selenium loading capacity
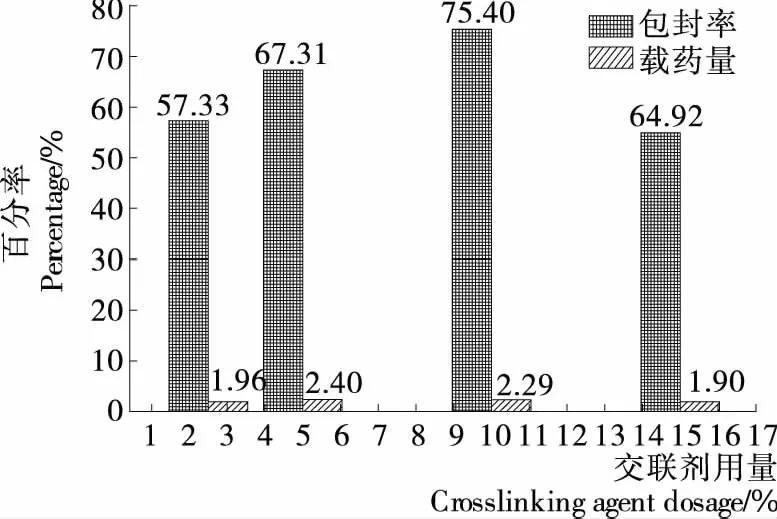
图4 交联剂用量对微球包封率和载药量的影响
图4 Effects of crosslinking agent on encapsulation efficiency and selenium loading capacity
2.2 正交试验
正交试验方案及采用SPSS 20.0软件统计分析的试验结果见表1和表2。
2.2.1 包封率为因变量的正交试验 以包封率为因变量的正交试验结果方差分析见表3。
由表3可知,因素A、B、C、D对微球的包封率有显著的影响(P<0.01)。根据表2、3结合变量因子对微球包封率影响的Duncan多重分析,得到微球最佳的优化组合为A3B3C3D2。
2.2.2 载硒量为因变量的正交试验 以包封率为因变量的正交试验结果方差分析见表4。
由表4可知,因素A、B、C、D对微球的包封率有显著的影响(P<0.01),根据表2、4以及变量因子对微球载硒量影响的Duncan多重分析,可知微球最佳的优化组合为A1B3C3D2。
由上述可知,以不同的因变量进行正交分析得到了不同的优化组合条件,分别为A3B3C3D2、A1B3C3D2。按照这些组合条件设计进行验证实验,结果见表5。
由表5可知,验证实验结果与正交分析结果相吻合。A1B3C3D2组正交优化方案的载硒量更优、A3B3C3D2组的包封率更好。
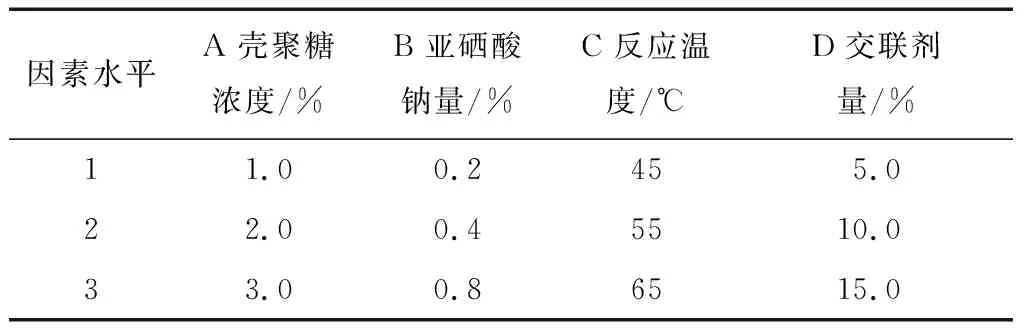
表1 乳化交联法正交试验因素水平Table 1 Factor levels of orthogonal test with emulsion cross-linking method
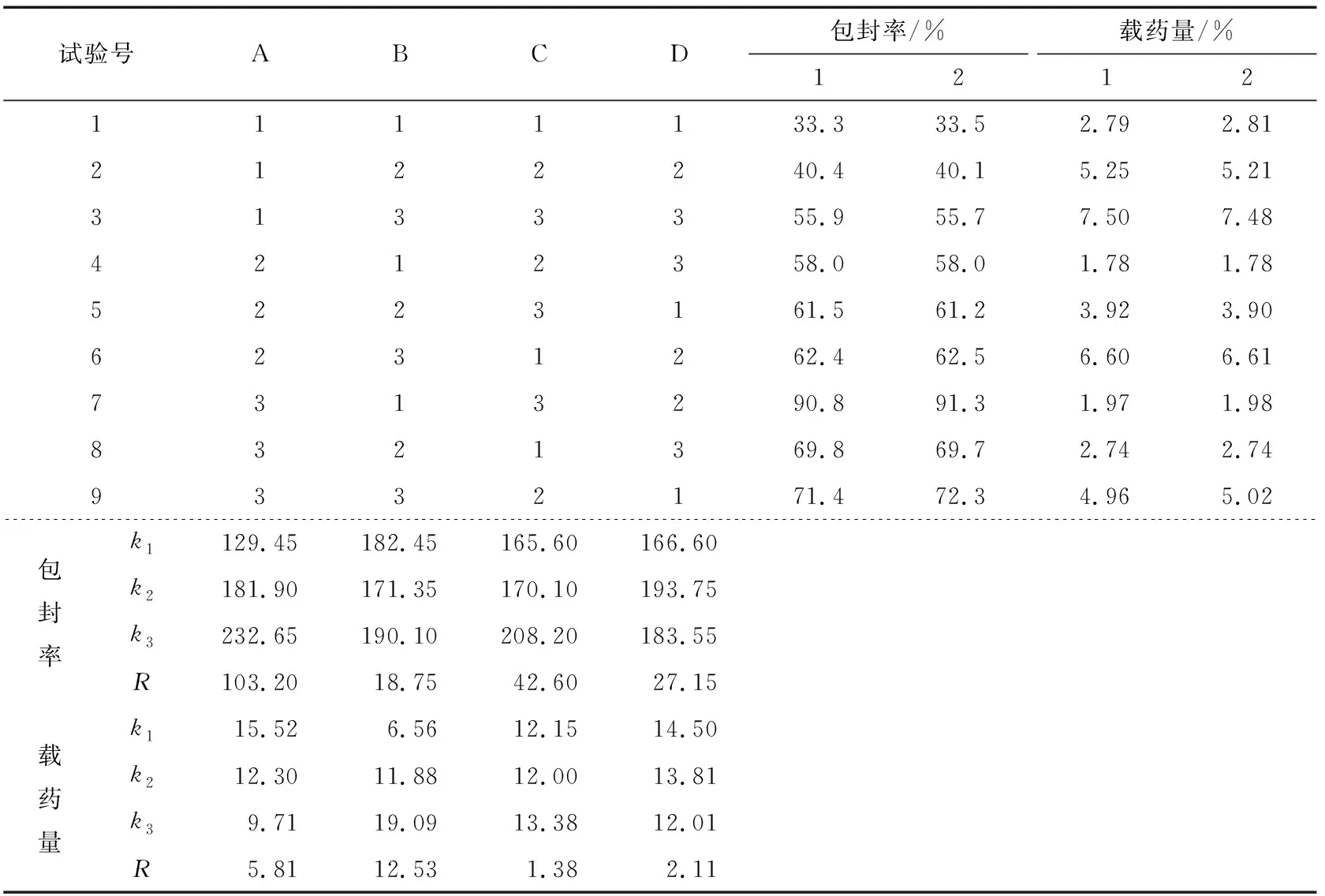
表2 L9(34)正交试验方案及结果Table 2 Scheme and results of orthogonal experimental scheme L9(34)
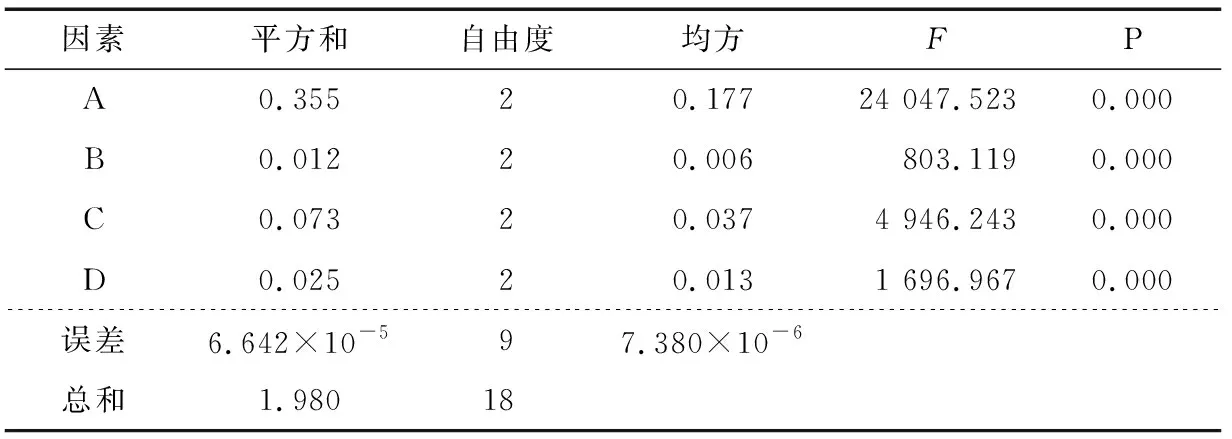
表3 正交试验结果的方差分析Table 3 Variance analysis of orthogonal test
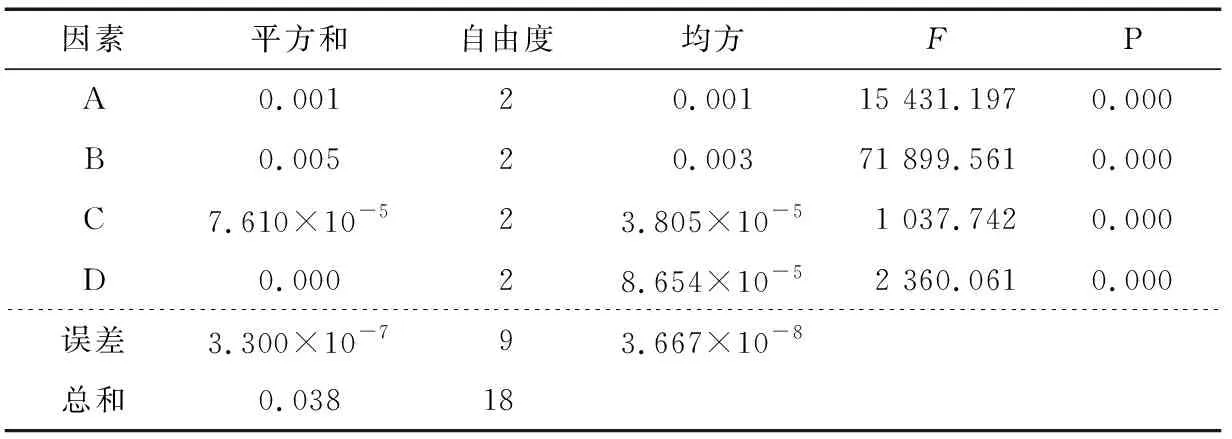
表4 正交试验结果的方差分析Table 4 Variance analysis of result on orthogonal test
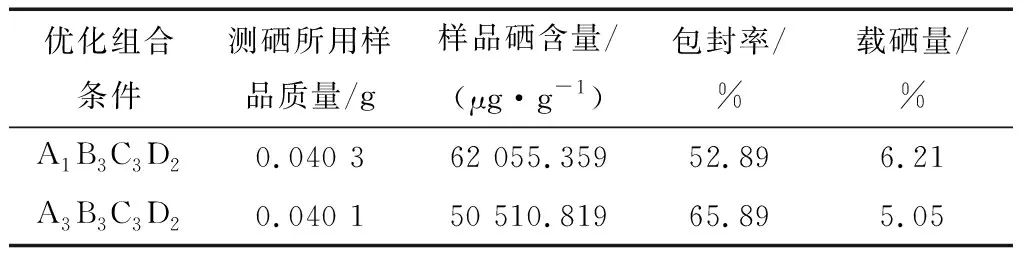
表5 验证实验结果Table 5 Result of test and verify experimentation
2.3 载硒CS微球的形貌表征
将采用优化组合方案所制备的微球进行SEM电镜扫描观察,微球的SEM图片见图5。从图5可发现,A1B3C3D2和A3B3C3D22方案条件下制备的微球都有较好的球形结构,形态良好,但A1B3C3D2条件下制备的微球粒径(粒径为4~8 μm)显著小于A3B3C3D2(粒径为9~12 μm),说明随着

a、c. A3B3C3D2方案的空白/载硒微球;b、d. A1B3C3D2方案的空白/载硒微球
图5 载硒壳聚糖微球的SEM图
Figure 5 SEM images for blank and selenium-loaded microspheres
材壁壳聚糖浓度的增大,所制备的微球粒径也增大。
2.4 载硒CS微球的IR和热分析
2种方案制得微球的IR和热分析结果基本相同,红外光谱、DTG和TG见图6~8。
2.4.1 红外分析 从图6可知,壳聚糖的特征吸收峰在3 441.03 cm-1处出现的宽峰是O—H和N—H的伸缩振动峰,2 908.98 cm-1为CH3的C—H伸缩振动吸收峰,2 883.02 cm-1是醛基的特征峰,1 652.01,1 596.75 cm-1是酰胺键Ⅰ和酰胺键Ⅱ的特征吸收峰,1 381.03 cm-1附近是CH3的C—H的对称弯曲振动峰,1 424.71 cm-1附近是—CH2的弯曲振动吸收,1 325.76,1 264.26 cm-1是壳聚糖中C—N的伸缩振动峰,1 079.74 cm-1附近是壳聚糖的C—OH 伸缩振动吸收峰;空白壳聚糖微球的IR曲线与壳聚糖相比,在1 079.74 cm-1以下的低波数段曲线形状相对于高波数段变化较大,3 441.03 cm-1处的峰基本未变,2 923.73 cm-1处较弱的吸收峰,是微球中尚存有少量未发生反应的醛基,1 638.58 cm-1处有较强的吸收峰,这是戊二醛和壳聚糖的氨基反应形成的schiff碱吸收峰,即戊二醛与壳聚糖发生了交联反应;从Na2SeO3的IR光谱图可知:在786.94 cm-1附近是亚硒酸根Se═O的伸缩振动峰,1 113.82 cm-1附近是亚硒酸根O—Se—O的对称伸缩振动峰,489.29 cm-1处是O—Se—O弯曲变角振动峰;载硒微球和空白微球的IR光谱曲线图整体上比较相近,但在2 923.73 cm-1处的吸收峰非常微弱,说明载硒壳聚糖微球中未发生反应的醛基很少,1 409.78 cm-1处有强的吸收峰,这是载硒微球中O—Se—O的伸缩振动峰,证明微球中的确包裹了预期硒目标药物,相对于Na2SeO3纯物质,这个峰向高波数发生了明显的移动。
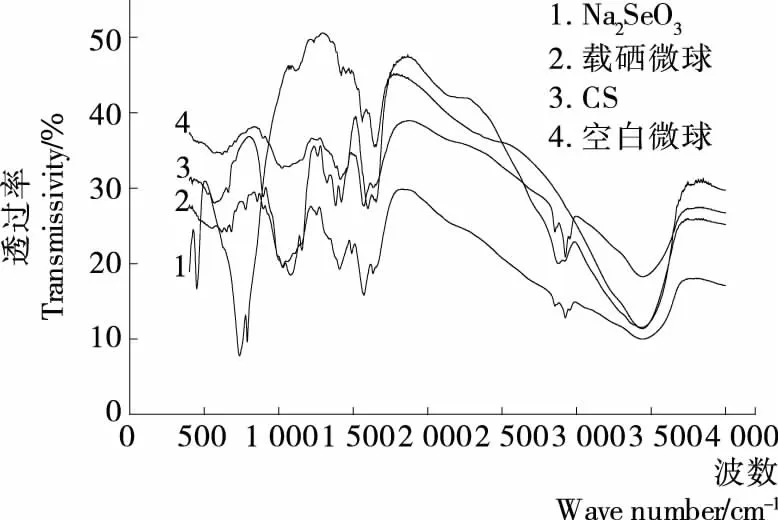
图6 各样品的红外光谱曲线Figure 6 IR curves of samples
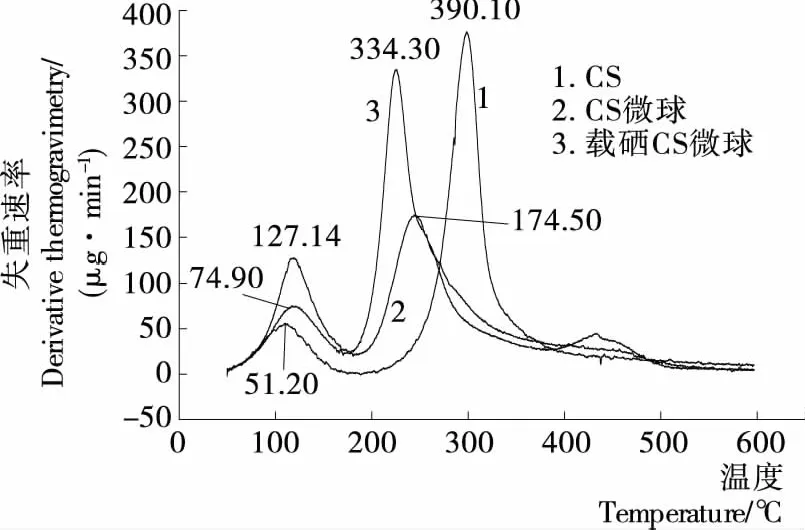
图7 各样品的DTG曲线Figure 7 DTG curves of samples
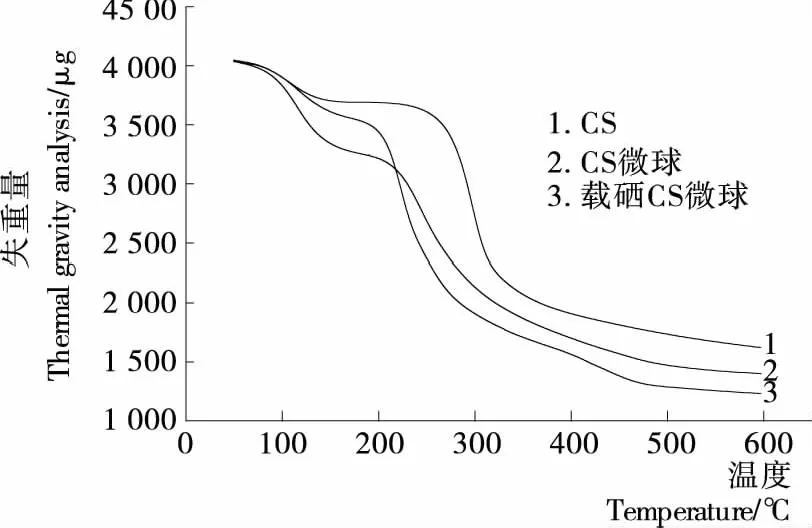
图8 各样品的TG曲线Figure 8 TG curves of samples
2.4.2 热重分析 由图7、8可知,总体上制备的微球热稳定性优于单纯的壳聚糖。壳聚糖在温度为67.24~133.31 ℃时有个小的失重阶段,此时剩余质量为样品总重的99.32%~91.20%,102.60 ℃失重速率最大达到51.20 μg/min,此阶段为自由水的挥发;243.84~588.87 ℃时有较大的失重,剩余质量为样品总重的90.89%~40.07%,298.70 ℃失重速率最大达到390.10 μg/min,此为壳聚糖的部分分解。空白壳聚糖微球存在2个失重阶段,69.14~161.79 ℃时剩余质量为样品总重的99.02%~84.34%,118.0 ℃失重速率最大达到127.14 μg/min;185.15~588.87 ℃时有较大的失重,剩余质量为样品总重的79.82%~32.71%,244.30 ℃ 失重速率最大达到174.50 μg/min。载硒壳聚糖微球存在2个失重阶段,68.05~158.93 ℃时,剩余质量为样品总重的99.48%~88.88%,117.8 ℃失重速率最大达到74.90 μg/min;177.54~588.38 ℃时有较大的失重,剩余质量为样品总重的87.71%~30.79%,225.50 ℃失重速率最大达到334.30 μg/min。
2.5 载硒CS微球体外缓释性能的调控
将表1中9组正交试验组制备的载硒CS微球样品进行体外缓释试验,探求微球的缓释可控性。准确称取每1种待测样品0.020 g 各3份,装入透析袋中,将透析袋放入10 mL聚乙烯样品管中,向其中加入10 mL模拟体液(SBF),37 ℃恒温水浴,定期取出缓释液5 mL检测其硒含量,计算微球的累计释放量,并同时补加同体积和温度的SBF液。各样品的缓释曲线见图9。图9显示,低浓度的CS和交联剂用量少的试验组制备的微球,释硒速率大于高浓度壁材和交联剂用量多的试验组,试验组1的释放速率最大且持续时间较短,在6 h内累计释放率达到59.6%,有一定的突释现象,而3% CS和15%交联剂的试验组制备的微球缓释效应明显。即微球的释硒速率受CS材壁浓度和交联剂用量的影响很大,而交联温度和投药量对释放速率的影响相对弱化。由此可推断,球壁厚度和交联度是微球药物释放速率的主要控制因素,通过选择相关变量因素的不同水平,调控球壁厚度和交联度,可实现载硒微球硒的可控缓释。
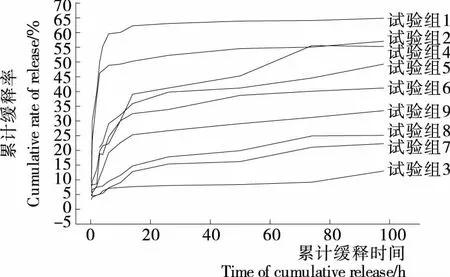
图9 正交试验各组制备的Na2SeO3/CS微球缓释曲线Figure 9 Sustained release selenium curve of Na2SeO3/CS microsphere on orthogonal test
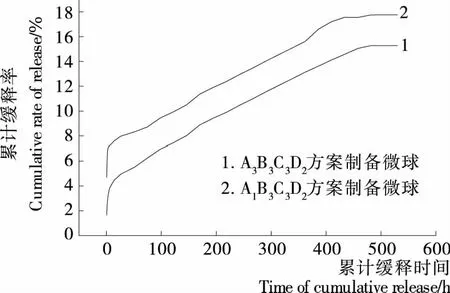
图10 载硒微球的体外累计释放曲线Figure 10 Release curve of drug-loading microspheres in vitro
微球释放介质的pH变化并不明显,仅在pH 7.3~7.4时有较小的波动,表明微球在释硒过程中对释放介质的pH影响较小。
3 结论
本试验研究结果表明:载Na2SeO3壳聚糖缓释微球最佳制备工艺条件为温度65 ℃,壳聚糖浓度3%,亚硒酸钠浓度0.8%,交联剂用量15%,包封率和载药量分别为65.89%,5.05%,且微球形貌优良、平均粒径为10 μm、热稳定性优于单纯的壳聚糖。
体外缓释试验证明,球壁厚度和交联度是微球释硒速率的主要控制因素,通过选择相关变量因素的不同水平,调控这2个因素,可实现载硒微球硒的可控缓释。最佳工艺制备的微球缓释性能良好,缓释速率在482 h后达平稳,有效缓释时间达35 d,即载Na2SeO3壳聚糖微球具有较好的长效缓释能力。
因此乳化交联法制备可控缓释硒的壳聚糖微球是可行的,将该载硒壳聚糖微球应用到食品、药品及精细化工等行业产品中,能有效避免硒的突释效应,为缺硒群体的科学补硒提供一条新途径。后续试验需对该产品进行体外细胞和体内动物试验,以精准评价其应用过程中的生物安全性。

