低氧训练对肥胖大鼠脂肪组织miRNA-27b/PPARγ脂代谢通路的影响
徐建方, 路瑛丽, 冯连世
低氧训练对肥胖大鼠脂肪组织miRNA-27b/PPARγ脂代谢通路的影响
徐建方, 路瑛丽, 冯连世
国家体育总局体育科学研究所, 北京 100061
目的:通过建立高脂饮食单纯营养性肥胖大鼠模型,结合脂肪组织中脂肪酸结合蛋白AFABP1、脂肪酸转运蛋白FATP4和胆固醇反转物ABCA1的表达水平变化,从脂类物质结合和转运的角度探讨低氧训练对miRNA-27b/PPARγ调节通路及其下游相关靶基因表达的影响。方法:SD大鼠肥胖模型验证成功后,随机分为常氧安静组(NC)、常氧训练组(NT)、低氧安静组(HC)和低氧训练组(HT)。NT和HT组分别以20 m/min、25 m/min进行水平跑台训练,持续训练4周,1 h/天,6天/周;NC和HC组不运动;低氧氧浓度为13.6%(相当于海拔3 500 m)。4周后取血清进行血脂测试,肾周脂肪采用qRT-PCR进行miRNA-27b、PPARγ、AFABP1、FATP4、ABCA1基因表达检测。结果:1)HT、HC和NT组大鼠体重低于NC组(<0.01),NT组脂肪重量低于NC组(<0.05),HT组脂肪重低于NC、HC组(<0.01);2)HT、HC组的TC值低于NC组(<0.05),HC、HT组的TG值高于NT组(<0.01),HT、HC组的HDL-C值低于NC、NT组(<0.05);3)HT组的miRNA-27b表达较NC、NT和HC组下调(<0.01);4)HT组的PPARγ mRNA表达较NC、HC组上调(<0.01);5)NT组的FABP1 mRNA表达较NC组上调(<0.01),HC组较NC组下调(<0.01),HT组较NC、HC组上调(<0.01),HT组较NT组下调(<0.01),HT组的FATP4 mRNA较NC组上调(<0.01),HT、HC组的ABCA1 mRNA表达较NC、NT组下调(<0.01)。结论:1)低氧训练较常氧训练和单纯低氧暴露降低肥胖大鼠体重和脂肪重量更有效;2)低氧训练通过抑制脂肪组织miRNA-27表达,上调PPARγ表达,影响下游靶基因AFABP1和FATP4的表达,促进脂肪酸的结合与转运,但却抑制ABCA1表达,引起HDL-C水平下降。
低氧训练;肥胖;miRNA-27b; PPARγ;脂代谢
肥胖问题一直是研究热点,针对脂代谢的不同调节通路,研究人员进行了大量探索。低氧对肥胖的影响也见到诸多报道,研究结果表明,低氧及低氧训练能够显著降低体重和体脂,影响机体脂类代谢,是重要的减控体重方式[4,5,6,18,25,27]。miRNA是大小为20~25个核苷酸的单链非编码、在进化上高度保守的内源性小分子RNA。miRNA在生物体的发育、生长和凋亡、免疫调控、肿瘤发生等过程中均发挥重要作用,参与脂肪细胞分化、糖脂代谢以及能量稳态调控等,与肥胖、糖尿病等代谢性疾病的发生发展密切相关[21,28,36]。研究表明,miRNA通过调节脂类合成、运输以及分解等有关基因的表达,调控脂代谢。随着对miRNA研究的深入,发现miRNA-27b在调节脂肪细胞分化和脂代谢方面发挥重要作用,miR-27b已经成为胆固醇和脂类代谢的调节中心和治疗动脉粥样硬化的潜在靶点。过氧化物酶体增殖物激活受体γ(PPARγ)作为脂代谢转录调控因子,受miRNA-27调节,影响机体脂肪细胞分化和脂代谢,与肥胖紧密相关[12,23,24]。
朱磊等[15]报道,随着低氧训练时间延长,肥胖大鼠肝脏中miR27表达水平逐步降低,而与之相反的是,PPARγ、CD36、ATGL、LPL的表达水平却逐步升高,该研究认为,低氧训练通过miR-27影响PPARγ及其下游脂肪酸代谢相关靶基因,从而改善机体脂代谢水平。查阅文献发现,有关miR-27b/PPARγ通路的研究多集中在肝脏组织,鲜见有关低氧训练对脂肪组织中miR-27b/PPARγ通路影响的报道。而脂肪组织是机体最大的内分泌器官,参与糖脂代谢的调节,在代谢综合征和心血管疾病的发生发展过程中发挥重要作用。
本研究拟通过建立高脂饮食单纯营养性肥胖大鼠模型,结合脂肪组织中脂肪酸结合蛋白AFABP1、脂肪酸转运蛋白FATP4和胆固醇反转物ABCA1的表达水平变化,从脂类物质结合和转运的角度探讨低氧训练对miRNA-27b/PPARγ调节通路及其下游相关靶基因表达的影响。
1 实验材料与方法
1.1 实验对象
出生21天的离乳雄性SD大鼠100只,购自北京维通利华动物技术有限公司(体重56.46±3.59 g),普通饲料喂养1周后(体重92.12±6.09 g),随机分为两组:正常饮食组、高脂饲料组。正常饮食组共10只SD大鼠普通饲料喂养(实验鼠生长维持颗粒饲料,玉米粉40%、面粉20%、豆粕20%、麸皮9%、鱼粉6%、酵母粉1%、豆油1%、食盐0.8%、磷酸钙2%、多种微量元素0.2%),分笼饲养,每笼5只,室温21℃~23℃,湿度40%~60%,自然光照,自由饮食。高脂饲料组共90只SD大鼠(普通饲料主要成分的68%、猪油10%、白糖10%、奶粉10%、豆油1.04%,食盐0.8%、磷酸钙2%、多种微量元素0.2%)喂养12周,经肥胖模型验证成功后,继续高脂饲料喂养2周,分笼饲养,每笼5只,室温21℃~23℃,湿度40%~60%,自然光照,自由饮食。
肥胖模型验证依据:大鼠喂养12周后,从高脂饲料组中体重大于普通饲料组平均体重的大鼠中随机选出10只,保证与剩余大鼠平均体重无显著差异。比较10只高脂饲料大鼠与10只普通饲料大鼠的体重、Lee’s指数、脂肪重(附睾脂肪+肾周脂肪)、脂体比[(肾周脂肪重+附睾脂肪重)/体重×100%]、血脂。结果发现,高脂饲料组大鼠体重(390.22±37.53 g)和Lee’s指数(304.26±8.47)较普通饲料组大鼠体重(363.11±33.09 g)和Lee’s指数(296.32±3.63)分别升高7.5%(>0.05)和2.7%(<0.05)。高脂饲料组大鼠脂肪重(14.82±5.50 g)和脂体比(3.73±0.98)较普通饲料组大鼠脂肪重(10.04±2.40 g)和脂体比(2.78±0.67)分别升高47.6%(<0.05)和34.2%(<0.05)。高脂饲料组大鼠血清TC(1.86±0.24 mmol/L)、LDL-C(0.43±0.10 mmol/L)较普通饲料组大鼠血清TC(1.29±0.22 mmol/L)、LDL-C(0.26±0.04 mmol/L)含量分别升高43.7%(<0.01)、66.1%(<0.01)。Lee’s指数、脂肪重、脂体比以及TC、LDL-C显著升高,表明高脂饲料饲养12周后肥胖大鼠造模成功。
1.2 分组与训练安排
根据实验大鼠的体重、适应性训练情况,将40只肥胖大鼠随机分为4组,各组之间体重无显著性差异;分组后的实验动物按表1安排生活和训练。
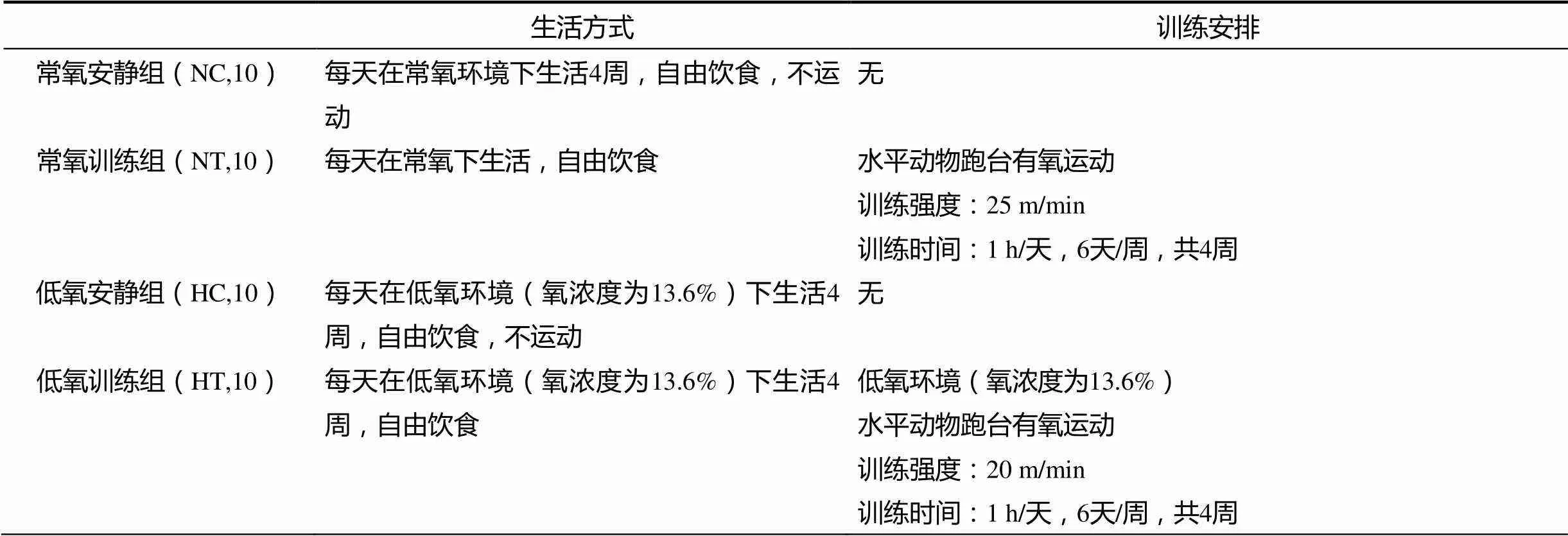
表1 本研究实验动物生活及训练安排
注:常氧训练和低氧训练跑速是依据前期研究和预实验结果确定的。本课题组在前期研究中发现,普通SD大鼠进行递增负荷确定实验强度时,常氧训练组和低氧训练组的血乳酸出现拐点的对应速度分别为30 m/min和25 m/min;而本研究实验对象为肥胖大鼠,其运动能力较弱,在预实验时低氧环境下肥胖大鼠不能完成25 m/min的强度训练,后为保障有氧强度的一致性,实验大鼠训练强度定为:常氧训练组为25 m/min,低氧训练组为20 m/min。
1.3 取材
安静组4周末,运动组最后一次训练恢复24 h后取材。对实验大鼠称重后按0.3 ml/100 g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠。腹主动脉取血后,37℃水浴30 min,3 000 rpm离心15 min,吸取血清,待测;分离出肾周脂肪,称重、分装、液氮中保存,待测。
1.4 试剂与仪器
主要试剂:引物(Invitragen miRNA逆转录试剂盒)、DEPC(Sigma)、氯仿、异丙醇、无水乙醇(上海化学试剂公司)、RT试剂(BPI)、荧光定量PCR试剂(TAKARA)、SYBR Green I(TAKARA)、RNeasy Plant Mini Kit(QIAGEN)、RNeasy Mini Kit(QIAGEN)。
主要仪器:MULTISKAN MK3全自动多功能酶标仪(Thermo,USA)、CFX 96Connect荧光定量PCR仪(USA BIO-RAD)、FTC2000荧光定量PCR仪(Canada)、高速离心机(Eppendorf)。
1.5 测试方法
血脂指标采用全自动生化分析仪进行测试,具体操作过程依说明书进行。
脂肪组织miRNA-27、PPARγ、AFABP1、FATP4、ABCA1表达采用SYBR Green I荧光染料RT-PCR测试,具体步骤如下。
1.5.1 总RNA提取
参照QIAGEN RNeasy Mini Kit说明书提取RNA,1%琼脂糖凝胶电泳检测结果。
1.5.2 反转录
反转录过程参照试剂盒说明书进行。
miRNA-27b反转录总反应体系为15 µl,含3 µl RT Primer、1 µl总RNA、0.5 µl RNaseOUT、1.5 µl 0.1 mmol/L DTT、3 µl 5RT×buffer、1 µl 2.5 mmol/L dNTP、1 µl反转录酶,最后加无RNA酶水至15 µl。冰浴5 min,16℃ 30 min,42℃ 30 min,70℃ 15 min。
PPARγ、AFABP1、FATP、ABCA1 mRNA反转录总反应体系为40 µl,2.5 μg/μl oligo(dT)18(2 μl)、5 μg 总RNA()混匀后68℃ 5~10 min,立即置于冰上5 min,加入1 μl RNaseOUT、4 μl 0.1 mmol/L DTT、8 μl 5X RT buffer、10 μl 2.5 mmol/L dNTP,混匀后42℃ 2 min,加入反转录酶2 μl,混匀42℃ 1~1.5 h,70℃ 15 min。
1.5.3 引物序列
引物由上海生工生物技术有限公司合成。
ACTB FW: ACAGGATGCAGAAGGAGATTAC, RV: ACAGTGAGGCCAGGATAGA, 产物长度117bp;PPARγ FW: GCCTAAGTTTGAGTTTGCTGTG, RV: GCGGTCTCCACTGAGAATAA TG , 产物长度97bp;FABP1 FW:GGTCAAGGCAGTGGTTAAGA, RV:GTCACCCAGTGTCATGGTATT, 产物长度118bp;FATP4 FW:CTGGACCCTAACTCAATGTACC, RV:TGAAGGTGCCTGTTGTATCC, 产物长度107bp;ABCA1 FW:AGGAGGGAAGATCCGTAGTT, RV: CTGAACCTCCCATTGACCATTA, 产物长度94 bp。
1.5.4 RQ-PCR 检测
1. RQ-PCR 反应体系的配制(本实验采用20 µl反应体系)。
miRNA-27b:在Real-time PER 管中依次加入10 X buffer(2 µl)、Primer(1 µl)、 cDNA(1.33 µl)、DEPC水(13.17 µl)、10 X2.5mmol/L dNTPs(2 µl)、HSTaq(0.5 µl),95℃ 10 min、95℃ 15 s、60℃ 60 s循环40次后检测。
PPARγ、AFABP1、FATP、ABCA1 mRNA:在Real-time PER 管中依次加入10 X buffer(2 µl)、Primer(0.4 µl×2)、cDNA(1 µl)、DEPC水(12.7 µl)、10×2.5 mmol/L dNTPs(2 µl)、SRBR GreenI(1 µl)、HSTaq(0.5 µl),95℃ 3 min、94℃ 20 s、60℃ 20 s、72℃ 20 s循环40次、72℃检测。
2. 测CT 值并分析R熔解曲线。
3. 每个样本重复3次。
4. 以ACTB作为内参,依据CT比较法进行相对定量分析,△Ct=Ct(目的基因)-Ct(内参基因,△△Ct=△Ct(实验组)-△Ct(对照组),相对表达量=2﹣△△Ct。
1.6 统计方法
使用统计软件SPSS 16.0对数据进行分析,以平均数±标准差(±)表示,显著性水平定为=0.05。将氧浓度和训练方式作为组间主因素,分别对肥胖大鼠各数据进行双因素方差分析。
2 实验结果
2.1 不同运动方式对肥胖大鼠体重、肾周脂肪重的影响
图1结果表明,HT组和NT组大鼠体重较NC组显著下降(<0.01),HC组大鼠体重较NC组显著下降(<0.05);NT组大鼠脂肪重较NC组显著下降(<0.05),HT组大鼠脂肪重较NC组和HC组显著下降(<0.01)。
双因素方差分析结果显示,训练因素对体重有显著影响(<0.01),说明训练能显著降低肥胖大鼠体重;氧浓度、训练对脂肪重有显著影响(<0.05,<0.01),说明低氧和训练都能显著降低肥胖大鼠肾周脂肪重。
2.2 不同运动方式对肥胖大鼠血脂水平的影响
双因素方差分析显示,氧浓度对TC、HDL-C有显著影响(<0.05,<0.01),说明低氧能显著降低高脂饮食大鼠血清TC、HDL-C水平;氧浓度、训练对TG有显著影响(<0.01,<0.05),说明低氧能显著升高血清TG水平,训练能显著降低血清TG水平(图2)。
2.3 不同运动方式对肥胖大鼠脂肪组织miRNA-27b表达水平的影响
图3结果表明,HT组大鼠脂肪组织miRNA-27表达水平较NC组、NT组和HC组均出现显著下调(<0.01)。
双因素方差分析结果显示,氧浓度×训练交互作用对肥胖大鼠脂肪组织的miRNA-27影响显著(<0.01),而单纯低氧和训练虽然有上调趋势,但不具有显著性。
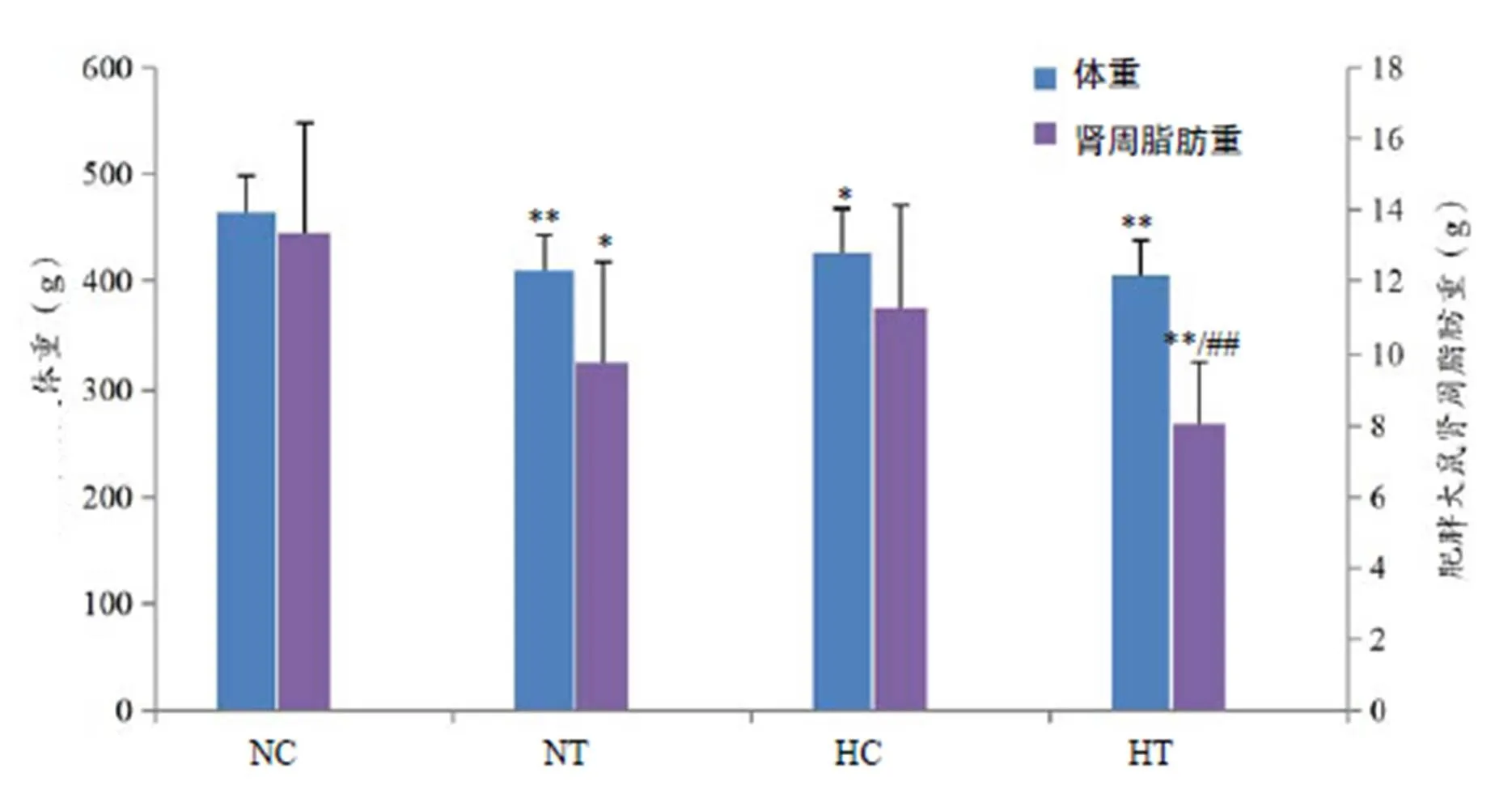
图1 肥胖大鼠体重、肾周脂肪重变化
Figure 1. The Changes of Body Weight and Perirenal Fat Weight in Obese Rats
注:*表示与NC组比较有显著性差异(<0.05),**表示与NC组比较有极显著性差异(<0.01);##表示与HC组比较有极显著性差异(<0.01),下同。
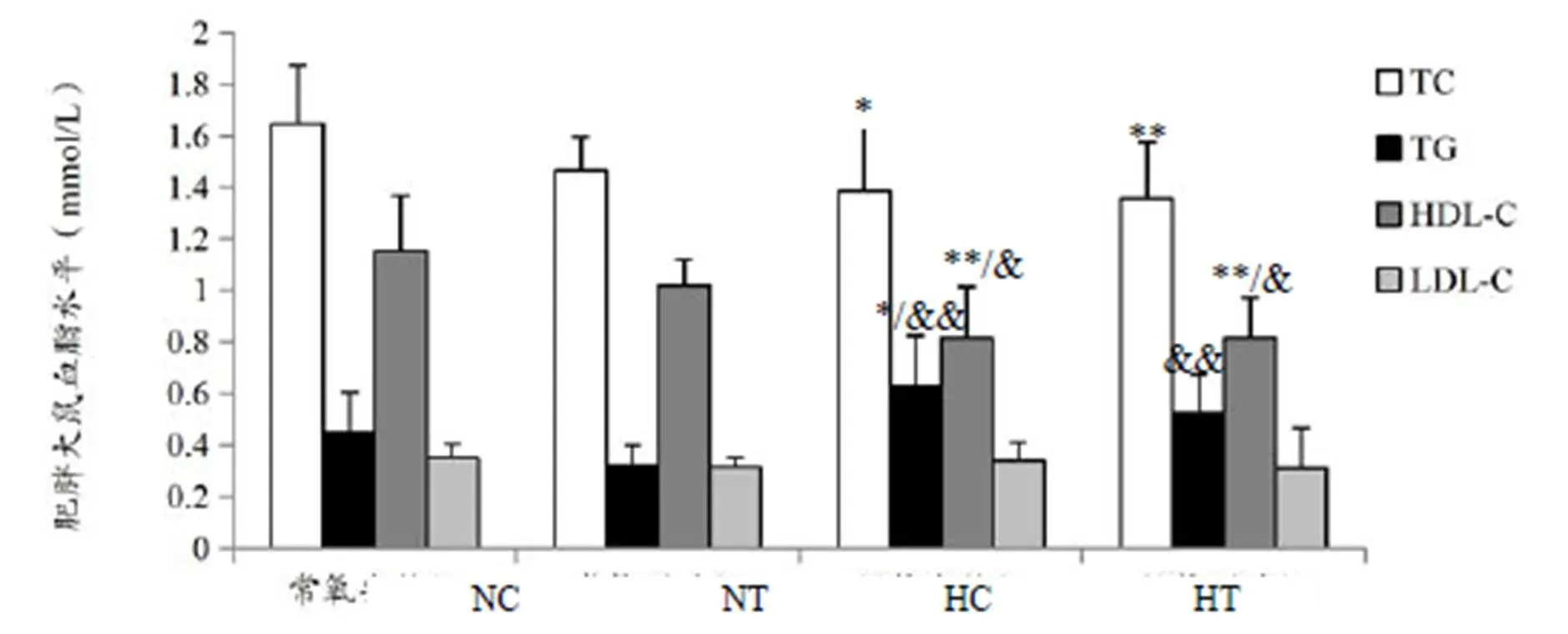
图2 肥胖大鼠血脂变化
Figure 2. The Changes of Blood Lipids in Obese Rats
注:&表示与NT组比较有显著性差异(<0.05),&&表示与NT组比较有极显著性差异(<0.01),下同。
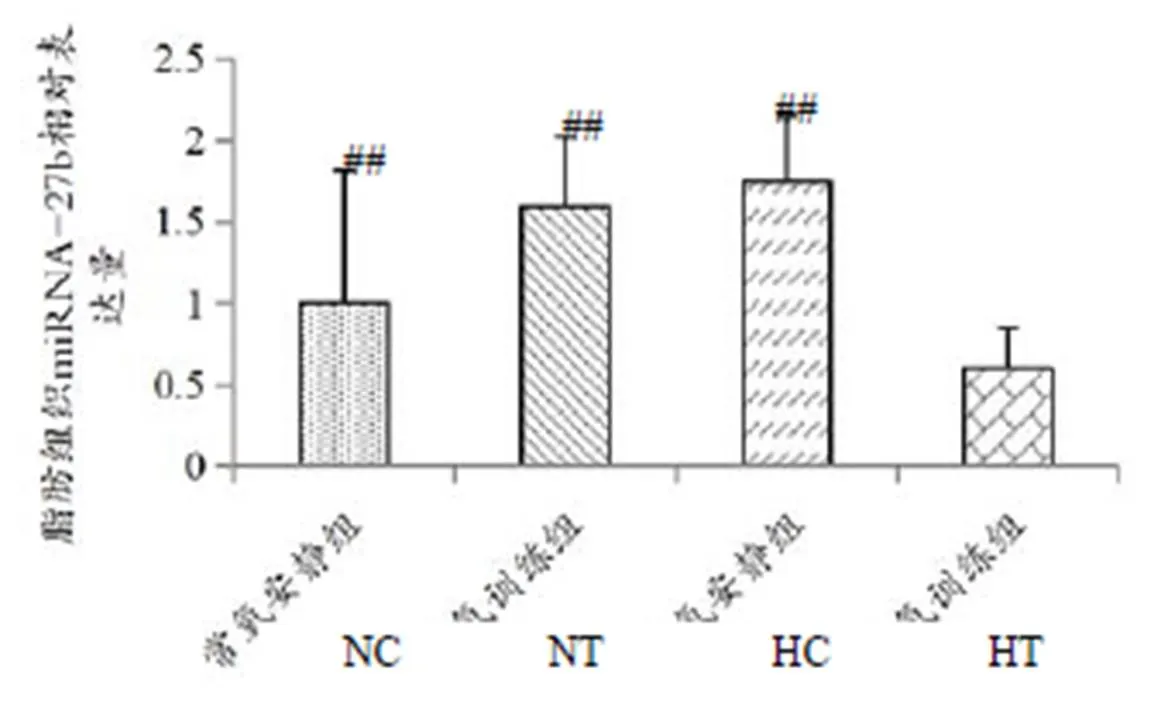
图3 脂肪组织miRNA-27b基因表达
Figure 3. The Expression of miRNA-27b in Adipose Tissue
2.4 不同运动方式对肥胖大鼠脂肪组织PPARγ mRNA基因表达水平的影响
图4结果表明,NT组大鼠脂肪组织PPARγ mRNA基因表达水平较NC组比较有显著性上调(<0.01);HT组大鼠脂肪组织PPARγ mRNA基因表达水平较NC组和HC组均显著上调(<0.01)。
双因素方差分析结果显示,训练和氧浓度×训练对肥胖大鼠脂肪组织中PPARγ mRNA基因表达具有显著性影响(<0.01)。
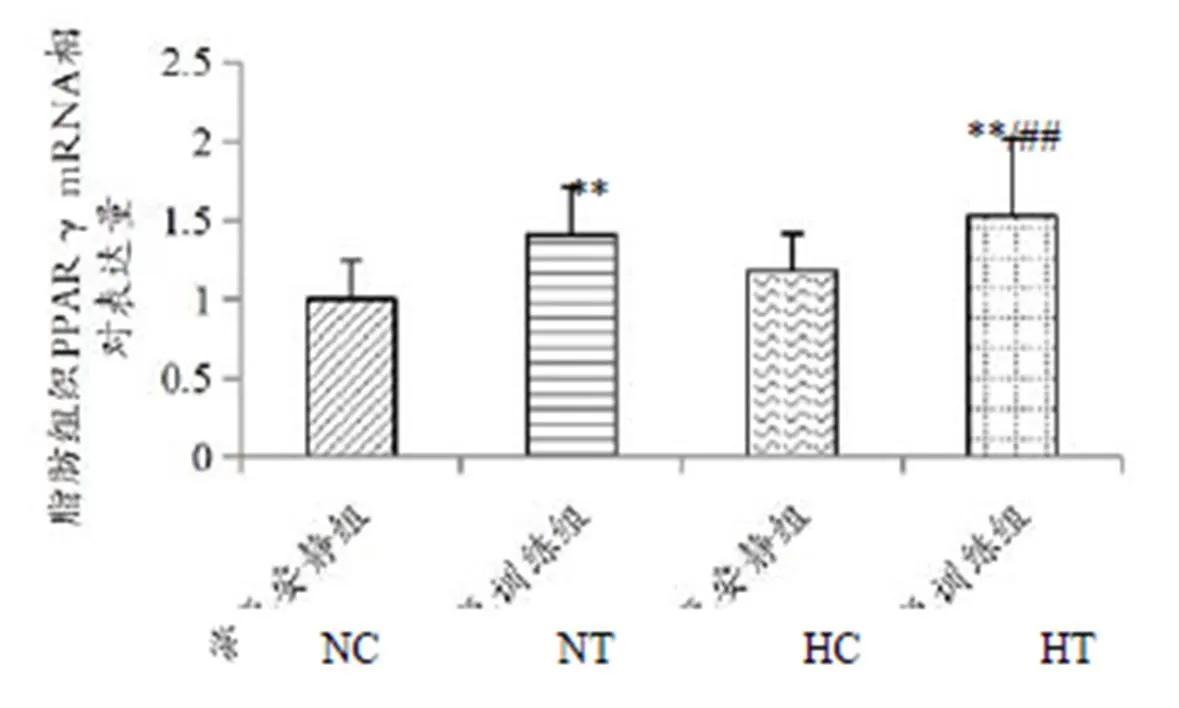
图4 脂肪组织PPARγ mRNA基因表达
Figure 4. The Expression of PPARγ mRNA in Adipose Tissue
2.5 不同运动方式对肥胖大鼠脂肪组织脂代谢相关基因的影响
图5结果表明,NT组大鼠FABP1 mRNA表达水平较NC组显著上调(<0.01);HC组大鼠FABP1 mRNA表达水平较NC组显著下调(<0.01);HT组大鼠FABP1 mRNA表达水平较NC组和HC组显著上调(<0.01),而较NT组大鼠显著下调(<0.01)。HT组大鼠FATP4 mRNA较NC组显著上调(<0.01)。HC组大鼠和HT组大鼠ABCA1 mRNA表达水平较NC组和NT组显著下调(<0.01)。
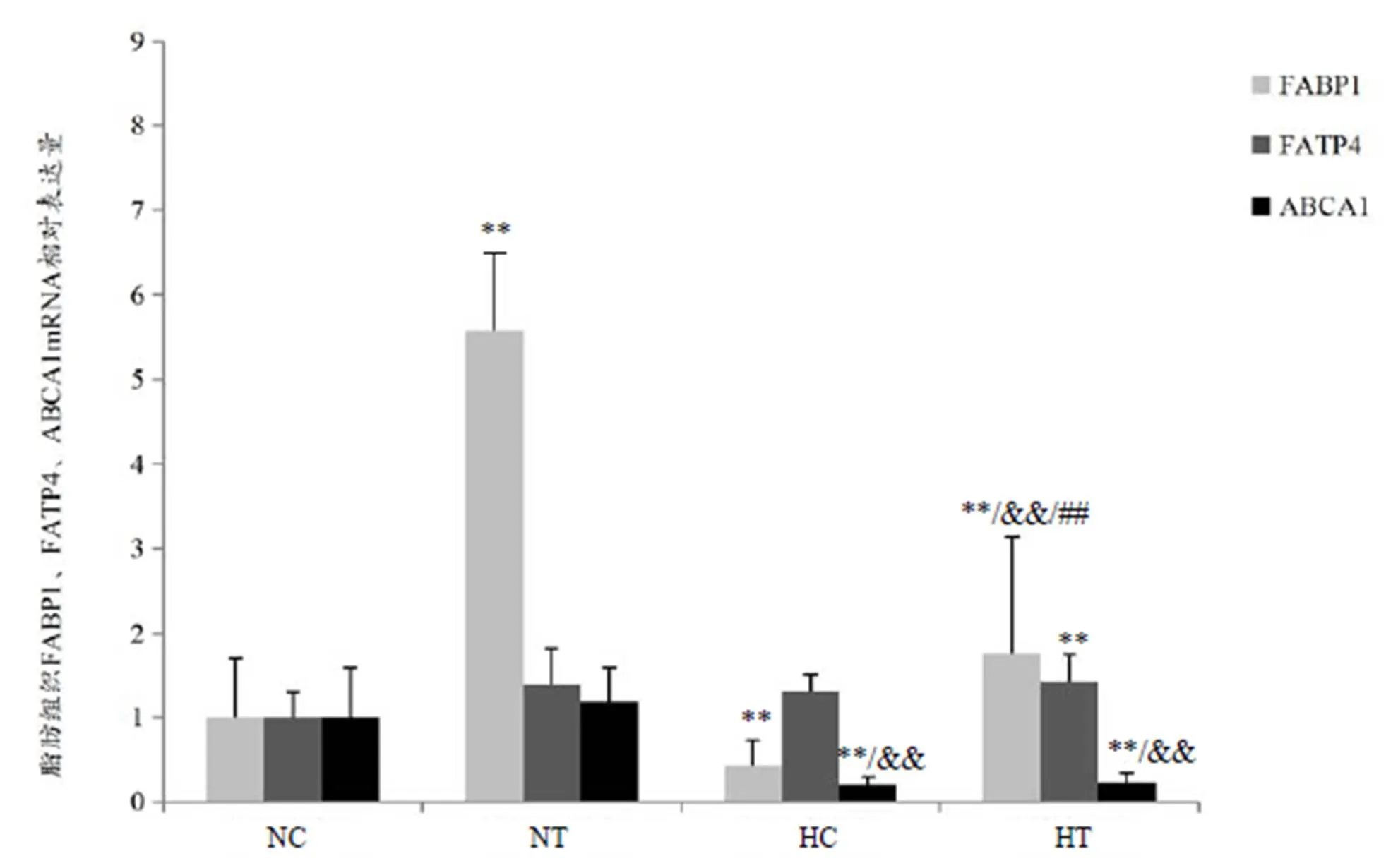
图5 脂肪组织脂代谢相关基因mRNA表达
Figure 5. The Expression of Lipid Metabolism Related Gene mRNA in Adipose Tissue
双因素方差分析结果显示,氧浓度、训练和氧浓度×训练交互因素均对肥胖大鼠脂肪组织中FABP1 mRNA基因表达作用显著(<0.01);氧浓度和氧浓度×训练交互因素对肥胖大鼠脂肪组织ABCA1 mRNA表达水平均具有显著作用(<0.01)。
3 分析与讨论
3.1 低氧训练对肥胖大鼠体重、脂肪重的影响
有研究表明,长时间低氧环境暴露或低氧环境下训练均能引起体重降低,且低氧训练降低体重和减少体脂的效果更明显。研究认为,低氧暴露和低氧训练导致体重降低的原因主要在于:1)低氧暴露或低氧训练导致食欲下降,能量摄入减少;2)在低氧环境下能量消耗增加。通常上述两方面共同影响体重变化,究其原因是使机体能量消耗大于吸收,产生能量负平衡[8,9,29,34]。
本研究结果显示,常氧训练和低氧训练均能显著降低肥胖大鼠体重,单纯低氧暴露也能显著降低体重,但在降低体重幅度上,由强到弱依次为低氧训练、常氧训练和单纯低氧暴露,体重下降幅度分别为12.7%、11.8%和8.2%,表明,低氧训练对肥胖大鼠体重影响最为明显,降体重效果最好。Netzer等[30]研究发现,每周进行90 min的低氧低强度训练,持续8周后,低氧训练组体重和BMI下降量较对照组更为明显,与本研究结果一致。
脂肪重量的变化也表现出相同趋势,即低氧训练和常氧训练显著降低肥胖大鼠肾周脂肪重,分别下降39.4%和26.5%;单纯低氧暴露后,肥胖大鼠肾周脂肪重也呈现出降低,下降幅度达到15.8%。李旭武等[5]、雷雨等[6]、吴秋桃等[10]研究结果也显示出常氧训练和低氧训练对体重、体脂有显著影响。
综上所述,本研究认为,低氧暴露及低氧训练降低体重和体脂的原因可能是低氧暴露和中等强度训练提高了大鼠能量消耗,使消耗/摄入比例提高,尤其是代谢过程中提高了脂肪利用率。
3.2 低氧训练对肥胖大鼠血脂的影响
肥胖往往伴随着血液中TC、TG和LDL-C浓度的升高及HDL-C浓度的降低,有研究证实,运动降低机体TC、TG、LDL-C浓度和提高HDL-C浓度,从而改善脂代谢。不同研究报道对于低氧暴露引起脂代谢变化的研究结果不太一致,究其原因可能是低氧程度和低氧时间不同而导致[9,29,34]。
本研究发现,与常氧安静组相比,低氧安静组和低氧训练组大鼠血清TC浓度分别显著降低15.9%和17.8%,表明,单纯低氧暴露和低氧训练均有助于降低机体血清TC浓度。低氧安静组和低氧训练组血清HDL-C浓度较常氧安静组显著降低29.22%和29.3%,低氧安静组和低氧训练组比常氧训练组显著降低19.7%和19.8%。有研究提出,低氧暴露和低氧训练能显著降低高脂饮食大鼠血清TC浓度,降低心血管、动脉粥样硬化等脂代谢疾病的风险;而由于血清TC浓度降低,需要转运入肝的胆固醇减少,因此血清HDL-C水平显著降低,这与本研究结果较为一致[8,32]。
从血清TG浓度变化来看,低氧安静组比常氧安静组血清TG浓度显著升高40.1%,比常氧训练组血清TG浓度升高95.5%;低氧训练组比常氧训练组血清TG浓度显著升高63.7%,结果表明,常氧训练有助于降低机体血清TG水平,而低氧刺激则提高了机体血清TG水平,且低氧训练在一定程度上逆转单纯低氧的这种作用。提示,低氧环境刺激可能导致机体脂肪动员加快,使血清TG水平出现一定程度升高,机体安静状态下有脂肪供能比例增加。因此,低氧训练加速了脂肪动员和脂类在血液中的运输,增加了脂肪的利用,最终使脂肪质量减少。
虽然本研究发现,常氧训练组、低氧安静组、低氧训练组大鼠血清LDL-C浓度与常氧安静组大鼠血清LDL-C浓度间不具有显著性差异,但分别降低10.5%、3.2%、11.1%的结果也充分显示出常氧训练和低氧训练均具有一定改善肥胖大鼠LDL-C的作用。
3.3 低氧训练对肥胖大鼠microRNA-27b表达水平的影响
miRNA是一类由20~25个核苷酸组成的内源性非编码小RNA分子。miRNA在RNA聚合酶Ⅱ的作用下转录成为pri-miRNA,在细胞核内进一步被加工为中间体pre-miRNA,然后转运到细胞质中,经过一系列酶切反应后形成成熟miRNA。成熟miRNA与RNA诱导的沉默复合体结合于目标mRNA的3’非翻译端(3′UTR)区域,引起目标mRNA的降解或者抑制其翻译,从而实现对靶基因的表达发挥转录后调控作用[19,28,33]。
研究证实,miR-27可与PPARγ的3’UTR特异结合,抑制PPARγ的表达,因此,PPARγ被认为是miR-27的靶基因。miR-27有miR-27a和miR-27b两个亚型,miR-27a参与多种肿瘤的发生和发展,调节机体脂代谢和糖代谢过程,与脂肪组织的发育成熟及糖尿病的生成密切相关;miR-27b不仅调控脂肪干细胞的脂向分化,而且可以通过下游靶基因PPARγ调节机体脂代谢过程,在脂肪生长中发挥负向调节作用。因此,miR-27作为成脂抑制因子,是脂肪细胞发育和脂肪形成过程中特异的核心转录调控因子[17,23,33]。肖金刚等[12]通过建立脂肪干细胞体外脂向分化模型,采用miRNA芯片及qRT-PCR检测,发现脂肪干细胞体外脂向分化过程中miRN-27b表达显著下调,认为miRNA-27b与脂肪干细胞的脂向分化密切相关,并可能通过调控靶基因PPARγ的表达而影响脂肪干细胞的脂向分化。
本研究发现,低氧训练组大鼠脂肪组织中的miR-27b表达水平较常氧安静组、常氧训练组和低氧安静组分别下调39.6%、62.0%、65.4%,且均具有显著性差异;而单纯有氧训练和单纯低氧对肥胖大鼠脂肪组织miR-27b表达不具有显著性影响,但均表现出升高趋势。提示,低氧训练能通过下调肥胖大鼠脂肪组织miR-27的表达,促进脂肪细胞分化。Lin等[24]研究指出,miR-27在脂肪分化过程中下调,miR-27的过表达则抑制脂肪细胞形成,且miR-27通过下调PPARγ从而调控脂肪细胞生成。他们同时发现,在肥胖小鼠脂肪组织中,miR-27表达增加,并受低氧环境影响。在模拟类似于肥胖小鼠氧合水平的1%氧浓度环境下,前脂肪细胞中miR-27a表达水平升高约2倍,miR-27b表达水平升高约1.5倍,他们的研究与Kulshreshtha等[23]报道肿瘤细胞中低氧诱导miR-27a表达上升一致。而在21%氧浓度条件下进行的脂肪分化中,miR-27a和miR-27b表达水平则在24 h后降低[23]。导致本研究与上述研究结果不一致的原因可能是低氧程度不一致对机体造成的低氧刺激不同,本研究的低氧浓度是13%,而Lin等的研究中氧浓度为1%。
3.4 低氧训练对肥胖大鼠PPARγ mRNA表达水平的影响
PPARγ在脂肪组织中高表达,有脂肪组织特异性。PPARγ有广泛的生物学效应,在脂肪细胞分化、糖脂代谢平衡、胰岛素敏感性、抑制炎症反应、抗动脉粥样硬化和抗肿瘤等方面均发挥重要作用。研究发现,PPARγ在脂肪细胞分化的早期有表达,在脂肪细胞分化过程中,通过正反馈调控,PPARγ表达水平不断升高,到脂肪细胞成熟时表达量达到最高。PPARγ诱导脂肪细胞分化过程中能够直接在转录水平激活ap2、磷酸烯醇式丙酮酸羧基酶(PEPCK)等基因。PPARγ在脂代谢途径中参与AFABP、磷酸烯醇式丙酮酸羧激酶(PEP-CK)、乙酰辅酶A合成酶(ACS)、FATP、脂肪酸移位酶(FAT/CD36)、脂蛋白脂酶(LPL)、肉毒碱乙酰肉毒碱转位酶(CACT)、ABCA1等基因的调控[3,31]。
运动过程中由于机体激素水平、能量代谢和酸碱平衡等方面的变化,可能影响PPARγ的表达水平,进而影响机体脂代谢[1,26,35]。但报道结果不一致,陈玉娟等[2]发现,8周耐力游泳运动后,大鼠脂肪组织中PPARγ蛋白表达量显著上升。柏友萍等[1]则指出,高、中、低不同运动强度结合共轭亚油酸运动后肥胖大鼠脂肪组织PPARγ mRNA表达和蛋白表达虽均高于对照组,但不具显著性差异,因此认为受运动强度影响较小。
本研究结果发现,低氧训练组和常氧训练组肥胖大鼠脂肪组织PPARγ基因表达水平较常氧安静组脂肪组织PPARγ基因表达水平分别显著性上调52.88%和41.13%;低氧安静组PPARγ基因表达水平较常氧安静组虽然上调18.82%,但不具显著性差异;低氧训练组PPARγ基因表达水平较低氧安静组显著上调28.66%。从双因素方差分析结果看,氧浓度对脂肪组织中PPARγ mRNA基因表达影响不明显,而训练和氧浓度×训练则对脂肪组织中PPARγ mRNA基因表达具有非常显著性影响。提示,单纯低氧刺激时可能由于低氧程度不够从而导致对肥胖大鼠脂肪组织中PPARγ mRNA基因表达影响不及单纯训练、低氧和训练的双重刺激。
3.5 低氧训练对肥胖大鼠脂肪组织脂代谢相关基因表达水平的影响
研究表明,低氧及低氧训练通过对脂肪合成与分解关键酶的活性及其相关基因与蛋白的表达进行影响,从而调控机体脂代谢。多数研究表明,低氧及低氧训练对脂肪酸合成代谢能力有降低作用,且低氧及低氧训练加快脂肪酸的分解。低氧暴露(1%O2浓度)通过抑制SREBP-1c表达,下调FAS mRNA表达水平,减少FAS合成,从而抑制细胞中脂肪的生成[7,11,22]。
FABP和FATP作为机体内重要的脂肪酸结合与转运载体,广泛存在于各细类胞中,通过结合饱和及不饱和长链脂肪酸,促进脂肪酸的结合和转运,影响脂肪酸的摄取、储存及排出,调控脂类生成及降解。研究表明,剧烈运动或长期锻炼,会引起FAT、FABP和FATP从胞浆内的“储存池”快速移动到胞膜上,心肌和骨骼肌细胞中FATP表达增加,促进脂肪酸的大量摄入以供机体能量代谢之需[14,16]。
本研究结果显示,常氧训练组肥胖大鼠脂肪组织FABP1 mRNA表达水平上调幅度较大,较常氧安静组显著上调458.3%;低氧安静组肥胖大鼠脂肪组织FABP1 mRNA表达水平较常氧安静组和常氧训练组分别显著下调56.94%和92.29%,表明低氧暴露在一定程度上抑制其表达;低氧训练组肥胖大鼠脂肪组织FABP1 mRNA表达水平较常氧安静组和低氧安静组显著上调76.39%和309.68%,较常氧训练组显著下调68.41%。提示,低氧训练有助于反转这种作用。同时,低氧训练组肥胖大鼠脂肪组织FATP4 mRNA表达水平较常氧安静组显著上调42.53%,表明低氧训练有助于脂肪酸的转运;较常氧训练组和低氧安静组分别上调3.05%和8.87%,但不具显著性差异。Jeppesen等[20]报道,经过8周训练后,受试者骨骼肌中FATP4的含量上升了33%,且在干预后期,骨骼肌中FATP-4蛋白表达的增加与耐力训练中脂质的氧化显著相关。这与本研究结果表现趋势一致,表明低氧训练、低氧暴露、常氧训练均能在一定程度上加快脂肪酸的转运。
ABCA1介导胞内脂质流出形成新生性HDL-C,抑制动脉粥样硬化的发生发展,起到心血管保护作用。ABCAl基因可被肝X受体(LXR)激动剂转录激活,ABCAl蛋白也可被钙蛋白酶介导降解[22]。张洪侠等[13]通过对ApoE基因敲除小鼠进行14周跑台耐力训练,观察耐力运动的影响时发现,运动组ABCAl mRNA表达上调且主动脉斑块及内膜损伤程度较对照组减轻。显示耐力运动通过增加LXR-α和ABCAl mRNA的表达,而发挥抗动脉粥样硬化的作用。关于低氧环境的作用,莫显刚等[8]则报道,TO-901317上调ABCAl mRNA及细胞膜蛋白水平的表达。无论放线菌酮存在或不存在情况下,缺氧(1%O2浓度)均能降低细胞膜ABCAl蛋白水平,升高钙蛋白酶活性。钙蛋白酶抑制剂ALLN能部分逆转缺氧诱导细胞膜ABCAl蛋白水平降低。因此他们认为,缺氧可能通过增加钙蛋白酶活性,从而加速细胞膜ABCAl蛋白降解。
本研究结果显示,低氧安静组肥胖大鼠脂肪组织ABCA1 mRNA表达水平较常氧安静组和常氧训练组分别显著下调79.74%和82.97%,低氧训练组ABCA1 mRNA表达水平较常氧安静组和常氧训练组分别显著下调77.16%和80.80%;而常氧训练组与常氧安静组,以及低氧训练组与低氧安静组之间均无显著变化。提示,单纯训练对脂肪组织ABCA1 mRNA的表达影响不明显,这与张洪侠等[13]的报道结果不太一致,可能与跑速不同、持续时间长短不一有关。但低氧刺激均下调其表达则与他人研究一致。结合HDL-C结果分析,低氧暴露和低氧训练均在一定程度上降低了机体HDL-C水平,这与ABCA1表达水平的变化情况一致。
4 结论
1. 常氧训练、低氧暴露和低氧训练均有利于通过减少机体脂肪重量降低体重,其中以低氧训练效果最好。
2. 低氧训练通过抑制脂肪组织miRNA-27表达,上调PPARγ表达,影响下游靶基因AFABP1和FATP4的表达,促进脂肪酸的结合与转运,但抑制ABCA1表达,引起HDL-C水平下降。
[1] 柏友萍,李萌,崔建飞,等.不同强度运动结合共轭亚油酸对肥胖大鼠内脏脂肪组织PPARγ表达和血浆PPARγ含量的影响[J].中国运动医学杂志,2015,34(12):1197-1201.
[2] 陈玉娟,张海峰,何玉秀,等. 8周耐力游泳对大鼠白色脂肪组织PPAR蛋白表达脂肪细胞增殖分化的影响[J]. 中国运动医学杂志,2007,26(5):568-570.
[3] 程安玮,万发春,王文亮. PPAR对脂肪细胞的影响[J].中国食物与营养,2009,2:58-60.
[4] 黄徐根, 冯连世,徐建方, 等. 低氧训练过程中大鼠体重及能量代谢的变化[J]. 体育科学, 2007, 27 (10): 61-68.
[5] 李旭武,翁锡全,林文弢. 间歇低氧运动对胰岛素抵抗大鼠体成分及血脂指标的影响[J]. 广州体育学院学报,2014,(4):93-96.
[6] 雷雨,张万秋,崔丽萍. 低氧及低氧结合运动对肥胖大鼠身体成分的影响[J]. 四川体育科学, 2010,(2):39-41.
[7] 卢英民,姚能才,窦存芳,等. 长期运动训练对慢性心力衰竭患者心肌型脂肪酸结合蛋白的影响[J]. 心血管康复医学杂志, 2010, 19(6):583-586.
[8] 路瑛丽,张漓,冯连世,等. 高住高练和高住低练对大鼠血脂及腓肠肌脂肪酸氧化的影响[J]. 中国运动医学杂志,2010,29(2):137-140.
[8] 莫显刚,洪伟,王兰,等.缺氧对细胞膜ABCAl降解的影响及其机制研究术[J].中国现代医学杂志,2017,27(3):13-17.
[9] 王宁琦,胡扬,官余凌,等. 4周低氧运动结合饮食控制对肥胖青年体重、血脂及胰岛素抵抗的影响[J]. 中国运动医学杂志, 2012, (4):289-294.
[10] 吴秋桃,胡蓉,叶春姬. 青年大学生BMI与血压的相关性分析及运动干预实验[J]. 重庆医学 2012,(12):1173-1175.
[11] 武明雷,刘戈力. 脂肪酸结合蛋白与肥胖的关系[J]. 国际儿科学杂志,2013,40(3):257-2598.
[12] 肖金刚,陈建霖,李晓宇,等. 脂肪干细胞脂向分化过程中miRNA-27b表达的研究[J]. 天津医药,2009,37(9):759-761.
[13] 张洪侠,刘善云,周桂桐. 耐力运动对ApoE基因缺陷小鼠肝X受体α和三磷酸腺苷结合盒转运体A1基因表达的影响[J]. 天津体育学院学报,2010,25(6):486-488.
[14] 张喆,张蕴琨. 运动与骨骼肌脂肪酸转运蛋白研究进展[J]. 中国运动医学杂志,2013,32(1):89-94.
[15] 朱磊,路瑛丽,冯连世. 低氧训练诱导 mi R-27/PPARγ调控肥胖大鼠肝脏脂肪酸代谢变化的研究[J]. 中国体育科技,2018, 54(1):115-122.
[16] 邹大进,张征. 肥胖与2型糖尿病的治疗新靶点:脂肪细胞型脂肪酸结合蛋白的抑制研究方兴未艾[J]. 中华糖尿病杂志,2016,8 (2):65-67.
[17] CHEN W J, YIN K, ZHAO G J. The magic and mystery of MicroRNA-27 in atherosclerosis[J]. Atherosclerosis,2012, 222:314-323.
[18] FENG L S , LU Y L. Altitude training in China[C]//International Convention on Science, Education and Medicine in Sport. Glasgow, UK, 2012.
[19] GUO D G, LI Q X, LV Q,. MiR-27a targets sFRP1 in hFOB cells to regulate proliferation, apoptosis and differentiation[J]. PloS One, 2014,9(3):1-11.
[21] KARBIENERA M, FISCHER C,. microRNA miR-27b impairs human adipocyte differentiation and targets PPARγ[J]. Biochem Biophys Res Commun, 2009,390:247-251.
[20] JEPPESEN J, JORDY A B, SJOBERG K A,. Enhanced fatty acid oxidation and FATP4 protein expression after endurance exercise training in human skeletal muscle[J]. PloS One,2012,7(1):1-9.
[22] KRZYSTEK KORPACKA M, PATRYN E, BEDNARZ MISA I,.Circulating adipocyte fatty acid-binding protein,juvenile obesity and metabolic syndrome[J].J Pcdiatr Endoerinol Metab,2011,24(1l-12):921-928.
[23] KULSHRESHTHA R, FERRACIN M, WOJCIK S E,. A microRNA signature of hypoxia[J]. Mol Cell Biol , 2007,27: 1859-1867.
[24] LIN Q, CAO Z G, RODOLFO M,. A role of miR-27 in the regulation of adipogenesis[J]. FEBS J , 2009,276 : 2348-2358.
[25] LING Q, SAILAN W, RAN J,. The effect of intermittent hypoxia on bodyweight, serum glucose and cholesterol in obesity mice[J]. Pak J Biol Sci, 2008,11:869-875.
[26] LIU WX, ZHOU F, WANG Y,. Voluntary exercise protects against ulcerative colitis by up-regulating glucocorticoid-mediated PPAR-gamma activity in the colon in mice[J]. Acta physiol, 2015,215:24-36.
[27] LU Y L, FENG L S, ZHAO P . Effect of Different Hypoxic Training on Body Weight in Rats[C]// International Convention on Science, Education and Medicine in Sport. Glasgow, UK,2012.
[28] LU Y L, JING W, FENG L S,. Effects of hypoxic exercise training on microRNA expression and lipid metabolism in obese rat livers[J]. J Zhejiang Univ Sci B, 2014,15:820-829.
[29] MORO C, GALGANI J E, LUU L,. Influence of gender, obesity, and muscle lipase activity on intramyocellular lipids in sedentary individuals[J]. J Clin Endocrinol Metabol, 2009,94:3440-3447.
[30] NETZER NIKOLAUS C, ROLAND C, THOMAS K. Low intense physical exercise in normobaric hypoxia leads to more weight loss in obese people than low intense physical exercise in normobaric sham hypoxia [J]. Sleep breath, 2008, 12 (2): 129-134.
[31] PERIASAMY S, CHU P Y, LI Y H,. Sesamol ameliorates hypotension by modulating cytokines and PPAR-gamma in systemic inflammatory response[J]. EXCLI J,2015,14:948-957.
[32] RICHALET J P, MEHIDIOI H, RATHAT C,. Acute hypoxia decreases cardiac response to catecholamines in exercising humans [J]. Int J Sports Med, 1988, 9 (2): 157-162.
[33] ROTLLAN N, HEMANDO C F. MicroRNA regulation of cholesterol metabolism[J]. Cholesterol, 2012(8):1-8.
[34] STROBEL G, NEUREITHER M, BARTSCH P. Effect of acute mild hypoxia during exercise on plasma free and sulphoconjug-ated catecholamines [J]. Eur J Appl Physiol, 1996, 73 (1-2): 82-87.
[35] SZOSTAK J, MIGUET-ALFONSI C, BERTHELOT A,. Training-induced anti-atherosclerotic effects are associated with increased vascular PPARgamma expression in apolipoprotein E-deficient mice[J]. Acta physiol,2016,216:221-230.
[36] XIE W, LI L, ZHANG M,. MicroRNA-27 prevents atherosclerosis by suppressing lipoprotein lipase-induced lipid accumulation and inflammatory response in apolipoprotein E knockout mice[J]. PloS One,2016(6):1-20.
Study on the Lipid Metabolism of miRNA-27b/PPARγ in Obese Rats after Hypoxic Training
XU Jian-fang, LU Ying-li, FENG Lian-shi
China Institute of Sport Science, Beijing 100061, China.
This paper is aimed to study the lipid metabolism by detecting the expression of miRNA -27b/PPAR gamma and the target genes in obese rats’ adipose tissue after hypoxic training, which is induced to obese through high-fat diet. Methods: 40 obese rats were divided into 4 groups as the followings: normal oxygen control group (NC), normal oxygen training group (NT), hypoxic control group (HC) and hypoxic training group (HT). All hypoxic training groups stayed in the environment with 13.6% oxygen concentration. The treadmill training was applied with 25m / min in normoxic training group and 20 m/min in hypoxic training group, for 1h/d, 6d/w, 4 weeks. The miRNA-27b, PPARγ, AFABP1, FATP4, ABCA1 mRNA genes expressions in adipose tissue were measured by quantitative fluorescent PCR. Results: 1) The body weight of HT and HC was lower than that of NC (<0.01,<0.01,<0.05), and the kidney fat weight of NT was lower than that of NC (<0.05), while the kidney fat weight of HT was lower than that of NC and HC (<0.01). 2) The level of total cholesterol of HT and HC were lower than NC(<0.05). The level of triglyceride of HC and HT were higher than NT (<0.01). The level of HDL-C of HT and HC were lower than NC (<0.05). 3) The expression of miRNA-27b of HT was significantly down-regulated compared with NC, NT and HC (<0.01). 4) The expression of PPARγ mRNA of HT was significantly up-regulated compared with NC and HC (<0.01), and the expression of PPARγ mRNA of NT was up-regulated compared with NC (<0.01). 5) The expression of FABP1 mRNA of NT was up-regulated compared with NC (<0.01), while HC was down-regulated. The expression of FABP1 mRNA of HT was up-regulated compared with NC and HC (<0.01), while was down-regulated compared with NT (<0.01). The expression of FATP4 mRNA of HT was significantly up-regulated compared with NC. The expression of ABCA1 mRNA of HT and HC was significantly down-regulated compared with NC and NT. Conclusion: 1) The effect of reducing the weight and body fat by HT is better than NC and NT. 2) By inhibiting miRNA-27b expression in adipose tissue, hypoxic training promotes the expression of PPARγ gene and then affects lipid metabolism. Hypoxic training influences the expression of FABP1 and FATP4 through miRNA-27b/PPARγ pathway, and then regulates the transport and binding of fatty acids. Hypoxic training inhibits the expression of ABCA1 through the miRNA-27b/PPARγ pathway, leading to decrease the level of HDL-C.
1002-9826(2018)05-0056-09
10.16470/j.csst.201805009
G804.7
A
国家体育总局体育科学研究所基本科研业务费资助项目(基本14-14, 基本16-18)
徐建方,男,副研究员,博士,主要研究方向为青少年体质健康、优秀运动员训练监控、低氧训练适应机制、体重控制研究,E-mail: xujianfang@ciss.cn。
冯连世,男,研究员,主要研究方向为运动训练监控、高原(低氧)训练、运动与减控体重、运动与青少年健康促进,E-mail:fengls98@126.com。

