槲皮素分子印迹聚合物合成及识别研究
豆鹏飞
(长庆油田公司,陕西 榆林 718100)
槲皮素(Quercetin)其学名为3,3,4,5,7-五羟基黄酮是一类天然具有多种活性的黄酮类化合物[1]。槲皮素分子含有羟基,具备了与功能单体形成氢键的条件,但分子中含有5个羟基,造成了它的极性大而不溶于非极性或弱极性溶剂。槲皮素广泛存在于水果、蔬菜、核桃、茶、和多种天然活性产物中,具有抗氧化、抗病毒、抗肿瘤和调节免疫等多种功能。因其有极高的药用价值,国内外的学者都对槲皮素的药理进行了研究。
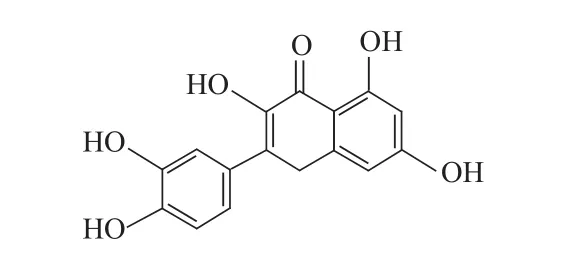
虽然槲皮素的来源广泛,但是如何获得纯度较高的槲皮素提取方法还没有一个标准,现行的提取方法中还存在一些技术上的缺陷,分离成本高,选择性分离效率低,在提取的过程中往往还将槲皮素的类似物一并提取出来。解决这些问题的根本就是研究出新的提取分离方法,解决了核心问题也将使得槲皮素的价值能够充分发挥出来。因此,近年来,许多学者开始探索利用分子印迹技术制备槲皮素的分子印迹聚合物并将其制作成分离提取材料。
天然植物中往往存有很多活性物质以及他们的类似化合物,从天然植物中提取分离一种物质时常常会伴随着类似化合物被提取出来的情况[3]。如本实验中从油茶壳中提取槲皮素时往往会伴有芦丁,异鼠李素等类似物。所以本课题以槲皮素为模板分子,应用分子印迹技术制备槲皮素分子印迹聚合物。探讨最佳的制备方法以获得具有选择识别能力的槲皮素分子印迹聚合物。这将更高效地选择性提取分离油茶壳中的槲皮素,同时对提取分离其他活性物质提供了一个参考,对今后高效选择性地提取分离更多活性组分提供一种新的途径。
1 实验内容
1.1 仪器
主要实验设备见表1。
1.2 试剂
主要实验试剂见表2。
1.3 槲皮素MIPs和非印迹聚合物(NIPs)的制备
在100 mL锥形瓶中加入0.5 mmol槲皮素和5.0 mL甲醇超声溶解,再加入适量AM或4-VP和一定量的乙腈,充分振荡后,于室温下静置12 h, 然后加入8.0 mmol交联剂TRIM和0.02 g引发剂AIBN,超声振荡脱气5 min,并通氮气15 min,密封后置于80℃水浴中,聚合反应12 h。聚合产物缓慢冷却至室温,抽滤分离得到聚合物沉淀。用200 mL甲醇/乙酸(V:V=9:1)混合溶液索氏提取,除去聚合物中的模板分子及未反应的单体,提取完毕后用超纯水水洗,直至pH为7.0为止。于80℃真空干燥箱中干燥24 h,得到 MIPs。
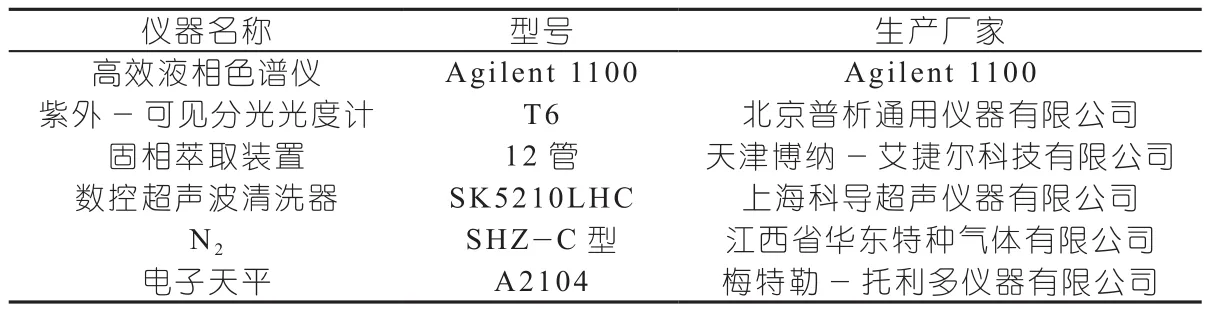
表1 主要实验设备
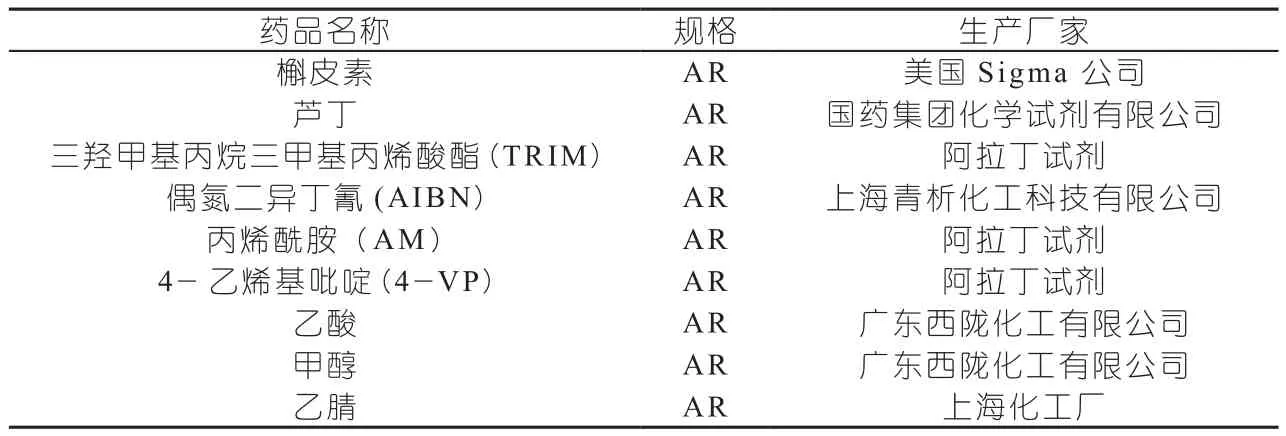
表2 主要实验试剂
非印迹聚合物(NIPs)制备方法与MIPs制备方法相同,只是在反应体系中不加入模板分子槲皮素。得到一系列的MIPs和NIPs用于后备实验。
1.4 槲皮素MIPs和NIPs性能测试
1.4.1 槲皮素MIPs和NIPs吸附容量实验
(1)吸附动力学曲线的制作
分别称取0.10 g制备的MIPs和NIPs置于100 mL磨口锥形瓶中,加入10 mL 0.2 mg槲皮素甲醇溶液,于室温下25℃恒温振荡吸附不同时间,离心分离后取上清液,用高效液相色谱仪测定上清液中槲皮素的浓度,根据吸附前后溶液浓度的变化,计算出MIPs和NIPs的吸附量。
(2)静态吸附等温线的制作
分别称取一组等量的MIPs和NIPs 50 mg,置于10 mL 的离心管中,依次加入 0.02~1.0 mmol/L 的槲皮素甲醇溶液 5.0 mL,置于恒温震荡器中保持25℃振荡 12 h,根据吸附前后的浓度变化计算出单位质量聚合物的结合量,从而得出MIPs和NIPs对槲皮素的吸附等温线。
1.4.2 槲皮素MIPs和NIPs吸附选择性实验
分别称取一组等量的MIPs和NIPs 0.10 g放入100 mL锥形瓶中,加入10 mL 0.2 mg槲皮素和芦丁的甲醇混合标准溶液,于25℃室温下恒温振荡12 h,然后将此混合物转入离心机中,在12 000 r/min的转速下离心10 min。测定槲皮素和芦丁的平衡浓度,根据吸附前后溶液浓度的变化计算MIPs对底物的结合量。
1.5 用高效液相色谱对槲皮素的定量测定实验
用Agilent 1100 高效液相色谱仪分离分析经固相萃取后上样液,淋洗液和洗脱液中的槲皮素及其类似物。液相条件为,色谱柱:Hypersil C18柱(5 μm,4.6 mm×250 mm);流动相A:乙腈,B:质量分数为0.1%的磷酸水溶液;梯度洗脱条件:0~4 min,20%A;4~10 min,20%A→60%A;柱 温 :25℃,流速 :1.0 mL/min,进样量 :20 μL,检测波长 :280 nm、360 nm双波长检测。
1.6 槲皮素MIPs的固相萃取实验
1.6.1 槲皮素MIPs固相萃取柱的制备
采用湿法装柱,称取槲皮素MIPs 0.3 g,加入5.0 mL甲醇制成浆液,装入容量为5.0 mL、直径为8.0 mm的聚丙烯固相萃取空柱中,装填均匀后再用10 mL甲醇冲洗。
1.6.2 槲皮素MIPs固相萃取柱的选择性实验
配置浓度为0.2 mg的槲皮素芦丁混合标准溶液,移取1.0 mL标准溶液置于固相萃取柱中,上样液收集完后,用一定体积甲醇溶液洗脱,收集淋洗液;最后用一定体积的甲醇/乙酸(V:V=9:1)的溶液洗脱固相萃取柱,并收集洗脱液。上样液、淋洗液和洗脱液分别用氮吹仪浓缩至干,用甲醇定容至1.0 mL,以备测定。
1.7 槲皮素MIPs的再生识别能力测试
用槲皮素MIPs吸附剂制备的固相萃取柱重复固相萃取实验,将上样液、淋液、洗脱液收集后用高效液相色谱测定其峰面积计算槲皮素的回收率。
1.8 槲皮素MIPs对油茶壳提取样品的应用实验
将油茶壳提取物蒸干后用甲醇定容至10.0 mL,移取1.0 mL于固相萃取柱中,上样液收集完后,用一定体积甲醇溶液洗脱,收集淋洗液;最后用一定体积的甲醇/乙酸(V:V=9:1)的溶液洗脱固相萃取柱,并收集洗脱液。上样液、淋洗液和洗脱液分别用氮吹仪浓缩至干,用甲醇定容至1.0 mL,以备测定。
2 实验结果与讨论
2.1 槲皮素MIPs制备方法的比较
分别采用本体聚合法和沉淀聚合法制得槲皮素MIPs,测定其最大吸附容量及结合槲皮素和芦丁标准样品测得其分离因子如表3所示。取沉淀聚合法制得的槲皮素MIPs做吸附动力学曲线如图1所示。

表3 不同制备方法制得的槲皮素MIPs比较
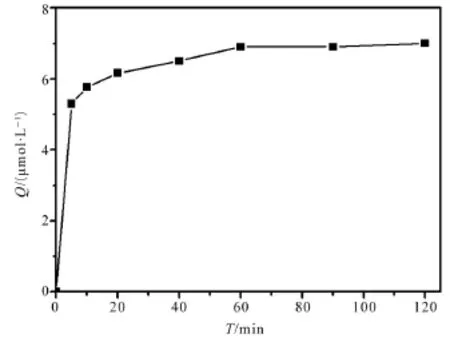
图1 沉淀聚合合成MIPs的吸附动力学曲线
考察沉淀聚合法和传统本体聚合法对槲皮素分子的吸附容量和选择性。目前大部分槲皮素印迹聚合物采用本体聚合法制备[4],采用此聚合方式普遍存在的问题是:MIPs吸附容量低、印迹分子识别速率慢和选择性不高等等。采用本体聚合制备槲皮素分子印迹聚合物,如表3所示其最大吸附容量为1.60 μmol/g,吸附9 h后才基本达到吸附平衡,他们以槲皮素和芦丁进行结合实验,得到其分离因子α为1.84;而采用本方法得到槲皮素最大吸附容量为6.93 μmol/g,是其吸附容量的3.08倍;其分离因子α为4.33,并且在120 min内即能达到吸附平衡;其吸附动力学曲线由图1所示,可以看出:MIPs在前10 min的吸附速率很快,吸附量已经占到总吸附量的82.3%。吸附平衡在60 min左右即能达到吸附饱和。与传统本体聚合法相比,沉淀聚合合成的MIPs对模板分子的吸附速率要快得多,这可能是因为:MIPs较快的吸附速率与聚合物颗粒的粒径较小有关,由于沉淀聚合得到的MIPs颗粒粒径小,模板分子传输到MIPs上的传质阻力大大减小,因而识别空穴的时间要短,而表观的总吸附速率也要快得多。
2.2 槲皮素MIPs功能单体的选择
2.2.1 功能单体种类对槲皮素MIPs吸附效果的影响
采用沉淀聚合法分别用AM,4-VP,AM/4-VP做功能单体制备槲皮素MIPs,将制得的槲皮素MIPs作为吸附剂用槲皮素芦丁混合标准液做固相萃取实验得出其回收率如表4所示。不同功能单体混合比例制备槲皮素MIPs固相萃取实验回收率如表5所示。不同功能单体制备槲皮素MIPs的吸附量对比结果如图2所示。
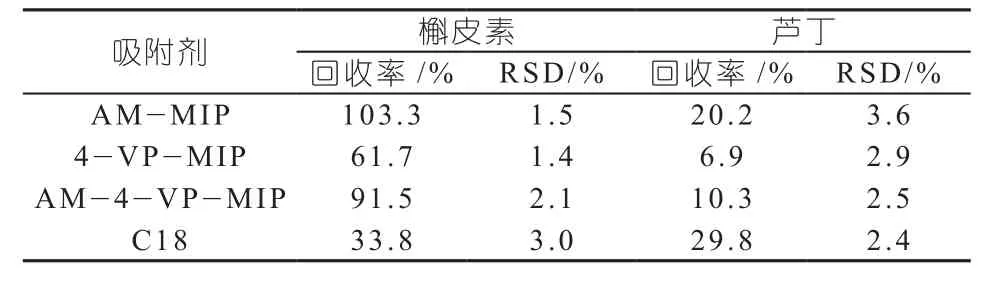
表4 槲皮素和芦丁的回收率(n=3)
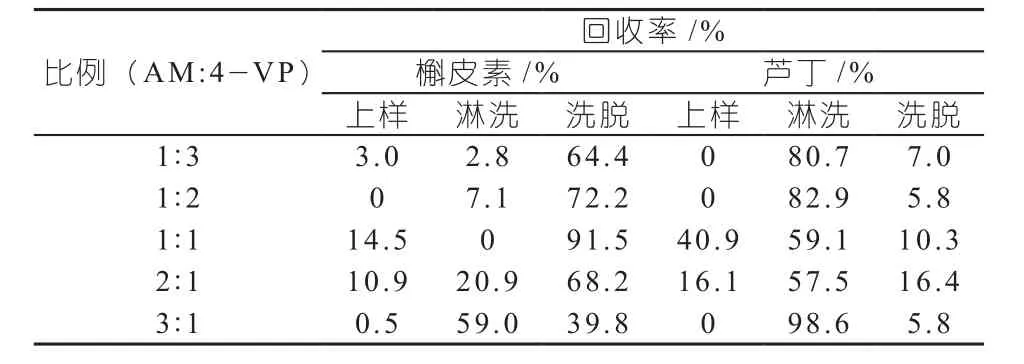
表5 不同比例混和功能单体的回收率
一般来说,印迹酸性的模板分子,适合选用碱性功能单体;印迹碱性的模板分子,则适合选用酸性功能单体。由于槲皮素分子含有多个酚羟基,具有一定的酸性,从理论而言,选择碱性的功能单体会有利于模板分子和功能单体形成稳定的主客体复合物。本实验采用碱性的AM和4-VP做功能单体,考察这两种功能单体对模板分子及其类似物的吸附性和选择性的影响。其结果表明:采用4-VP为功能单体,对模板分子识别效果较AM更强、选择性也更高;其用作固相萃取吸附剂对模板分子槲皮素及其类似物的保留能力也更强,导致难于洗脱。如表3所示,用4-VP做功能单体的吸附剂对槲皮素的回收率仅为61.7%,远小于用AM做功能单体的回收率,达到103.3%;而对类似物芦丁的回则收率远低于AM。究其原因,可能是4-VP和槲皮素之间除了氢键、离子间作用力外,吡啶环的疏水效应和模板分子槲皮素及其类似物间也有相互作用,这几种作用使得4-VP对槲皮素分子的保留强于AM。而采用AM和4-VP混合功能单体对模板分子的选择性和吸附量较高,其固相萃取回收率和特异性选择性明显高于商品化的C18固相萃取柱。
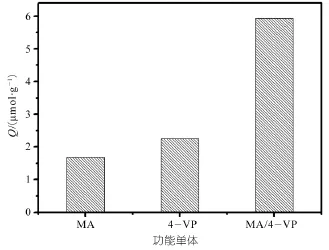
图2 不同功能单体合成聚合物的吸附量
图2比较了分别用AM,4-VP,AM/4-VP做功能单体时聚合物的吸附量,发现使用混和功能单体获得的吸附容量最大,达到其吸附容量6.0 μmol/g;这可能是因为AM和4-VP都属于碱性功能单体,它们之间具有协同作用,不容易产生自身缔合,从而和槲皮素分子能够较好的形成复合物,并在MIPs中产生更多的、具有特异选择性的活性印迹位点。实验中发现当AM的比例较大时,经过固相萃取后模板分子槲皮素的回收率较低,归因于用AM作功能单体时对模板分子的保留弱;而当4-VP的比例较大时,经固相萃取后模板分子槲皮素的回收率相比AM来说也较低,这是因为用4-VP作功能单体对模板分子的保留太强、难于洗脱所导致的。因此,根据表4和表5的实验结果,合成MIPs时选择1:1比例下的AM和4-VP为1:1的混和功能单体。
2.2.2 功能单体(AM)浓度对槲皮素MIPs的影响
通过固定槲皮素的浓度(0.02 mg),改变AM的浓度 (从 a~h 分别为:0;0.005;0.01;0.02;0.04;0.05;0.1;0.25 mg)而测得槲皮素分子和功能单体AM预聚合后的紫外光谱图如图3所示。
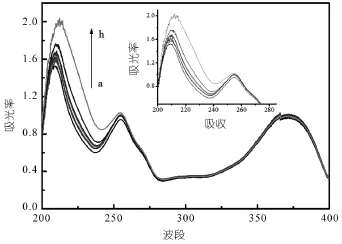
图3 不同AM浓度溶液的紫外吸收光谱图
由图可知:随着AM的浓度增大,预聚合后溶液的吸光度也逐渐增大,并且最大吸收波长发生红移,说明AM与槲皮素分子发生了作用。这可能是由于AM是碱性的功能单体,而槲皮素是多酚类的酸性化合物,含有较多的羟基,它们之间具有离子间作用;另外由于它们之间形成的氢键也使得相互之间发生作用,形成复合物。并且由于N原子上的富余电子对槲皮素芳香环的供电子基效应,使得AM最大吸收波长发生红移。
2.3 致孔剂的用量对吸附效果的影响
由图4对比不同体积得到MIPs的吸附量,发现当乙腈用量为40 mL时,吸附量可以达到较高的水平,因此在聚合反应过程中致孔剂乙腈的加入量为40 mL。其原因可能是随着致孔剂量的减少,反应体系(包括溶剂、单体和其他溶解组分)中的连续相对聚合物链的溶解度增强、聚合物临界链长增加,导致核聚集而成的聚合物粒子数目下降,因而聚合后粒子的粒径减小。
2.4 槲皮素MIPs和NIPs性能测试结果
2.4.1 槲皮素MIPs和NIPs的静态吸附实验及Freumdlich分析
在浓度范围为0.02~1.0 mmol /L的槲皮素甲醇溶液中,加入等量的MIPs和NIPs做吸附试验,根据吸附前后的浓度变化计算出单位质量聚合物的结合量,从而得出MIPs和NIPs对槲皮素的吸附等温线如图5所示。
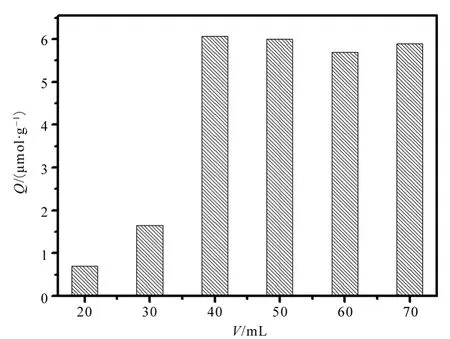
图4 不同溶剂体积合成聚合物的吸附容量
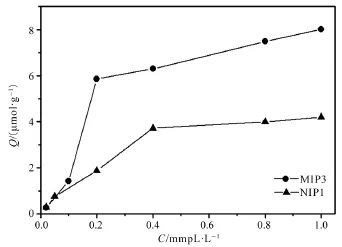
图5 槲皮素在MIPs 和 NIPs 上静态吸附等温曲线
由图5中的曲线可知,随着槲皮素浓度的增大,单位质量MIPs的吸附量也增大,而NIPs在槲皮素初始浓度大于0. 4 mmol /L 时的吸附量已趋于饱和,并且在相同初始浓度下单位质量MIPs 的吸附量远大于在单位质量 NIP s的吸附量,证明了这种沉淀聚合得到的MIPs对槲皮素具有很好的吸附效果效果。这说明在印迹过程中,模板分子在MIPs中选择性键合产生的印迹孔穴及孔穴上的活性结合位点,决定了MIPs对模板分子的高度亲合力和特异识别性远大于非选择性键合作用。
在分子印迹的研究中,常用Freumdlich模型来印迹聚合物的吸附能力强弱,评价分子印迹聚合物的结合特性,Freumdlich模型方程式lgQ= lgα+mlgC。
式中:Q—单位质量聚合吸附分析物的量,μmol/g;
C—分析物在溶液中平衡时的浓度,μmol/mL;
α和m是Freumdlich方程的两个常数[40]。其中m表示吸附能力的强弱,当m的值在0~1的范围内,说明吸附比较容易进行。
经Freumdlich模型拟合的结果如图9所示:MIPs对槲皮素的吸附方程为:lgQ= 0.943 23+0.829 92 lgC,R=0.9986;而NIPs对槲皮素的吸附方程为:lgQ= 0.731 19+0.675 89 lgC,R=0.98 87;由α值可知MIPs比NIPs具有更大的吸附容量,而由m值可以明显得出MIPs的同质的吸附位点的相比NIPs更多。这可能是由于功能单体和模板分子之间存在多种相互作用,使得制备的MIPs对模板分子的特异性吸附更强所导致的。
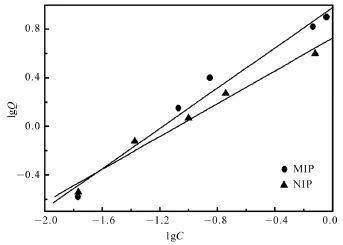
图6 槲皮素在MIPs和NIPs吸附的Freumdlich模型曲线
2.4.2 槲皮素MIPs和NIPs的吸附选择性实验结果
在底物浓度为2.0 mmol/L时,用槲皮素和芦丁混合标准液测定MIPs和NIPs的结合分离系数KD(见表6)。

表6 MIPs和NIPs对槲皮素和芦丁的分离系数KD和选择性识别因子α
由表6可知MIPs对槲皮素和芦丁分别为95.24 mL/g和26.63 mL/g,分离因子=3.53;而NIPs的KD分别为26.63 mL/g和24.43 mL/g,分离因子α=1.10。说明MIPs对槲皮素具有较好的选择性,其因为MIPs的模板分子为槲皮素,能够识别槲皮素并对其有选择性地保留,而对芦丁没有特别的选择性。
2.5 槲皮素MIPs在固相萃取中的应用结果
2.5.1 固相萃取条件优化
(1)淋洗条件的优化
当采用含槲皮素的甲醇溶液为上样溶液时,由于MIPs和NIPs都存在着非选择性吸附,所以为了消除非选择性吸附,选择合适的淋洗液尤为重要。本实验采用甲醇作淋洗剂,考察了不同体积甲醇淋洗剂对槲皮素类似物芦丁的除去效果,发现用较少体积的甲醇淋洗时,对芦丁的去除效果较差,这说明淋洗剂量少时,不足以破坏槲皮素及其类似物芦丁与聚合物间的疏水环境;而用较大体积的甲醇淋洗时,虽然对芦丁的去除效果较好,但是也会将大量的槲皮素分子除去,如图7所示;发现用2.0 mL甲醇淋洗时,既能使模板分子槲皮素的回收率保持在较高水平,又能把芦丁尽可能地去除。
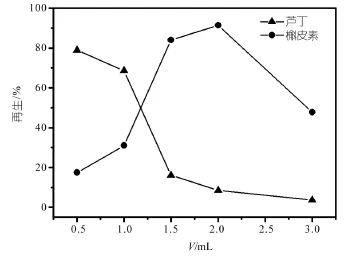
图7 淋洗剂体积对槲皮素芦丁回收率的影响
(2)洗脱条件的优化
使用甲醇乙酸的混合溶液作为洗脱剂,由图8可以看出,当乙酸的比例小于15%时,对槲皮素的回收率较低,这可能是因为乙酸比例较小时,洗脱剂还不足于克服槲皮素与聚合物特异性吸附作用力,而当乙酸的比例增加至20%时,发现槲皮素的回收率能达到较高的水平,说明此比例下的洗脱剂能够克服模板分子和吸附剂之间的特异性吸附作用,因而能使槲皮素有较高的回收率,而芦丁的回收率较低的原因是前面已用淋洗剂甲醇充分淋洗,去除了大部分因非特异性吸附而保留的芦丁。
综上所述:选用2.0 mL甲醇作淋洗剂,20%的乙酸甲醇溶液作洗脱剂,可使槲皮素的回收率保持在较高的水平,同时去除芦丁的效果也较好,使得MIPs的选择性尽可能高。
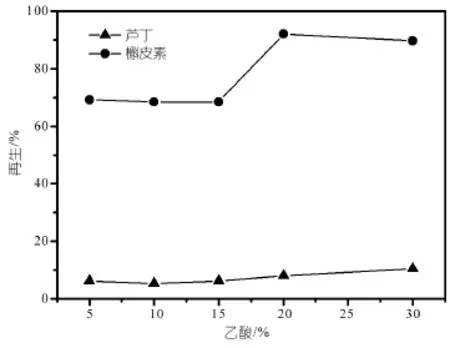
图8 乙酸比例对槲皮素芦丁回收率影响
2.5.2 槲皮素MIPs固相萃取柱的选择性实验结果
由槲皮素MIPs用作固相萃取吸附剂对槲皮素和芦丁的SPE色谱图,由图9可以发现:上样液和淋洗液中只有芦丁标准液的峰,没有出现槲皮素的峰,说明槲皮素被槲皮素MIPs吸附剂选择性地保留,洗脱液中只有槲皮素的峰没有出现芦丁的峰,说明芦丁在淋洗过程中已基本被淋洗完,槲皮素和芦丁被分离开来。说明槲皮素MIPs吸附剂的确对槲皮素分子具有较好的选择性和保留效果。
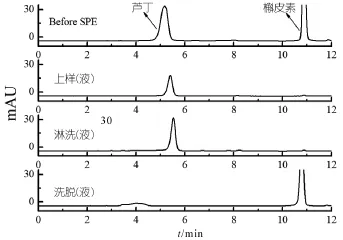
图9 槲皮素芦丁混合标准溶液SPE色谱图
2.6 槲皮素MIPs的再生识别能力结果
为了考察槲皮素MIPs的再生识别能力,使用槲皮素MIPs作为吸附剂制作的固相萃取柱重复固相萃取实验,并计算得出其回收率对比如图10所示。
作为分离材料的MIPs,具备良好的再生识别能力是非常重要的,实验对槲皮素MIPs的稳定性和潜在的再生识别能力作了考察,图10为槲皮素MIPs作为固相萃取吸附剂重复使用的结果。由图可知:重复使用10次后吸附容量虽然有所降低,但是仍然能保持在较高的水平,回收率达到50% 以上,这说明重复使用对MIPs的吸附能力没有非常明显的影响。再生后吸附量下降,这可能是因为:一方面重复使用过程中MIPs的部分吸附位点遭到了破坏;另一方面再生的过程中部分强保留的物质没有被完全洗脱下来,这两方面导致了吸附容量的下降。
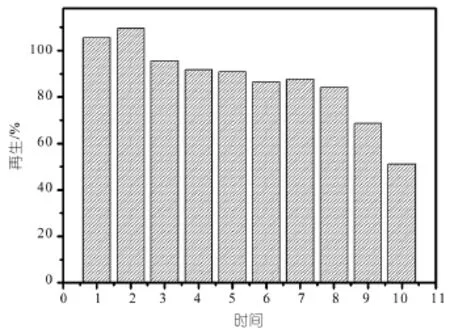
图10 槲皮素MIPs的再生识别性能
2.7 槲皮素MIPs在油茶壳实际样品中的应用结果
对实际油茶壳样品的固相萃取效果如图11所示,对比固相萃取前后的色谱图发现经过固相萃取后不仅能将杂质组分大量的除去。经过测定,用MIPs固相萃取处理后的油茶壳提取液中槲皮素的含量能达到83%,说明了槲皮素分子印迹固相萃取对实际油茶壳样品中槲皮素具有较好的选择性提取分离、纯化效果。
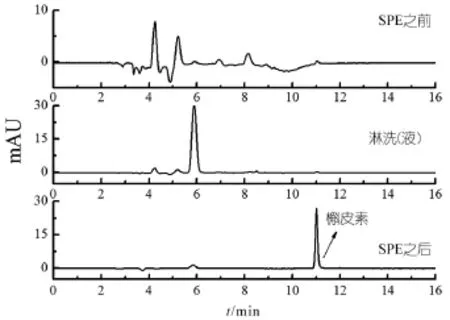
图11 实际油茶壳提取液样品SPE色谱图
3 结论
(1)通过对比沉淀聚合法与传统本体聚合法的最大吸附容量和分离因子,沉淀聚合的最大吸附容量达到6.93 μmol/g,分离因子α为4.33,均优于本体聚合。
(2)分别以AM,4-VP,AM和4-VP混合功能单体成功制备了槲皮素分子印迹聚合物,考察它们的形貌,发现,当致孔剂乙腈的体积为40 mL时能得到粒径均一、分散性好的MIPs。
(3)采用AM和4-V混和功能单体制备的MIPs作为固相萃取吸附剂,具有更好的选择性和更高的回收率。
(4)最终得到制备槲皮素MIP的最优方法为:以槲皮素为模板分子,40 mL乙腈为致孔剂、1:1AM/4-VP混合功能采用沉淀聚合法制备。
(5)对比MIPs和NIPs的静态吸附量和吸附选择性能,说明MIPs具有比NIPs更好的吸附能力和选择性。
(6)从多次重复实验结果中可以得出槲皮素MIPs具有良好的再生识别能力。
(7)使用槲皮素MIP作为固相萃取吸附剂材料在固相萃取实验中表现良好。
(8)对实际油茶壳样品中的槲皮素进行了分离纯化实验,证明了这种印迹聚合物用于选择性分离油茶壳提取液中的槲皮素具有较好的效果,为复杂天然产物中黄酮类物质的选择性富集及分析检测提供了一条新的途径。

