沉默hnRNP A2/B1抑制人宫颈癌Hela细胞中cyclin D1/E表达的研究*
廖铭心,刘 瑶,蔡 僮,方 文
(贵州医科大学医学检验学院临床生化教研室,贵阳 550004)
宫颈癌是目前威胁女性健康的常见恶性肿瘤之一,尤其对于发展中国家来说其发病率更是居高不下[1]。据中国癌症中心发布的数据显示我国宫颈癌的发病率和病死率分别为10.4/105和2.59/105[2]。在寻求改善传统治疗方案的同时探索在基因水平上新的肿瘤抑制方法受到人们越来越多的关注。核内不均一核糖核蛋白A2/B1(heterogeneous nuclear ribonucleoprotein A2/B1,hnRNP A2/B1) 是hnRNPs家族中的一员,与mRNA的剪接、转运及调控细胞生长和多种肿瘤的发生(如胃癌、非小细胞肺癌、胶质母细胞瘤等)有着密切的联系[3-6]。本课题组前期用洛铂作用于宫颈癌细胞后也发现hnRNP A2/B1表达下调并有细胞周期阻滞和抑制增殖的现象[7]。而细胞周期蛋白(cyclin)D1与cyclin E联合可促进细胞通过G1期的限制点,cyclin D1、cyclin E在调控细胞周期进程中起到重要作用[8],同时JOHN等[9]和BUTT等[10]总结发现cyclin D1和cyclin E 在多种肿瘤中表达都上调进而影响肿瘤的发展。本课题组前期已通过慢病毒介导沉默宫颈癌Hela细胞中的hnRNP A2/B1基因表达[11-12],本研究拟进一步探讨hnRNP A2/B1对细胞cyclin D1/E表达水平的影响并通过裸鼠移植瘤模型观察沉默hnRNP A2/B1基因后对肿瘤生长情况的影响,阐明hnRNP A2/B1对宫颈癌发展的重要作用。
1 材料与方法
1.1材料
1.1.1实验动物及主要试剂 4~6周BALB/c雌性裸鼠共18只,购自贵州医科大学实验动物中心。四甲基偶氮唑蓝(MTT)相关试剂RIPA裂解液、BCA试剂盒购自碧云天生物技术公司;SYBR Green PCR Master Mix购自美国Biosystems公司;Trizol、逆转录试剂盒购自天根生物科技有限公司;兔抗hnRNP A2/B1抗体购自美国Invitrogen公司,兔抗cyclin D1和兔抗cyclin E抗体购自英国Abcam公司,兔抗β-actin、抗增殖细胞核抗原(PCNA)及免抗Ki-67抗体购自博奥森生物公司,辣根过氧化物酶 (HRP) 标记的山羊抗兔二抗购自北京中山金桥生物技术有限公司;胎牛血清购自美国Gibco公司;RPMI-1640培养液购自美国Hyclone公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒购自万类生物公司;超敏ECL化学发光试剂盒和聚偏氟乙烯(PVDF)膜购自美国Millipore公司;其余试剂均为国产分析纯。
1.1.2主要仪器 Allegra高速台式低温离心机购自美国Beckman公司;Bio-rad680全波长酶标仪、Western blot垂直电泳槽购自美国Bio-rad公司;细胞培养箱购自日本三洋电机有限公司;Nikon-TE2000-U倒置相差显微镜购自日本Nikon公司。
1.2方 法
1.2.1慢病毒转染沉默hnRNP A2/B1 慢病毒介导shRNA转染沉默宫颈癌Hela细胞株步骤详见参考文献[11-12]。
1.2.2细胞培养 人宫颈癌Hela细胞株购自中国科学院细胞库。将未沉默细胞株和沉默后的细胞株共分3组:正常Hela细胞组、阴性沉默对照组 (Hela-NC 组)、阳性沉默实验组 (Hela-shRNA组)。各组细胞分别用含有10%的胎牛血清、1%青霉素-链霉素和1% L-谷氨酰胺的RPMI-1640培养液在37 ℃含5% CO2的细胞培养箱中培养,每2~3天换1次培养液。
1.2.3real-time PCR验证沉默效率 取上述3组处于对数生长期的细胞,用Trizol试剂盒提取总RNA并测定浓度,根据反转录试剂盒步骤将RNA反转录成cDNA,每个样品cDNA模板设立3个平行管。采用SYBR Green PCR Master Mix试剂盒进行qRT-PCR反应扩增目的片段。PCR引物如下:β-actin正向引物:5′-GTC TCC TCT GAC TTC AAC AGC G-3′,反向引物:5′-ACC ACC CTG TTG CTG TAG CCA A -3′; hnRNP A2/B1正向引物:5′-GAT GGC AGA GAA CGG TGT GAA G-3′, 反向引物:5′-AGG CAT AGG TAT TGG CAA CTG C-3′。PCR的反应条件为:95 ℃,10 min;95 ℃ 15 s,60 ℃ 1 min,40次循环。根据PCR的扩增曲线和溶解曲线分析产物的特异性,以β-actin为内参,最终结果以2-△△Ct统计各组基因表达水平。
1.2.4Western blot 于冰上用含有1%苯甲基磺酰氟(PMSF)的RIPA裂解液裂解各组细胞及移植瘤组织并在4 ℃离心机上以12 000 r/min离心20 min后收集上清蛋白液于-80 ℃保存备用。BCA法测定蛋白浓度,SDS-PAGE凝胶电泳分离目的蛋白并用湿转法将蛋白转至PVDF膜,5%脱脂奶粉封闭液孵育2 h。然后4 ℃过夜孵育兔抗β-actin (1∶6 000)、兔抗cyclin D1 (1∶500)、兔抗cyclin E(1∶500)、兔抗hnRNPA2/B1(1∶500)一抗,之后用TBST洗3次,每次10 min,将PVDF膜在山羊抗兔二抗(1∶90 000)中室温孵育1 h。ECL发光液显影并曝光。用Image J软件分析各组的灰度值。
1.2.5MTT检测细胞增殖 用0.25% 的胰蛋白酶将Hela组、Hela-NC组及Hela-shRNA组的细胞消化下来并稀释至5×104/mL,以每孔200 μL加入96孔板中并在37 ℃、5% CO2培养箱中分别培养12、24、48 h。然后每孔加入含10 μL MTT后继续培养4 h,之后去除上清液并每孔加入150 μL的二甲基亚砜(DMSO)于酶标仪上充分震荡10 min后在490 nm处检测吸光度(A)值。
1.2.6构建裸鼠移植瘤模型 于贵州医科大学实验动物中心购入18只4周龄的雌性BALB/c裸鼠并用清洁级饲料饲养于无特定病原体(SPF)级动物房中。实验对应细胞分3组,每组6只裸鼠。每只裸鼠于右背靠颈部皮下接种200 μL悬浮细胞液 (2×106/mL细胞悬浮于200 μL PBS中)。之后每3天用游标卡尺测量肿瘤体积大小并根据文献中发表的公式计算体积[13]。肿瘤生长30 d后用10%水合氯醛麻醉并断颈处死裸鼠收集肿瘤组织。
1.2.7免疫组织化学 移植瘤组织取出后用4%的中性甲醛固定24 h,之后脱水、石蜡包埋并制成4 μm厚的切片粘贴于载玻片上。之后二甲苯化蜡,梯度乙醇脱蜡至水,柠檬酸盐缓冲液高压修复抗原3 min。0.3% H2O2阻断非特异性抗原30 min,PBST洗3次后用10%的血清封闭液封闭20 min。4 ℃过夜孵育兔抗PCNA (1∶100)和兔抗Ki-67(1∶100)一抗,并以PBS代替一抗处理切片作为阴性对照。一抗孵育完毕并复温40 min后在37 ℃水浴箱中孵育二抗20 min,之后DAB显色,苏木素复染并逆行脱水后用中性树脂封片。棕色区域视为阳性区域,Image-Pro Plus6.0软件分析各组组织中棕色区域的IOD值。
1.2.8苏木素-伊红(HE)染色 前期组织处理与免疫组织化学步骤类似。4 μm厚的切片经脱蜡和再水合后用苏木素处理5 min,1%盐酸乙醇分化1 s,伊红染液处理3 min,逆行脱水后用中性树脂封片。

2 结 果
2.1各组宫颈癌Hela细胞中hnRNP A2/B1基因表达情况比较 由慢病毒介导shRNA沉默hnRNP A2/B1基因的Hela-shRNA组与Hela组和Hela-NC组比较,hnRNA A2/B1表达降低(P<0.05)。qRT-PCR结果显示Hela-shRNA组中的hnRNP A2/B1抑制效率达到(74.79±3.38)%,Western blot结果显示Hela-shRNA组中hnRNP A2/B1蛋白的表达量相较于其他两组明显降低(P<0.05),见图1。
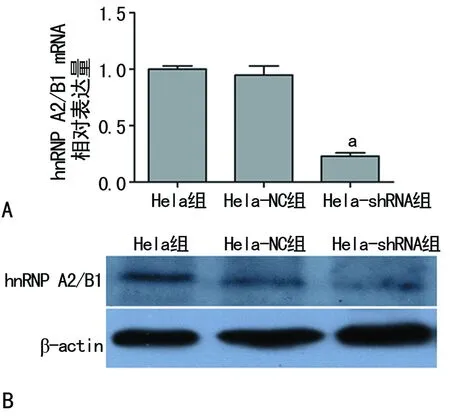
A:hnRNP A2/B1 mRNA;B:hnRNP A2/B1蛋白;a:P<0.05,与Hela组及Hela-NC组比较
图1慢病毒介导shRNA沉默hnRNP A2/B1基因
2.2沉默hnRNP A2/B1对宫颈癌Hela细胞增殖的影响 对Hela组、Hela-NC组及Hela-shRNA组分别检测各自在12、24、48 h时间点的增殖情况。Hela-shRNA组在48 h时间点的增殖情况较Hela组及Hela-NC组明显降低 (P<0.05),见图2。

a:P<0.05,与Hela组及Hela-NC组比较
图2沉默hnRNP A2/B1后各组的增殖水平比较
2.3沉默hnRNP A2/B1后对体外细胞cyclin D1及cyclinE表达的影响 Western blot结果显示Hela-shRNA组的cyclin D1及cyclin E蛋白水平相较于Hela组及Hela-NC组明显降低(P<0.05),Hela组与Hela-NC组比较差异无统计学意义(P>0.05),见图3。
2.4沉默hnRNP A2/B1后对宫颈癌Hela细胞移植瘤的影响 对于接种Hela、Hela-NC及Hela-shRNA的3组裸鼠,在实验期间各组行为都未见异常表现,饮食正常,各组存活率为100%。Hela-shRNA组的肿瘤生长相较于另外两组明显受到抑制,肿瘤体积明显减小 (P<0.05),见图4。免疫组织化学结果显示Hela-shRNA组中的增殖相关抗原PCNA及Ki-67表达较其余两组均明显降低(P<0.05),见图5、6,HE染色见各组切片中肿瘤细胞的病理形态呈现出细胞核深染,大小不一,核质比例失调,部分细胞形态不规则的现象,但各组之间的形态并无明显差异,见图6。另外移植瘤组织中的Western blot结果同样显示Hela-shRNA组的cyclin D1及cyclin E较其他两组明显降低(P<0.05),见图7。

A:Western blot;B:定量分析图;a:P<0.05,与Hela组及Hela-NC组比较
图3体外细胞中各组cyclin D1及cyclin E蛋白表达变化

a:P<0.05,与Hela组及Hela-NC组比较
图4裸鼠移植瘤的生长情况
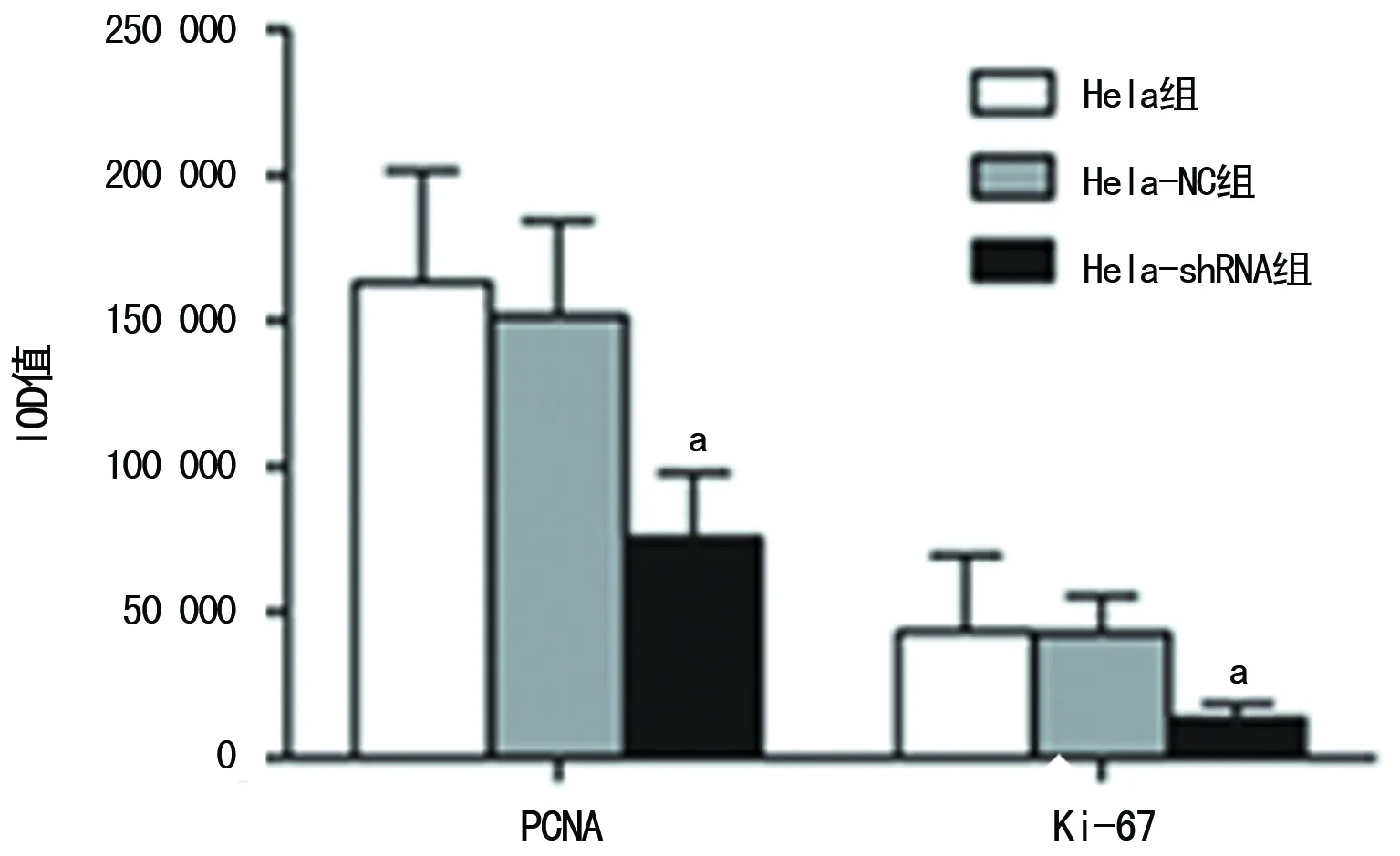
a:P<0.05,与Hela组及Hela-NC组比较
图5免疫组织化学定量分析
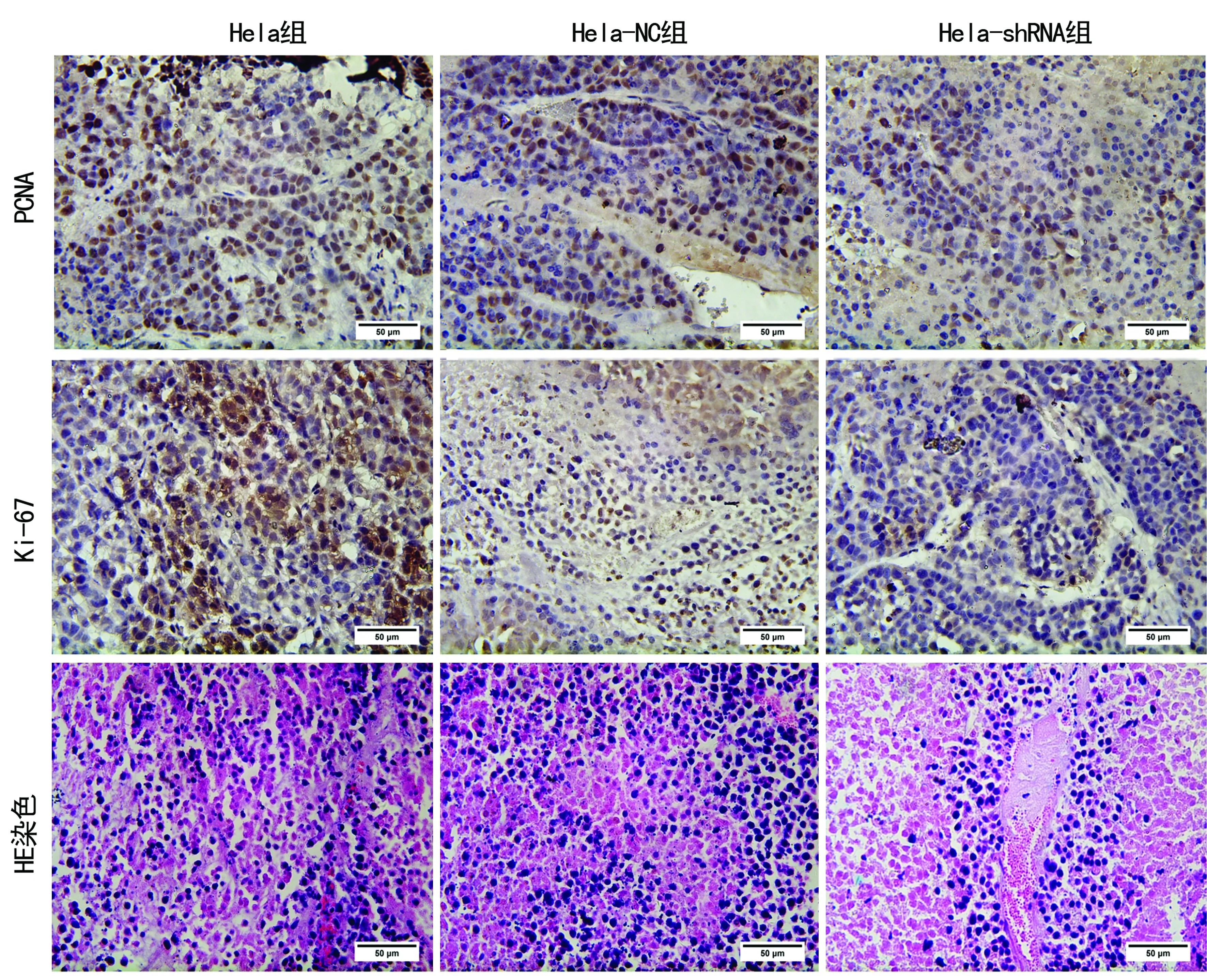
图6免疫组织化学及HE染色(×400)
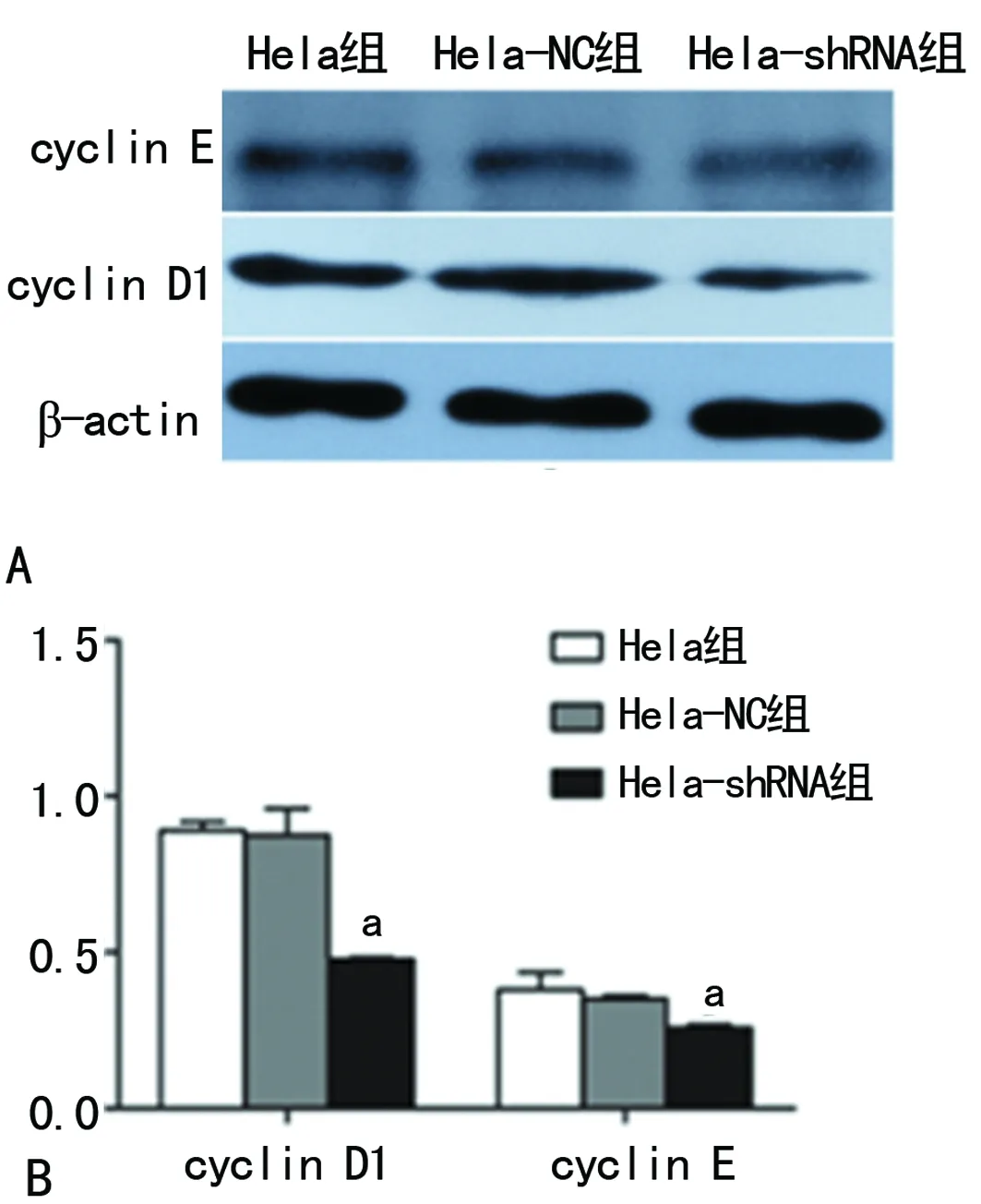
A:Western blot;B:定量分析图;a:P<0.05,与Hela组和Hela-NC组比较
图7移植瘤组织中cyclin D1及cyclin E蛋白表达变化
3 讨 论
由于宫颈癌在女性肿瘤的高发病率及恶性程度,目前许多学者都致力于寻找与宫颈癌相关的癌基因。据文献报道,目前宫颈癌的发生发展与诸多基因都有关联,而hnRNP A2/B1基因与宫颈癌的联系鲜有报道,因此本研究希望在前期研究的基础上进一步探索hnRNP A2/B1对调控宫颈癌细胞中周期相关蛋白的表达及其对细胞增殖和肿瘤生长的影响。
hnRNP A2/B1是一组由hnRNP A2和hnRNP B1蛋白质以适当比例结合涉及细胞转录和蛋白质翻译的mRNA结合蛋白[3-4]。hnRNP A2/B1不受调控地在肿瘤组织中的高表达是促进肿瘤形成的原因之一[6],甚至有研究报道将hnRNP A2/B1定义为一种原癌基因,尤其是在非小细胞肺癌中,hnRNP A2/B1已作为其肿瘤生物标记物及判断预后的指标[14]。LI等[15]研究发现hnRNP A2/B1及其他部分hnRNPs家族的基因参与介导人乳头瘤病毒16型(HPV-16)感染宫颈上皮的过程,同时也发现hnRNP A2/B1在宫颈癌中也是呈高表达状态。本研究结果显示沉默宫颈癌细胞中hnRNP A2/B1后其增殖及肿瘤生长等方面明显受到抑制,这也印证了部分学者的结论,说明hnRNP A2/B1确实参与了宫颈癌的发生发展过程。
从体内及体外实验结果均显示cyclin D1及cyclin E在hnRNP A2/B1基因沉默后均表达下调,而这两种蛋白对于调控细胞周期进程至关重要[8],这说明hnRNP A2/B1有可能通过cyclin D1及cyclin E来调控宫颈癌中的细胞周期变化。赵向寨等[16]发现通过沉默hnRNPs家族中的 hnRNP H基因能够下调子宫内膜癌Ishikawa细胞中的cyclin D1、CDK4的表达。而据CHOI等[17]报道,hnRNP A2/B1在维持人胚胎干细胞的自我更新及多功能性上具有重要意义,并通过沉默hnRNP A2/B1后也发现胚胎干细胞中的cyclin D1及cyclin E及cyclin B1表达下调,细胞周期阻滞于G1期。同时也有报道称在肺腺癌中检测到hnRNP B1升高而cyclin D1减少,协同二者的结果对肺腺癌及不典型增生的诊断具有重要意义[18]。而上述结论与本研究结论相一致,由此可以推断cyclin D1及cyclin E在hnRNP A2/B1调控宫颈癌细胞周期进程中十分重要。细胞核增殖相关抗原Ki-67及PCNA均为存在于细胞增殖期的蛋白质,是增殖细胞标记物之一,常被用于许多肿瘤与非肿瘤组织通过免疫组织化学分析病理特性的标记物[19],对于这两种蛋白质的检测有助于了解肿瘤细胞的增殖活性。本研究免疫组织化学结果显示沉默hnRNP A2/B1后PCNA和Ki-67的表达均显著减低,同时结合体外MTT细胞增殖实验,说明hnRNP A2/B1能够调控宫颈癌细胞的增殖活性。
综上所述,本次通过沉默hnRNP A2/B1基因后对宫颈癌细胞体外及体内实验的研究。结果显示,hnRNP A2/B1在宫颈癌细胞中可能参与调控细胞增殖,并通过cyclin D1及cyclin E调控细胞周期进程,同时促进宫颈癌的生长。所以hnRNP A2/B1可能是治疗宫颈癌的一个基因靶点,这将为未来对治疗宫颈癌进一步研究提供一个实验依据。

