吴茱萸碱抑制NOD1通路诱导肝癌HepG2和SMMC-7721细胞凋亡
郭星娴,李晓朋,吕晓婷,陈 益,周 鹏,吕艳伟,李 静,陈地龙,2
(1. 重庆医科大学基础医学院组织细胞工程与干细胞研究室,组织学与胚胎学教研室,重庆 400016;2. 三峡医药高等专科学校,重庆 400016)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的高发恶性肿瘤之一,其死亡率在消化系统恶性肿瘤中位于第3位,其发病率及死亡率居高不下。HCC具有起病隐匿、进展快、易转移、预后差、易复发等特点[1]。因此,探索如何有效治疗HCC依然是现今的研究热点之一。作为天然产物的中药具有毒副作用小、不易产生耐药性、减轻患者的痛苦等优势[2],因此,使用中药治疗肝癌受到了越来越多的重视。吴茱萸碱是吴茱萸的主要有效成分之一,药理学研究表明,吴茱萸碱的药理作用广泛,其在抗肿瘤、抗炎、调节免疫等方面的作用十分重要[3]。有研究显示,吴茱萸碱通过抑制核转录因子κB(nuclear factor κB ,NF-κB) p65的激活,发挥强大的抗炎和抗肿瘤效应[4]。
先天免疫系统由一些能够识别微生物、病毒或异常受损的宿主细胞的受体家族组成。研究显示,肿瘤的发生、发展与机体的免疫功能密不可分。近年发现,一种名为核苷酸寡聚域样受体(nucleotide-binding oligomerization domain-like receptors, NLRs)家族的蛋白与先天免疫反应有关[5],并且其中的核苷酸结合寡聚化结构域蛋白1(nucleotide-binding oligomerization domain 1,NOD1)对肿瘤的发生、发展存在一定的影响[6-7]。有研究报道,NOD1可通过诱导NF-κB p65磷酸化,介导炎症反应和肿瘤的发生、发展[8]。因此,我们猜测吴茱萸碱抑制肝癌细胞中NF-κB p65的激活可能与NOD1相关,但目前尚未见文献报道。
1 材料
1.1细胞株正常肝细胞株HL-7702和人肝癌细胞株SMMC-7721、HepG2,均购自中国典型培养物保藏中心(武汉)。
1.2药物与试剂吴茱萸碱(纯度98%)购自赛洛克生物科技公司;PCR试剂购自GeneCopoeia; BCA蛋白浓度测定试剂盒(增强型)、RIPA裂解液(强)、PMSF(100 nmol·L-1)、CCK-8试剂盒、Hoechst 33258染液,均购自碧云天生物技术有限公司;NOD1抗体购自Novus Biologicals;p65、p-p65抗体,均购自CST;Bcl-2、Bax、p53抗体,购自沈阳万类科技有限公司。
1.3仪器凝胶成像仪、电泳仪、电转仪、荧光定量PCR仪(美国Bio-Rad公司);高速台式离心机(长沙平凡仪器仪表有限公司);倒置显微镜、倒置荧光显微镜(日本Nikon公司)。
2 方法
2.1细胞培养正常肝细胞HL-7702培养于含10%胎牛血清和1%青霉素-链霉素溶液的RPMI 1640培养液中,肝癌细胞HepG2、SMMC-7721均培养于含10%胎牛血清和1%青霉素-链霉素溶液的DMEM-F12培养液中。将所有细胞放置于37 ℃、5% CO2孵箱中培养,每24~48 h传代1次。
2.2CCK-8法检测细胞增殖取对数生长期的HepG2、SMMC-7721细胞,以1×109·L-1接种于96孔板,每孔200 μL。此实验设计分3组,每组5个复孔。空白对照组: 未接种细胞,仅加入DMEM-F12完全培养基;Control组:已接种细胞并常规培养;吴茱萸碱组:细胞中加入含终浓度0.25、0.5、1、2、4 μmol·L-1吴茱萸碱的DMEM-F12完全培养基。分别培养12、24、48 h后,每孔加入10 μL CCK-8工作液,37 ℃孵育2 h。在450 nm处测定其光吸收值(A)。计算12、24、48 h各组细胞生长抑制率,实验重复3次。抑制率=(AControl组-A吴茱萸碱组)/(AControl组-A空白对照组)×100%。同时计算其半数抑制浓度(half inhibitory concentration,IC50),并确定药物作用最适浓度和时间,实验重复3次。
2.3Hoechst33258染色实验取对数生长期的HepG2、SMMC-7721细胞,以1×107·L-1接种于已放置好盖玻片的6孔板,每孔3 mL。该实验分为2组,Control组:已接种细胞并常规培养;吴茱萸碱组:给予含终浓度0.5、1 μmol·L-1吴茱萸碱的DMEM-F12完全培养基。于37 ℃、5% CO2孵箱中培养24 h后,取出,弃培养液,加入固定液固定10 min,弃固定液,清洗后加入染液,在常温下避光染色5 min,去染色液,PBS洗涤,将贴附有细胞的盖玻片取出,放于滴有抗荧光淬灭剂的载玻片上,在荧光显微镜下观察,并且采集图片,实验重复3次。
2.4实时定量PCR反应(qRT-PCR) 收集正常肝细胞HL-7702、肝癌细胞HepG2、SMMC-7721,加入TRIzol震荡后,加入1 ∶1氯仿去除蛋白,加入2 ∶1异丙醇去除沉淀,提取总RNA,在260 nm和280 nm处检测浓度,并用DEPC水配平,将提取的RNA逆转录为cDNA。使用GeneCopoeia试剂,依据说明书进行操作,检测正常肝细胞与肝癌细胞中NOD1的表达水平。体系为95 ℃反应10 min,45个循环的95 ℃反应10 s,60 ℃反应20 s,72 ℃延伸15 s,设置2个复孔,以β-actin为内参进行PCR检测,实验重复3次。NOD1引物序列:正向5′-ACTGAAAAGCAATCGGGAACTT-3′,反向5′-CACACACAATCTCCGCATCTT-3′。
2.5Westernblot检测实验分组同“2.3”,培养24 h后,分别用全蛋白裂解液抽提试剂盒提取全蛋白。采用BCA蛋白浓度测定试剂盒检测各组蛋白浓度,每个样品取20 μg蛋白上样,SDS-PAGE分离蛋白,电转移至PVDF膜上;用5%脱脂奶粉封闭,4 ℃孵育一抗Bcl-2、Bax、p53、NOD1、p65、p-p65(1 ∶1 000)过夜。洗膜3次,37 ℃孵育二抗(1 ∶10 000)1 h,洗膜3次后,用ECL法检测蛋白的表达。

3 结果
3.1吴茱萸碱对HepG2、SMMC-7721细胞增殖的影响Fig 1的CCK-8检测结果显示,吴茱萸碱(0.25、0.5、1、2、4 μmol·L-1)作用于HepG2和SMMC-7721细胞12、24、48 h后,HepG2和SMMC-7721细胞的增殖均受到明显抑制,与Control组相比,差异有统计学意义(P<0.05),且吴茱萸碱对HepG2及SMMC-7721细胞的生长抑制作用呈剂量和时间依赖性。计算12 h的IC50分别为1.8、2 μmol·L-1,24 h的IC50分别为1.1、1.3 μmol·L-1,48 h的IC50分别为0.7、0.9 μmol·L-1。故选用给予1 μmol·L-1吴茱萸碱诱导24 h进行后续实验。

Fig 1 Inhibitiory effect of evodiamine on SMMC-7721(A) and HepG2(B) cells by CCK-8 assay n=3)
3.2吴茱萸碱对HepG2、SMMC-7721细胞凋亡的影响Fig 2的Hoechst 33258染色结果显示,Control组发出均匀、淡蓝色荧光;而吴茱萸碱诱导后的各组均出现核染色质浓缩聚集、核碎裂、核边集及发出蓝白色荧光等典型的细胞凋亡形态学特征,且1 μmol·L-1吴茱萸碱组的凋亡细胞比0.5 μmol·L-1吴茱萸碱组更多。

Fig 2 Evodiamine induced SMMC-7721 and HepG2 cells for 24 h by Hoechst 33258 staining (×200)
3.3吴茱萸碱对HepG2、SMMC-7721细胞中凋亡相关蛋白表达的影响Fig 3的Western blot结果显示,与Control组比较,吴茱萸碱组HepG2、SMMC-7721细胞中促凋亡蛋白Bax、p53表达明显增加,而抗凋亡蛋白Bcl-2表达明显减少,差异有统计学意义(P<0.05)。
3.4NOD1在正常肝细胞HL-7702及肝癌细胞HepG2、SMMC-7721中的表达Fig 4的qRT-PCR及Western blot结果显示,与正常肝细胞相比,HepG2及SMMC-7721细胞中的NOD1表达水平明显升高,提示NOD1的高表达可能是肝癌发生、发展的诱因之一。
3.5吴茱萸碱对HepG2、SMMC-7721细胞中NOD1通路相关蛋白表达的影响Western blot检测NOD1信号通路中的主要成员NOD1、p65、p-p65的变化,Fig 5结果显示,与Control组比较,吴茱萸碱组HepG2及SMMC-7721细胞的NOD1、p-p65蛋白水平明显降低,而p65表达水平不变。
4 讨论
肝癌是我国最常见的恶性肿瘤之一,并且在全球的发病率呈明显上升趋势,其发展迅速,不易发现,并且预后较差。

Fig 3 Protein expression in SMMC-7721 and HepG2 cells after evodiamine treatment for 24 h n=3)
*P<0.05vscontrol
肝癌患者的免疫力普遍较为低下,使用常规化疗药物也有可能损伤患者的免疫功能,并且治疗成本较高。因此,寻找价格低廉,且能够在抗癌的同时提高患者免疫力的药物迫在眉睫。
吴茱萸碱为吴茱萸干燥近成熟果实中的主要有效成分之一,其抗肿瘤作用是近年来的研究热点。国内外大量研究证明,吴茱萸碱可以降低炎症因子的表达,发挥强大的免疫调节功能,并且具有较强的抑制肿瘤细胞增殖、阻滞细胞周期、诱导细胞死亡和抗血管生成、抑制浸润转移作用,从而能够抑制肿瘤生长、转移[9]。目前,在临床上已有采用吴茱萸碱治疗肝癌、结肠癌等恶性肿瘤的报道[10-11],但对其抗癌的机制研究尚未完全清楚。
本研究采用CCK-8法检测吴茱萸碱对肝癌细胞HepG2和SMMC-7721的增殖抑制作用。结果显示,0.25~1 μmol·L-1的药物在12、24、48 h均可明显抑制上述两种细胞的增殖,并呈时间和剂量依赖性。采用Hoechst染色检测吴茱萸碱对肝癌细胞凋亡的影响,结果显示,采用0.5、1 μmol·L-1吴茱萸碱诱导24 h后,肝癌细胞出现了核染色质浓集,并发出亮蓝色荧光等典型的细胞凋亡指征,且凋亡形态的变化程度与药物浓度呈正相关。
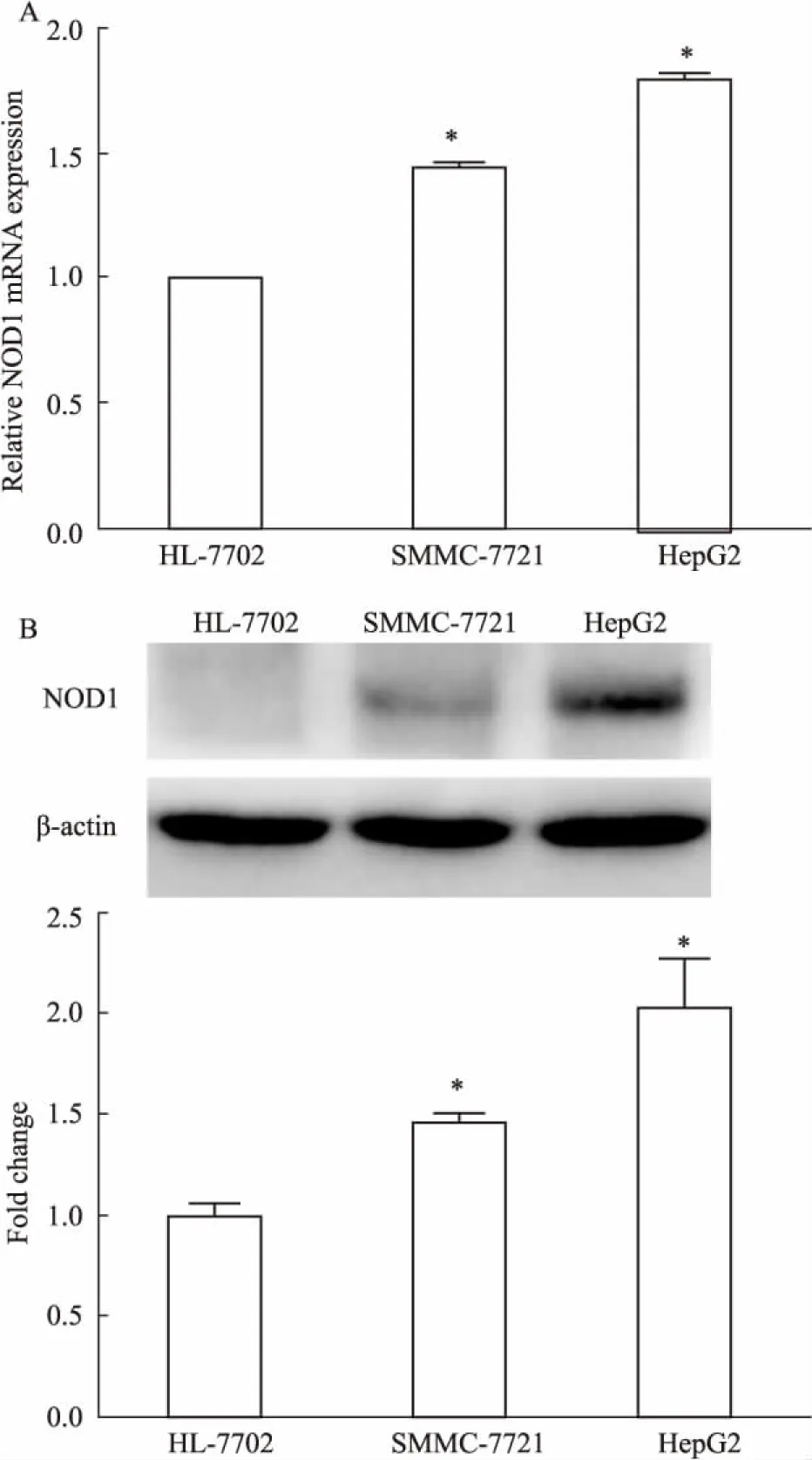
Fig 4 Analysis of NOD1 mRNA (A) and protein(B) expression in normal hepatic cell lines and
*P<0.05vsHL-7702
p53蛋白是一种抑癌基因,负性调节细胞生长,与调控细胞周期、DNA修复、细胞凋亡等重要的生物学功能有关,其过表达与肿瘤的发生、发展、转移、复发及不良预后相关。Bcl-2蛋白是一种重要的抗凋亡基因,其能够阻止细胞色素C从线粒体释放到细胞质,从而抑制了细胞凋亡。Bax蛋白是人体中关键的凋亡基因,是Bcl-2基因家族的成员之一,其过表达可拮抗Bcl-2的作用,使细胞发生凋亡。本实验采用0.5、1 μmol·L-1吴茱萸碱作用于肝癌细胞后,与Control组相比,吴茱萸碱组肝癌细胞的凋亡相关蛋白Bax、p53表达水平增高,而抗凋亡相关蛋白Bcl-2表达水平降低,且呈浓度依赖性。研究证实,吴茱萸碱可促进肝癌细胞的凋亡,但其机制尚未完全清楚。
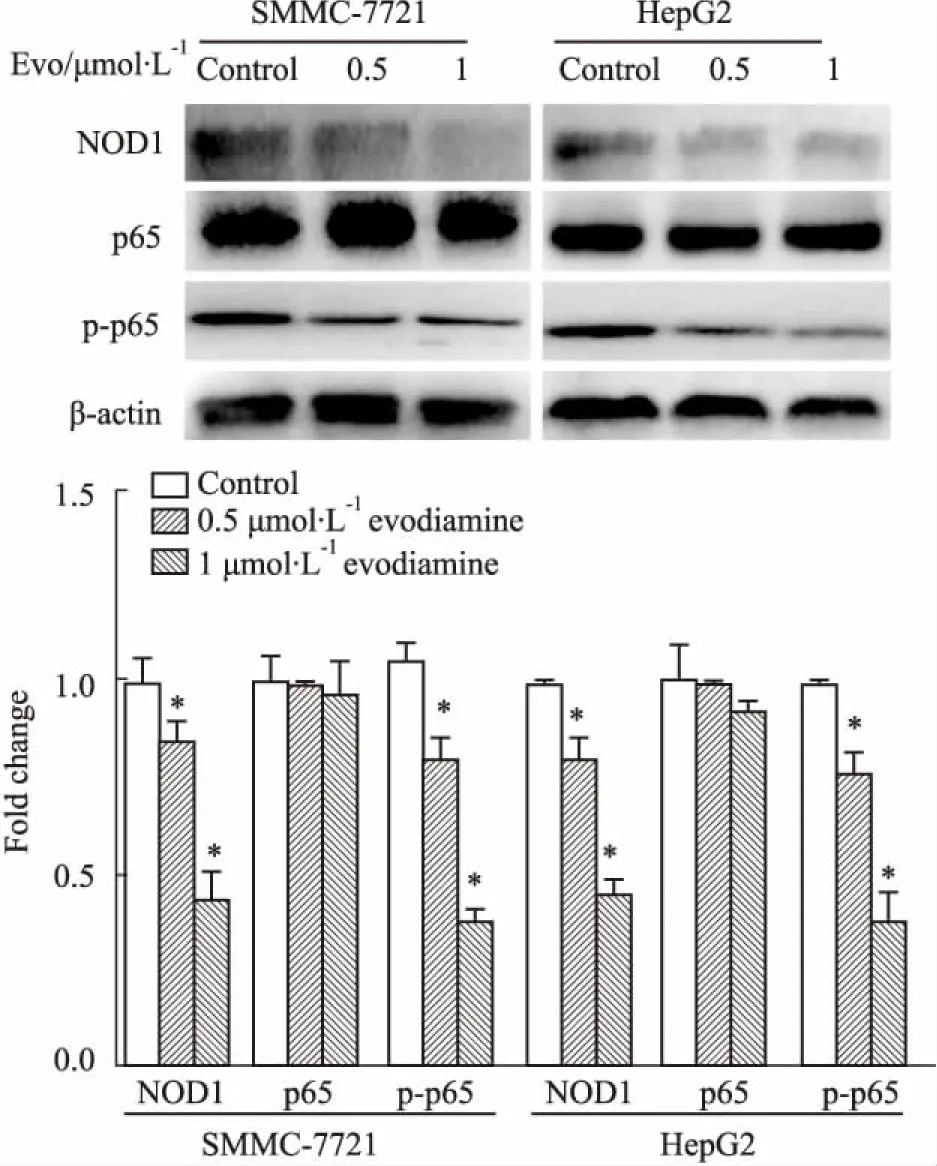
Fig 5 Protein expression in SMMC-7721 and HepG2 cells after evodiamine treatment for 24 h n=3)
*P<0.05vscontrol
NOD1蛋白是参与人体天然免疫的胞质蛋白家族中的一员,是一种模式识别受体,在遗传上高度保守,其与一些炎症反应的发生及细胞凋亡关系密切。近年有研究发现,NOD1敲除小鼠显示出对炎症诱导的结肠肿瘤发生的敏感性增加[12]。也有研究表明,与非肿瘤组织相比,胃癌组织中NOD1受体水平明显较高[13]。后期有研究发现,MCF-7细胞中,NOD1的缺失与肿瘤生长相关[14]。研究表明,NOD1在多种肿瘤细胞中呈高表达,但在肝癌细胞中NOD1的表达水平如何,尚未见文献报道。因此,我们采用qRT-PCR及Western blot检测了正常肝细胞HL-7702、肝癌细胞HepG2及SMMC-7721中的NOD1表达水平,发现与正常肝细胞相比较,HepG2及SMMC-7721细胞中的NOD1表达水平均明显较高,揭示了NOD1的高表达可能是肝癌发生、发展的诱因之一。随后,我们用0.5、1 μmol·L-1吴茱萸碱作用于肝癌细胞后,Western blot检测发现,与Control组相比,NOD1的蛋白表达明显降低。那么,吴茱萸碱是如何通过NOD1来调控肝癌细胞凋亡的呢?
NF-κB蛋白家族主要参与机体自身的免疫反应、机体损伤和应激、细胞分化和凋亡以及肿瘤生长过程的信息传递,p65蛋白是其中的一员,其被磷酸化后进入细胞核,启动其调控作用。许多凋亡相关蛋白如p53等,都是NF-κB蛋白的靶基因产物,p53信号通路为肿瘤发生过程中诱导凋亡的重要信号通路,Bax和Bcl-2又是p53信号通路相关的重要分子,p53可通过影响Bcl-2、Bax等蛋白的表达,实现对细胞凋亡过程的调控作用[15]。因此,我们猜测吴茱萸碱可能通过下调NOD1的表达,影响NF-κB p65磷酸化,影响凋亡相关蛋白的表达来发挥其诱导肝癌细胞凋亡的作用。本实验采用0.5、1 μmol·L-1吴茱萸碱作用于肝癌细胞后,Western blot检测发现,与Control组相比,p65蛋白表达未变,但p-p65蛋白水平下降,且呈浓度依赖性。研究证实,吴茱萸碱通过下调NOD1,抑制NF-κB的激活,激活p53信号通路,改变Bcl-2/Bax的比值,诱导肝癌HepG2和SMMC-7721细胞的凋亡。
综上所述,吴茱萸碱对肝癌细胞HepG2和SMMC-7721有明显抗肿瘤活性,其作用机制可能与抑制NOD1通路的激活相关,因而吴茱萸碱可作为一种潜在的NOD1抑制剂,为今后开发具有抗癌作用的同时,能够提高患者免疫力,且价格低廉的药物提供了一定的参考价值。
(致谢:本研究在重庆医科大学基础医学院组织工程与干细胞研究室完成,特此感谢研究过程中给予帮助的老师及同学!)
——以吴茱萸为例