两株lager啤酒酵母在传代及自溶过程中生理性能差异的比较
丁华建,段鸿绪,王金晶,李崎,李永仙,郑飞云,刘春凤,钮成拓
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
啤酒酵母作为啤酒酿造的重要原料之一,是影响啤酒品质的主要因素,对啤酒质量起决定性的作用[1-2]。在工业化啤酒酿造过程中,为降低经济成本,酵母细胞会被多次重复使用,这种操作过程被称为传代(serial re-pitching)[1, 3]。在传代过程中,酵母细胞在发酵结束时被收集并用于新一代的接种,而酵母细胞用于连续发酵的次数,叫做“代数”。啤酒酿造工业中,活跃的、年轻的和生理稳定的酵母细胞是生产高质量啤酒必不可少的,一些啤酒厂也尽量避免出现传代次数过多的问题[4]。
啤酒酵母根据发酵结束后酵母细胞在发酵液中活动的状态可分为两类,分别为上面啤酒酵母和下面啤酒酵母。上面啤酒酵母(Saccharomycescerevisiae)又称艾尔酵母(ale yeast),多用于生产艾尔型啤酒,而下面啤酒酵母又称拉格酵母(lager yeast),用于发酵拉格型啤酒。目前世界上大多数工业啤酒生产中使用拉格酵母进行发酵,通常所说的啤酒酵母也大多指拉格酵母。早期对lager酵母的研究认为其是由不同酵母菌株包括S.cerevisiae,S.bayanus,S.bayanusvar.uvarum杂交而来[5-6]。 2008年Dunn和Sherlock对17株lager酵母进行基因组分析证明了其杂交本质,并指出lager酵母的S.cerevisiae部分的亲本很可能是艾尔酵母[7]。而真贝酵母(S.eubayanus)菌株的发现进一步确定了lager酵母是由艾尔酵母S.cerevisiae与S.eubayanus杂交而产生的杂交体[8]。在基因组学研究的基础上,将拉格酵母分为了2组,分别为第1组Saaz/Carlsberg型酵母(S.carlsbergensis)和第2组Forhberg型酵母(S.pastorianus)[9]。研究发现,Forhberg型酵母能够利用麦芽三糖而Saaz型酵母不能利用[9]。虽然拉格酵母与酿酒酵母所表现出来的亲缘性很高,但两者在物质代谢尤其是风味物质代谢调控上却有很大的差别,而且与啤酒风味代谢相关的基因基本上都来自于其“非酿酒酵母”(non-cerevisiae)部分的亲本[10]。真贝酵母低温耐受性非常好,因此,来自于真贝酵母的这部分基因赋予了啤酒酵母在低温条件下良好的发酵能力。
在啤酒传代发酵过程中,酵母细胞需要应对环境中的各种压力,包括渗透压力、氧化压力、乙醇压力等(图1),当酵母细胞感受到压力或者对细胞来说产生一种毒性刺激而无法抵御时,细胞将启动自溶程序[11]。 不同于葡萄酒酵母的自溶会给葡萄酒带来面包、黄油等愉悦的香气[12-13],啤酒酵母自溶过程中大量的胞内物质泄漏到发酵液中,对啤酒的风味和品质造成不利的影响[1-2, 14-15]。通过选育耐压力胁迫的啤酒酵母能够一定程度上提高酵母的抗自溶能力[16],然而并不是非常理想。目前国内外少有针对啤酒酵母在传代过程中的生理变化进行研究,因此深入理解酵母在自溶胁迫过程中的生理变化,不仅有助于了解啤酒酵母传代过程中的抗自溶胁迫机制,还可以为选育优良啤酒酵母提供指导意义。

图1 发酵过程中酵母受到的各种压力变化[17]Fig.1 Various stresses encountered by the yeast during brewing process
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
啤酒酵母Pilsner和5-2均为拉格酵母菌株,主要用于拉格型啤酒的酿造,由本实验室保藏。酵母提取物和胰蛋白胨均购自北京OXOID公司;2′,7′-Dichlorodihydrofluorescein diacetate(DCFH-DA),购于Sigma-Aldrich公司;BacTiter-GloTMMicrobial Cell Viability Assay试剂盒,购于Promega公司;细胞凋亡检测试剂盒(红色荧光),购于Beyotime公司;其他试剂均为国产分析纯,购自上海国药集团化学试剂有限公司。
1.1.2 培养基和溶液
YPD培养基:20 g/L蛋白胨,10 g/L酵母抽提物,20 g/L葡萄糖。
柠檬酸盐缓冲液:10.51 g/L柠檬酸,14.71 g/L三水柠檬酸钠,用1 mol/L柠檬酸溶液调节pH至4.0。
亚甲基蓝染色液:美蓝0.3 g,95%乙醇30 mL,0.1 g/L KOH 100 mL,使用时稀释10倍。
磷酸盐缓冲液(PBS):8 g/L NaCl,0.2 g/L KCl,1.44 g/L Na2HPO4,0.74 g/L KH2PO4,用HCl调节溶液pH值在7.2~7.4。
1.2 实验方法
1.2.1 酵母细胞的传代发酵
从保藏的菌株斜面上取1环菌接入 10 mL YPD试管中,于 28 ℃下活化36 h,按1%的接菌量加入到70 mL的三角瓶中于 25 ℃培养48 h,最后按照酵母细胞浓度 2×107CFU/mL接入2 L带发酵栓的锥形瓶中,进行发酵。拉格型酵母Pilsner和5-2于11 ℃下发酵6 d。等发酵结束后,收取新鲜的酵母泥,按照相同的接种量进行传代发酵,直至第5代。
1.2.2 酵母细胞形态学观察
收集每代发酵结束后的新鲜酵母细胞,用5%戊二醛(0.1 mol/L磷酸缓冲液,pH=7.2)前固定,0.1 mol/L磷酸缓冲液漂洗1%锇酸(0.1 mol/L 磷酸缓冲液,pH=7.2)后固定,0.1 mol/L磷酸缓冲液漂洗,乙醇梯度脱水,临界点干燥后将样品粘贴在样品台上,离子溅射仪镀膜后置于扫描电子显微镜下观察其细胞形态[18],而超薄切片经醋酸双氧铀和柠檬酸铅染色后置于透射电子显微镜下观察。
1.2.3 细胞死亡率和活性检测
定时对自溶液取样,适当稀释后与等量亚甲基蓝染液混匀,染色5 min后用血球计数板镜检计数。细胞呈蓝色的为死细胞,无色的为活细胞,记录细胞总数和死细胞数(细胞活性=活细胞数/细胞总数×100%)。
1.2.4 抗自溶指数的检测
参考许维娜等[11]研究方案,将2 g主发酵结束后的酵母泥加到200 mL柠檬酸盐缓冲液(模拟自溶液)中,28 ℃静置培养72 h,每12 h取样检测各指标。取1 mL样品在3 000×g离心5 min,沉淀酵母细胞用于检测死亡率,上清液用于测定在260 nm和280 nm处的吸光度。根据2个吸光值与酵母死亡率的比值判定酵母的抗自溶性能。
1.2.5 基于ATP检测细胞活力
参考BactTiter-GloTMMicrobial Cell Vitality Assay试剂盒说明书,进行细胞ATP的检测。细胞悬浮在100 mmol/L的磷酸盐缓冲液(pH=7.0,0.1%葡萄糖和1 mmol/L EDTA)中,并使细胞浓度控制在106CFU/mL左右,取100 μL进行检测。这个化学发光的光信号在5 min后就可用TECAN Infinite®200 多功能酶标仪进行检测,而且发光信号跟ATP的含量成正比。
1.2.6 细胞内ROS检测
参考ANNA LEWINSKA实验方法[19],将细胞悬浮在pH=7.0的磷酸盐缓冲液中,并使细胞浓度控制在107CFU/mL左右。取1 mL样品,加入 5 μL DCFH-DA于37 ℃避光反应30 min,然后用多功能酶标仪检测荧光强度(测试条件:λex=488 nm和λem=525 nm)。
1.2.7 DNA的相对损伤分析
利用TdT介导dUTP缺口末端标记法(TUNEL)染色来检测DNA 的损伤[20-21]。具体的操作是参考细胞凋亡检测试剂盒(红色荧光)说明书,用4%多聚甲醛固定1 h,溶壁酶在37 ℃处理40 min,最后加TUNEL反应混合物在37 ℃黑暗中培养1 h,结果通过荧光显微镜来计数,至少有200个细胞计数,以确定DNA损伤。
2 结果与分析
2.1 细胞形态学分析
2.1.1 细胞表面形态分析
对0代、3代及5代的酵母细胞进行微观形态观察,扫描电镜结果如图2所示,放大倍数为3 000倍。发现酵母细胞在0代多呈椭圆形,表面圆润饱满,有明显的出芽现象和芽痕,但是在经过连续的传代发酵后,酵母细胞的表面就逐渐出现褶皱变化,甚至由于胞内物质的流失导致细胞干瘪失形,但是细胞表面依旧无明显破损。这说明在连续传代发酵过程中酵母细胞壁的破坏是局部的、小规模的,也反映了细胞壁在抗压方面所起到的重要作用。同时,相对于菌株5-2,可以清晰地看出菌株Pilsner在传代过程中,细胞形态变化较大,受损较严重,同时细胞表面也出现了干瘪失型,这也说明了在传代发酵过程中,菌株5-2抗压能力优于菌株Pilsner。
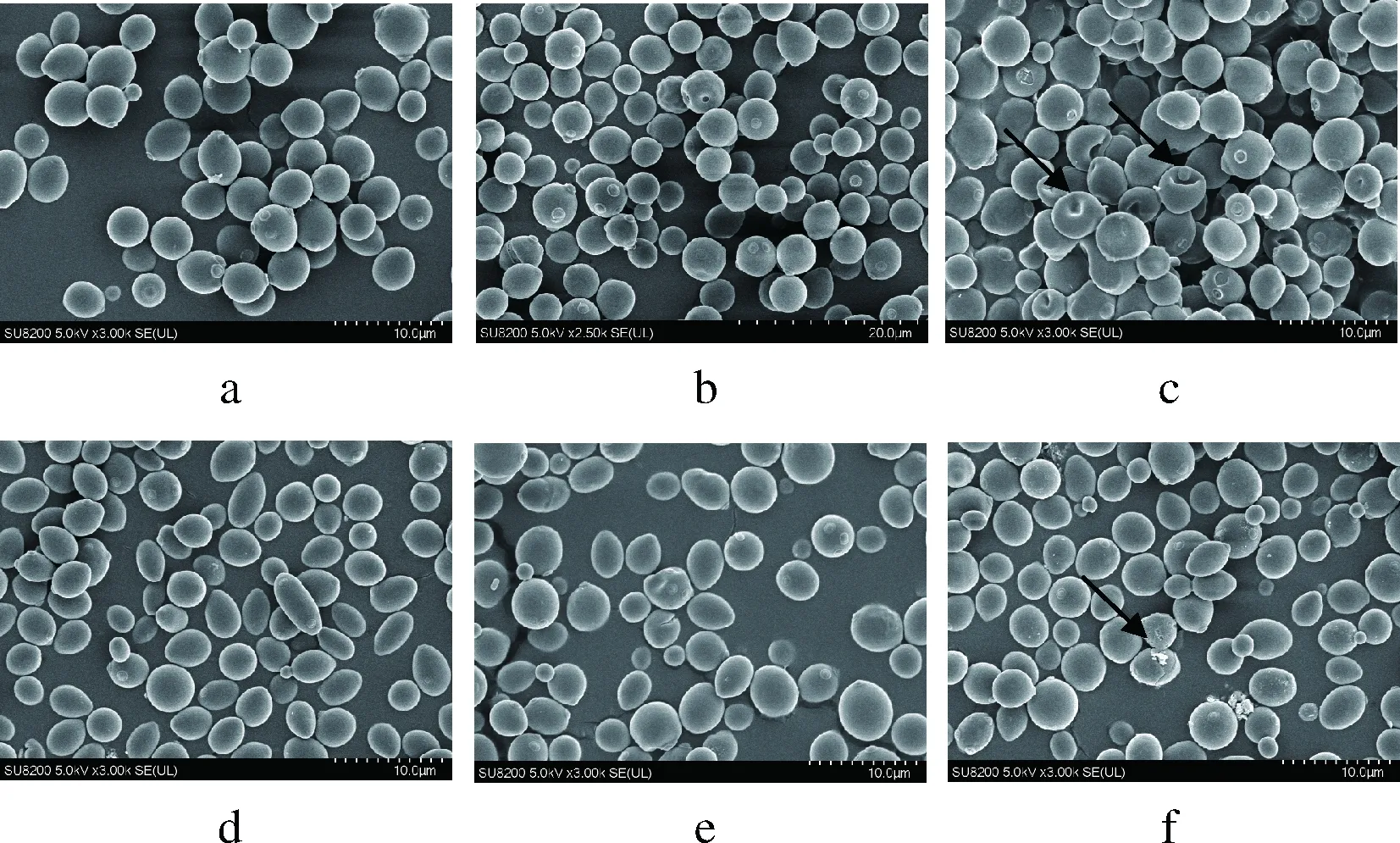
图2 不同代数啤酒酵母的扫描电镜(SEM)结果Fig.2 SEM analysis of lager yeasts from different generationsa.b.c分别为Pilsner菌株的0、3、5代的SEM结果;d.e.f 分别为5-2菌株的0、3、5代的SEM结果,放大倍数3 000倍
2.1.2 细胞壁厚度分析
通过酵母细胞的切片透射电镜图可以清晰地观察酵母细胞的内部结构形态,也可以清楚的观察到酵母细胞壁的状况,利用标尺可以测定不同代数的酵母细胞壁厚度。图3为Pilsner和5-2菌株0、3、5代细胞的切片透射电镜图,放大倍数为 15 000 倍。每株菌选取 50个未发生芽殖的细胞,测定不同位置细胞壁厚度,进行平均后得到的酵母壁细胞壁厚度如表1所示。
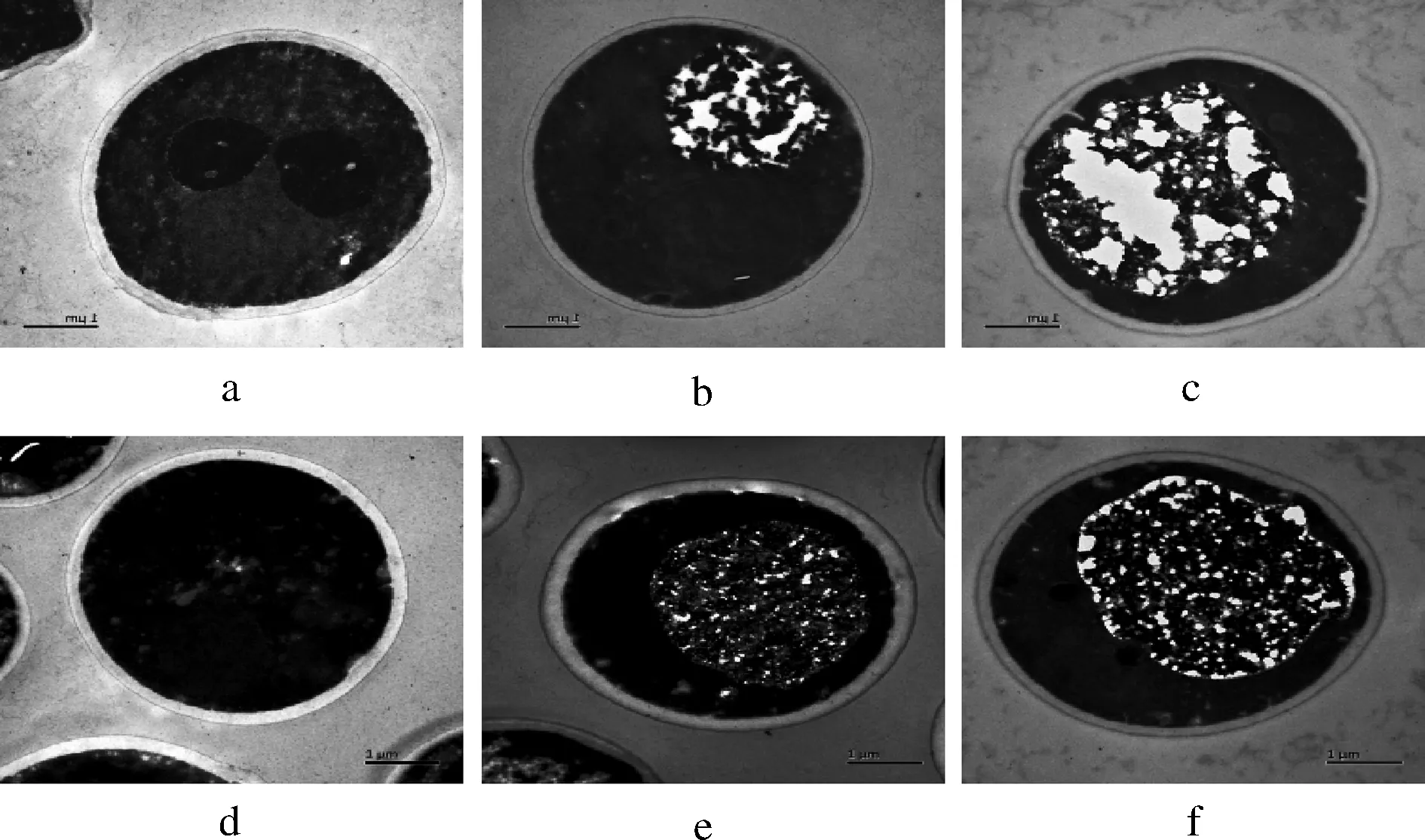
图3 不同代数啤酒酵母的切片投射电镜(TEM)结果Fig.3 TEM analysis of lager yeasts from different generationsa.b.c分别为Pilsner菌株的0、3、5代的TEM结果;d.e.f 分别为5-2菌株的0、3、5代的TEM结果,放大倍数15 000倍
表1 不同代数啤酒酵母的细胞壁厚度

单位:nm
根据图3所示,可以很明显看到在经过连续传代发酵后,细胞内的脂质、蛋白质等物质会被逐渐水解,这也解释了为什么细胞的表面形态会在连续传代后出现褶皱变化,甚至干瘪失形。相对于菌株5-2,Pilsner细胞的内部结构水解程度更大,因此才导致其细胞形态变化相对更大。如表1所示,发现2个菌株的细胞壁厚度都在逐渐下降,只是不同菌株的下降趋势不同,其中菌株Pilsner在经过5代发酵后,由开始的233 nm下降到173 nm,厚度减少了25.8%,菌株5-2由开始的212 nm下降到186 nm,厚度只减少了12.3%。酵母细胞壁是一个动态的且被调控地非常有序的细胞结构,其在保护细胞应对压力上发挥着重要作用[22-23]。所以细胞壁厚度相对薄的Pilsner菌株在经过多次传代后,细胞形态变化较大,胞内受损严重,表现出的抗压能力较5-2弱。
2.2 酵母模拟自溶分析
收集每一代发酵结束的酵母泥进行模拟自溶分析,结果如图4所示。
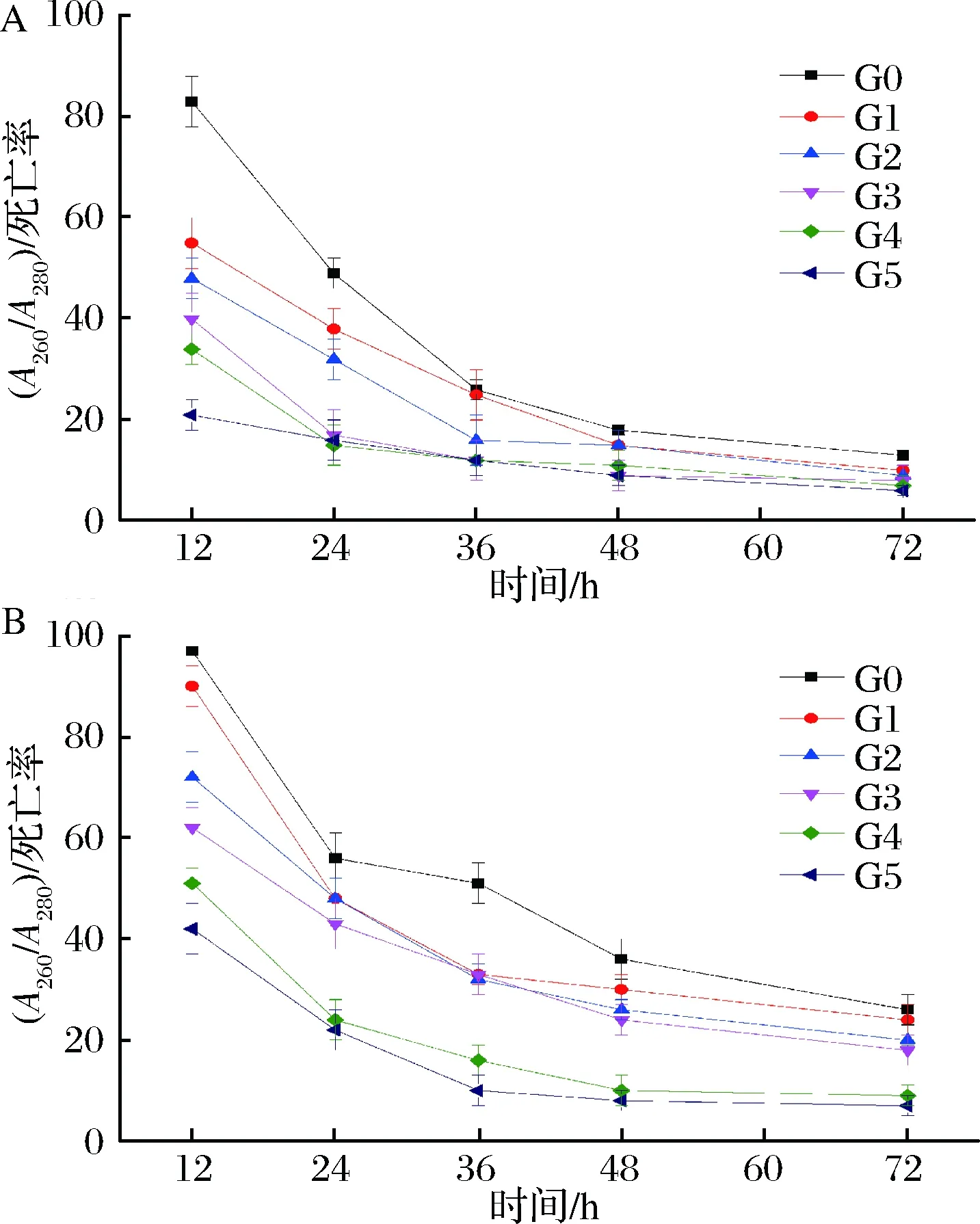
a-啤酒酵母Pilsner;b-啤酒酵母5-2图4 不同代数啤酒酵母模拟自溶液中(A260/A280)/死亡率随时间的变化情况Fig.4 Changes of (A260/A280) /mortality rate of lager yeastsfrom different generations in citrate buffer
随着传代次数以及自溶时间的增加,菌株的抗自溶指数均发生逐渐下降的趋势,不同菌株下降趋势不同。在模拟自溶条件下,Pilsner和5-2的抗自溶指数分别由0代的83和97,下降到3代的40和62,分别下降了51.8%和36.1%,到第5代时,Pilsner和5-2的抗自溶指数已经达到21和42,下降了47.5%和32.3%,Pilsner菌株的抗自溶指数下降趋势远大于5-2菌株。另外,随着自溶时间的延长,不同代数的菌株细胞也是随着其代数的增加,抗自溶指数下降趋势变化越加缓慢。由于菌株在传代过程中会逐渐衰老,越加难以抵抗一些恶劣的环境影响,因此可能导致其细胞的自溶[14, 24]。抗自溶指数的下降意味着抗自溶能力的下降,从图中可以很明显地发现5-2菌株的抗自溶能力强于Pilsner菌株,所以5-2相对来说能更好地抵御环境的影响。
2.3 传代发酵及自溶过程中细胞活性及活力研究
2.3.1 细胞活性及活力分析
2.3.1.1 细胞活性分析
检测分析2个菌株在传代以及自溶过程中的细胞活性,结果如图5所示,Pilsner和5-2的细胞活性在传代发酵过程中缓慢下降,经过5代发酵后细胞活性从98.9%下降到95.8%和96%,分别下降了3.1%和2.9%。然而,在自溶过程中细胞活性则下降迅速,下降幅度分别达到37.9%和65.9%。在饥饿状态下细胞活性的下降主要是靠细胞自身的抗逆性来维持,所以通过分析上述数据可以明显地发现,5-2菌株细胞抗逆性强于Pilsner。另外,结合细胞抗自溶研究的结果,发现细胞活性高的菌株,其抗自溶能力也较强。因此在啤酒发酵过程中测定酵母细胞的活性对工业化生产具有重要的指导意义[25]。

a-啤酒酵母Pilsner;b-啤酒酵母5-2图5 传代发酵及自溶过程中啤酒酵母细胞活性变化情况Fig.5 Changes of cell viability of lager yeasts from differentgenerations in the process of fermentation and autolysis
2.3.1.2 基于ATP含量的细胞活力分析
细胞活力与细胞内ATP含量密切相关[26],因此了解ATP含量变化对细胞活力有着重要作用。通过荧光素-荧光素酶反应检测ATP,其发光信号强度与细胞内ATP含量成比例,由于它的灵敏度和执行速度,使其成为一个应用广泛的检测细胞活力的方法,ATP检测结果用相对光单位(RLU)来表示。如图6所示,ATP含量在传代过程以及自溶条件下都出现急剧下降趋势。在传代过程中,Pilsner和5-2的胞内ATP含量由开始的5 400 RLU和7 600 RLU到3代时下降为2 000 RLU和3 300 RLU,分别下降了63.0%和56.6%,到了第5代,其ATP含量已经下降到1 200 RLU和2 300 RLU,与第3代相比又下降了40.0%和30.3%。显然Pilsner的胞内ATP含量下降趋势远大于5-2,而且初始的ATP水平又远低于菌株5-2,说明其细胞活力弱于5-2。此外,在自溶条件下,发现2株菌株的ATP含量下降趋势都是在0~24 h内迅速下滑,24 h后下降趋势有所缓和,这跟细胞的抗自溶指标变化趋势类似,说明细胞活力与细胞抗自溶能力也有一定的相关性。另外,从细胞活性来看,Pilsner和5-2在传代的过程中,从0代到5代其菌株的细胞活性下降不足5%,但是这2个菌株的胞内ATP水平却急剧下降到约70%。这表明细胞活性不足以评价啤酒酵母在酿造过程中的生理能力,所以就需要结合两者来评估细胞的生理状态,来反映细胞的活力。
a-啤酒酵母Pilsner;b-啤酒酵母5-2图6 传代发酵及自溶过程中啤酒酵母细胞ATP含量变化情况Fig.6 Changes of ATP levels of lager yeasts from differentgenerations in the process of fermentation and autolysis
2.3.2 胞内ROS积累评价
ROS的检测结果用相对荧光单位(relative fluorescent unit, RFU)表示,所以确保相同细胞数量很关键。对2株菌株传代以及自溶过程中胞内ROS积累进行检测,结果如图7所示。
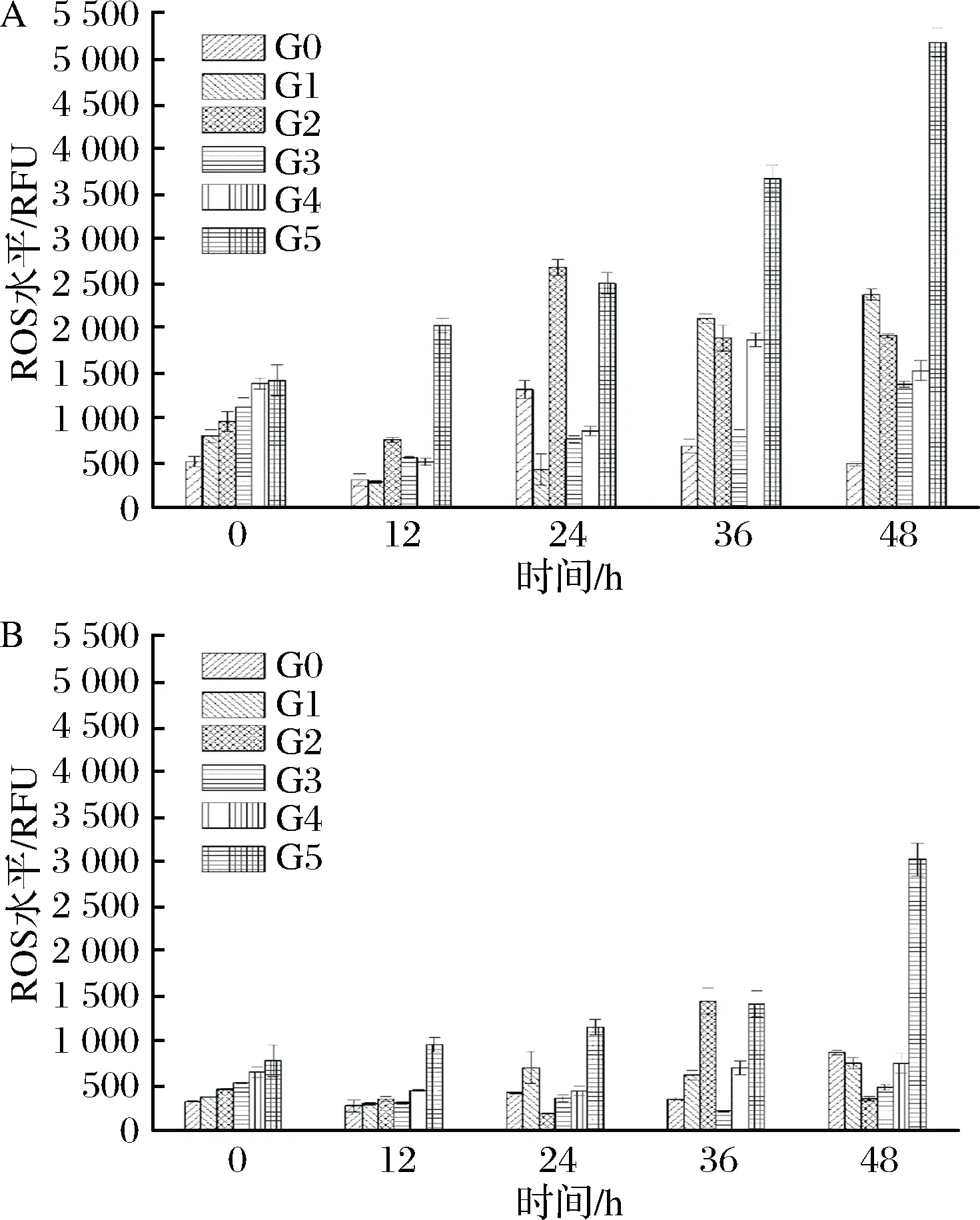
a-啤酒酵母Pilsner;b-啤酒酵母5-2图7 传代发酵及自溶过程中啤酒酵母细胞内ROS变化情况Fig.7 Changes of ROS levels of lager yeasts from differentgenerations in the process of fermentation and autolysis
发现2株菌株胞内ROS的含量在传代过程中都出现逐渐积累现象。从0代发酵结束至5代发酵结束,Pilsner和5-2的胞内ROS含量分别从520 RFU和320 RFU,积累到1 400 RFU和740 RFU,分别上升了169%和131%。高活力活性的菌株,其产生的ROS含量相对少,且稳定。而本文的结果跟前人的研究结果[27]类似,都出现ROS积累现象。近年来研究表明,酵母细胞的复制老化伴随着活性氧在母细胞中的积累。此外,也有研究表明,线粒体已被确定为ROS产生的主要来源[28-29]。所以线粒体ROS的增加进一步导致了整个细胞内的ROS的积累。然而,在自溶条件下,菌株都出现了先下降后上升的波动。有研究表明,为了防止细胞氧化损伤,酵母细胞会启动氧化应激反应,包括酶和非酶防御机制来消除ROS[30]。这就很好的证明了为什么在自溶条件下,ROS会出现下降的趋势。而在恶劣条件下,细胞就会出现氧化应激现象,这导致了ROS生成和消除之间的不平衡,最终积累了更多的ROS。另外,Pilsner菌株产生的ROS远高于菌株5-2,而过多的ROS则会严重影响细胞的生理功能,所以这也间接表明,5-2细胞活力比Pilsner更强。
2.3.3 细胞DNA损伤评价
DNA断裂时,暴露的3’-OH可以在末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase, TdT)的催化下加荧光探针标记的dUTP,从而可以通过荧光显微镜或流式细胞仪进行检测,这就是TUNEL(TdT-mediated dUTP nick-end labeling)法在单细胞水平上检测DNA损伤的方法原理[31]。TUNEL法已被广泛用来评估酵母在复制衰老和时序衰老过程中DNA的损伤[27, 32]。在连续传代的过程中和自溶条件下的DNA损伤情况,结果如图8所示。
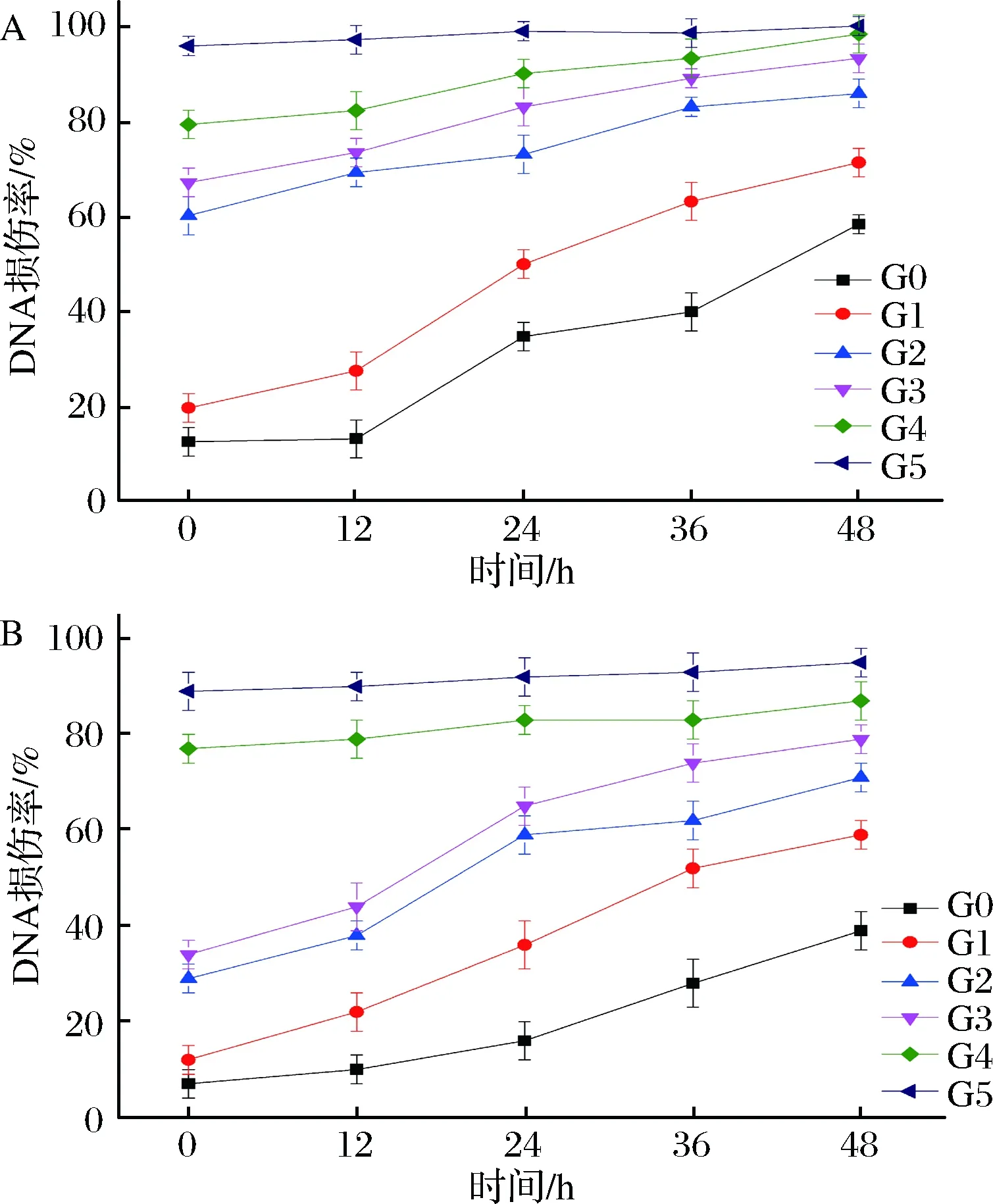
a-啤酒酵母Pilsner;b-啤酒酵母5-2图8 传代发酵及自溶过程中啤酒酵母细胞DNA损伤变化情况Fig.8 Changes of DNA damage of lager yeasts fromdifferent generations in the process of fermentationand autolysis
细胞的DNA损伤情况在传代和自溶过程中都越来越严重,而且很明显的看到,Pilsner菌株的DNA损伤率在第2代就出现迅速上升,整体都高于5-2,而且DNA的损伤趋势与ATP下降趋势表现几乎一致,说明酵母细胞ATP变化与DNA损伤有直接关系。另外,在前面的研究中,发现酵母在发酵过程中,尤其是自溶过程中,会伴随着ROS大量积累,而ROS的积累又进一步增加DNA的损伤,因此造成DNA的迅速损伤,如图9所示。

a.b.c分别为菌株Pilsner的0、3、5代的DNA损伤荧光结果,d.e.f 分别为菌株5-2的0、3、5代的DNA损伤荧光结果,其中红色细胞表示DNA受损伤的细胞图9 不同代数啤酒酵母细胞DNA损伤荧光图Fig.9 DNA damage fluorescence of lager yeasts fromdifferent generations
3 结论
在工业化啤酒酿造过程中,为降低经济成本,酵母细胞会被多次传代重复使用,然而在传代过程中,啤酒酵母需要重复应对环境中的氧化压力、渗透压力等各种压力,这些压力会引起酵母质量的下降。当酵母细胞无法抵御所受压力时,细胞开始自我降解,从而引起酵母的自溶衰亡,而酵母自溶又会给啤酒的风味、品质带来极其不利的影响。
本研究从生理学角度深度分析了啤酒酵母在传代过程中细胞形态、自溶性能、细胞活性活力等指标,结果发现:(1)在传代培养过程中,原本表面圆润饱满的酵母细胞会在活力下降后出现褶皱,甚至因为细胞内部结构的严重水解而干瘪失型。同时,细胞壁厚度在传代过程中也会逐渐变薄;(2)在模拟自溶液中,菌株的抗自溶能力随着传代次数的增加而逐渐减弱,其中菌株Pilsner自溶程度和死亡率明显高于5-2;(3)在传代发酵及自溶过程中,2个菌株的细胞活性均呈缓慢下降趋势,而两者的细胞活力则呈现迅速下降趋势。在细胞活性下降5%时,Pilsner和5-2的胞内的ATP水平已经急剧下降达到70%,因此需要结合两者来评估细胞的生理状态,来反映细胞的活力;(4)高活力的菌株其所表现的抗自溶能力、抗压能力都很强,而且高活力的菌株所产生的ROS含量相对少,且稳定,基本维持在300~1 000 RFU,DNA损伤速度也会相对缓慢。另外,胞内ROS的积累也会增加DNA的损伤。研究啤酒酵母在传代及自溶过程中的生理性能变化,不仅对现有生产菌株的优劣和传代能力进行评价,对选育优良啤酒酵母也具有重要指导意义。

