微米阵列结构聚合物薄膜的制备及其对细胞三维培养的影响
江卫民,张伟康,李东栋,宋晔
微米阵列结构聚合物薄膜的制备及其对细胞三维培养的影响
江卫民1,张伟康2,3,李东栋2,宋晔3
1 南京大学医学院附属口腔医院 南京市口腔医院,江苏 南京 210008 2 中国科学院上海高等研究院,上海 201210 3 南京理工大学 软化学与功能材料教育部重点实验室,江苏 南京 210094

江卫民, 张伟康, 李东栋, 等. 微米阵列结构聚合物薄膜的制备及其对细胞三维培养的影响.生物工程学报, 2018, 34(11): 1850–1859.Jiang WM, Zhang WK, Li DD, et al. Preparation of microarray-structured polymer film and its effect on 3D cell culture. Chin J Biotech, 2018, 34(11): 1850–1859.
二维 (Two-dimensional,2D) 细胞实验模型是目前研究人类疾病的细胞过程和药物筛选的主流方法。然而,生物细胞的生长受到众多因素的影响,传统的2D细胞培养在精确再现三维组织内细胞的功能方面存在一些障碍。与2D细胞培养相比,三维 (Three-dimensional,3D) 细胞培养体系注重细胞间的接触及细胞-基质间的接触,更接近于生物体的生长环境,更适合于药物筛选、细胞培植等研究。文中通过纳米压印技术制备了不同结构微米阵列聚合物薄膜,并将其应用于293T细胞的培养,通过调节薄膜表面结构、表面接触角成功实现了对生物细胞生长形貌的调控。利用扫描电镜等方法,对比了聚合物薄膜不同微结构、不同表面润湿性对细胞生长形貌的影响,重点关注细胞团的形态变化。结果表明,细胞在亲水性10 μm柱形阵列薄膜上呈现三维生长状态,这种薄膜可能更适用于制备生物细胞3D培养基;疏水性3 μm柱形阵列薄膜适用于体积小、表皮硬的组织细胞的3D培养,对于体积较大的细胞效果差。另外,对于疏水性较强的薄膜,细胞倾向于球状生长,而亲水性较强的薄膜则易贴壁生长。研究结果为微结构薄膜在生物细胞3D培养方面的应用作了初步探索。
纳米压印,超疏水,超亲水,细胞培养
在生物医药行业中,众多的药物通过临床研究后并不能达到预期的疗效和安全性要求,所以药物的研发是一个耗时、成本高、成功率低的工作[1-2]。二维 (Two-dimensional,2D) 细胞实验模型为药物的研发提供了一个有效的发现模型,已经成为研究人类疾病的细胞过程和药物筛选的主流方法[3-4]。
然而,生物细胞的生长受到众多因素的影响,如可溶性因子、细胞外基质、相邻细胞等[5],传统的2D细胞培养环境与生物体中细胞的实际生长环境有较大差异,对于许多人类疾病2D细胞培养基不能有效模拟[6],并在精确再现三维组织内细胞的功能方面存在一些障碍[7-9]。针对此问题,科研工作者作出了一系列探究,开发了生物细胞的三维 (Three-dimensional,3D) 培养技术。与传统的2D细胞培养相比,3D细胞培养注重细胞间的接触及细胞-基质间的接触,更接近于生物体的生长环境,更适合于药物筛选、细胞培植等研究。因此,开发3D细胞培养系统具有良好的应用前景[10-11]。2017年Fang等[12]开发了一系列三维人体器官的体外模型,培养出细胞球状体。日本的ORGANOGENIX公司开发了基于3D结构支架的细胞培养板[13],并在3D细胞培养板上培养人宫颈癌细胞,实现了3D培养基的商业应用。Hu等[14]开发了一种3-氨基苯基硼酸功能化石墨烯泡沫网络,该网络结合了3-氨基苯基硼酸的仿生性能和石墨烯的机械、电化学性能,耐久性好且电化学传感性能灵敏的优点,因此这种3D细胞培养材料可实现培养过程的实时监控。Han[15]应用胶原蛋白与转谷氨酰胺酶交联,开发出一种可调节的3D细胞培养系统,并在细胞分析中起到了至关重要的作用。然而,目前制备3D细胞培养基的方法成本高、且培养基耐久性与耐腐蚀性差。所以为了开发出一种工艺简单、成本低廉、性能良好的3D细胞培养基,我们将微结构聚合物薄膜作为功能性基底,引入到3D细胞培养基的制备中。
由Wenzel模型[16]和Cassie-Baxter模型[17]可知,同一种材料当表面微结构发生变化时,其表面的液体接触角也会随之变化。因此,通过调节材料表面微结构即可控制表面性质,从而实现对细胞生长的影响。可见,深入研究材料制备方法和界面调控机制,开发成本低廉、工艺简单、表界面特性可控、性能持久、可用于3D生物细胞培养的微结构薄膜材料具有重要意义。
本研究介绍了一种工艺简单、易于界面改性的微结构阵列聚合物薄膜(Microarray-structured polymer film,MSPF) 的制备方法,并将MSPF应用于3D生物细胞的培养,探究了不同的微结构对细胞形态的影响,得到了最适合于制备细胞3D培养基的微结构薄膜。我们在降低制作成本的基础上,制备出多种结构的细胞培养基,并深入研究其性能,为微米结构超疏水薄膜应用于生物细胞培养领域打下基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
无水乙醇、丙酮、三氟 (1H,1H,2H,2H-全氟正辛基) 硅烷、乙二胺四乙酸 (EDTA) 等均为分析纯(国药集团化学试剂有限公司);去离子水为自制 (18 MΩ∙cm);压印胶 (UV54) 购自康得新复合材料集团股份有限公司;聚二甲基氧烷弹性体 (PDMS) 主剂和固化剂 (Sylgard 184) 购自道康宁 (上海) 有限公司;胎牛血清和DMEM细胞培养剂购自美国Gibco公司。
1.1.2 仪器与设备
超纯水机 (Milli-Q Reference System,美国 Millipore公司);氧气等离子机 (Plasma-Preen Ⅱ 862,迈可诺技术有限公司);纳米压印设备 (自制);旋涂仪 (VCT-100,MTI Corp.);CO2培养箱 (上海力申科学仪器有限公司);扫描电镜 (SEM,S4800,Hitachi);接触角测试仪 (DSA100,Kruss Kontaktwinkle Inc.);3D激光扫描显微镜 (VK-9700K,日本基恩士公司)。
1.2 方法
1.2.1 3D微结构薄膜制备
图1为制备MSPF的工艺流程。首先,对Si模板进行抗粘处理,将Si模板放在氧气等离子体机中处理5 min,再放入自制的分子气相沉积设备中,在其周围滴上4 μL疏水剂 (三氟 (1H,1H,2H,2H-全氟正辛基) 硅烷),真空状态下加热到150 ℃,保温3 h。然后,将PDMS主剂与固化剂按照10∶1的比例混合均匀,浇铸在Si模板上,放入真空箱中抽至0.08 MPa,除去气泡,水平静置30 min后放入60 ℃烘箱中固化3 h,剥离后得PDMS透明柔性模板。第三步,将玻璃裁剪成10 cm×5 cm矩形,依次用丙酮、乙醇、去离子水各超声15 min并用氮气吹干,用作衬底。将压印胶旋涂于玻璃基底上,转速为500 r/min,时间10 s,之后改为1 000 r/min、30 s;最后,把上述PDMS模板贴于涂有压印胶的玻璃表面并赶走气泡,用光强10 mW/cm2的UV灯照射4 min,剥离PDMS后即得到MSPF。
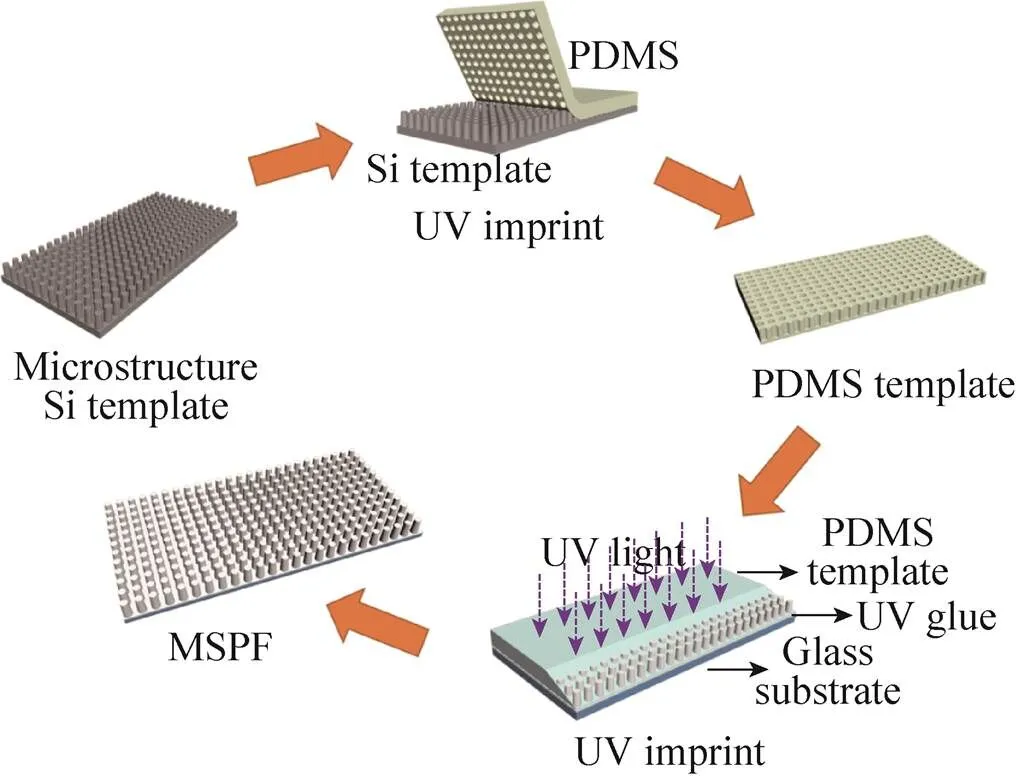
图1 MSPF薄膜制备流程图
本研究采用纳米压印工艺制备了几种不同结构的MSPF,分别为:周期1 μm凹坑阵列薄膜、周期3 μm柱形阵列薄膜、周期10 μm柱形阵列薄膜和平面结构薄膜,将这几种MSPF留作对比实验。
1.2.2 MSPF的表面处理
通过纳米压印制备的MSPF表面为疏水性,将MSPF放到氧气等离子机中,在功率150 W下处理2 min,即可将表面变为亲水性。将同种结构的薄膜各制备两份,其中一份不做处理,另一份进行氧气等离子体处理,并对薄膜样品进行编号,如表1所示。将两份样品同时用作细胞培养的基底薄膜,进行对比实验。
1.2.3 293T细胞的培养
实验选择293T细胞作为培养的目标细胞。首先将293T细胞进行传代并接种到各个样品薄膜上,其操作步骤如下:1) 将不同结构的薄膜培养基用乙醇冲洗,并用氮气吹干;2) 将15 mL离心管、移液器、移液枪、12孔培养板、薄膜培养基放在洁净台上用紫外灯照射30–40 min,进行消菌杀毒;3) 将无Ca2+、Mg2+的PBS,10%的胎牛血清,100 U/mL双抗DMEM放到水浴锅中预热,备用,水浴锅温度设为37℃;4) 从37 ℃、5%的CO2培养箱中取出293T细胞,使用移液管将细胞移植到清洗过的细胞瓶中;5) 使用PBS将EDTA-0.25%胰蛋白酶稀释5倍,取2–3 mL加入到细胞瓶中。使用显微镜观察细胞,待细胞变圆加入胎牛血清,同时轻轻振荡细胞瓶将瓶上的细胞震落,之后放入离心管中1 000 r/min离心3 min;6) 用移液管吸取上清液,加入3–5 mL DMEM将细胞稀释,取一定量的细胞液进行再次稀释,对细胞计数,留作备用;7) 分别将不同的薄膜培养基放入到12孔培养板中,用无菌移液管吸取75%的乙醇加入到培养板的孔洞中,对薄膜培养基进行洗涤,吸净乙醇;吸取5 mL的PBS继续洗涤薄膜培养基,吸净PBS;8) 使用移液管将制备好的细胞悬浮液接种到12孔培养板的薄膜培养基上,放置到37 ℃、5%的CO2培养箱中进行培养;9) 待细胞培养至20 h时取出,显微镜观察细胞。
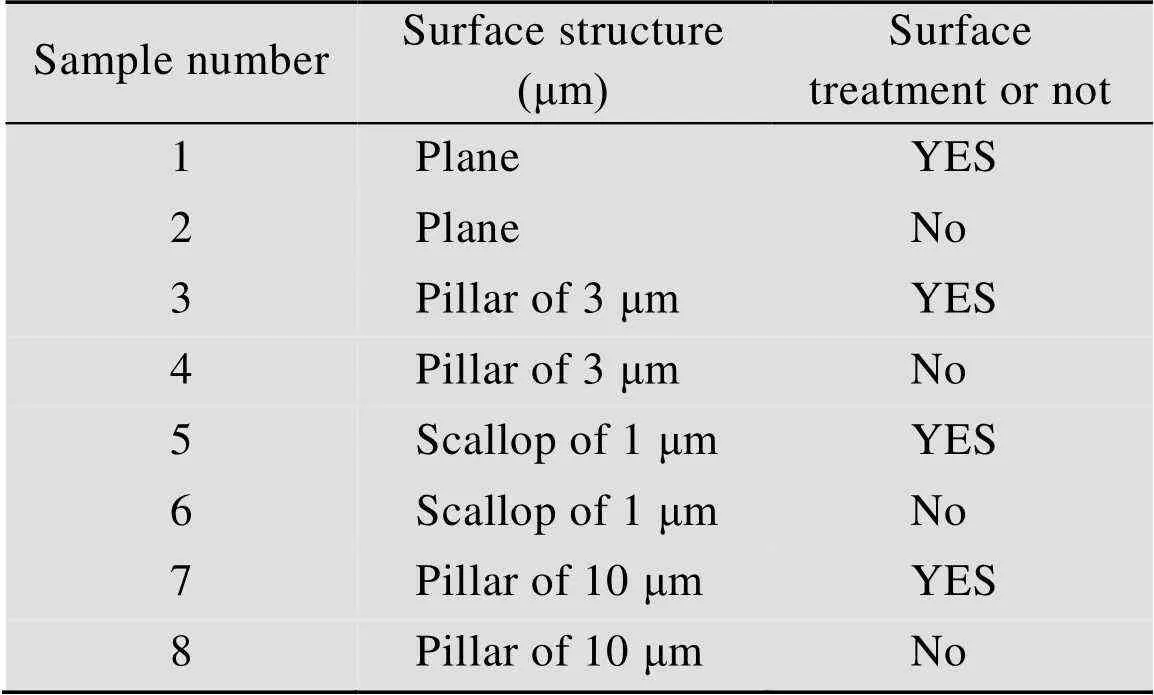
表1 不同结构薄膜参数
在培养结束后,需要对细胞进行特定的处理使其保持现有的形貌特征,以便进行观察。对细胞的处理包括:1) 细胞的固定。常用的固定方法是:在4 ℃下使用2.5%戊二醛浸泡1–3 h,1.0%四氧化锇浸泡0.5–1 h;2) 细胞的脱水。常用的脱水剂为乙醇,方法是梯度脱水,即分别使用30%、50%、70%、80%、85%、90%、95%、100%的乙醇浸泡15 min。在脱水过程中要沿壁缓慢加入乙醇,避免对样品的冲击、损坏等;3) 细胞的干燥。采用的方法为空气干燥法,即将细胞样品脱水到无水状态后,退回到85%的脱水剂,然后取出样品在空气中自然干燥。
1.2.4 性能测试
使用SEM对样品表面形貌进行观测。使用接触角测试仪对不同结构的薄膜进行接触角测试。同时,使用3D激光扫描显微镜对细胞样品进行较大面积的观察、测试。
2 结果与分析
2.1 MSPF的性能表征
图2为周期3 μm、10 μm柱形阵列结构薄膜与周期1 μm凹坑阵列结构薄膜的SEM。从图2B中可测出柱子的高度为1.5 μm,周期3 μm,柱子形状呈圆包状,侧壁光滑,柱子顶部直径约为1 μm,底部直径约为2 μm。图2E中凹坑结构的深度为500 nm,图2D中可以看出凹坑上端呈圆形,周期为1 μm。图2H中柱子高为10 μm,直径为4 μm,阵列周期为10 μm,柱子为圆柱形,侧壁光滑,柱子上下直径基本相同。通过纳米压印制备的微结构薄膜上的结构都是大面积规整有序。

图2 不同结构薄膜的SEM图. (A)–(C) 分别为3 μm柱形阵列薄膜表面的俯视图、断面图和斜面图 (60°);(D)–(F)分别为1 μm凹坑阵列薄膜表面的俯视图、断面图和斜面图 (60°);(G)–(I) 分别为10 μm柱形阵列薄膜表面的俯视图、断面图和斜面图 (60°)
如前所述,由Wenzel模型[16]和Cassie-Baxter模型[17]可知相同材料的薄膜,其表面微结构的不同会影响其表面接触角。同时,相同结构、同种材料的薄膜当其表面自由能发生变化时其接触角也会发生变化[18-19]。因此我们对8种样品薄膜分别进行了接触角的测试,结果见图3。我们发现,在结构相同时通过氧气等离子体的处理薄膜表面接触角会变小。图3 A、B、C、D即为氧气等离子体处理后的聚合物薄膜,因为氧气等离子体处理会使聚合物表面悬挂键增多,改变其表面能,所以在结构不变的情况下接触角会变小。
由图3也可以看出,在亲水处理之前只有10 μm柱形阵列薄膜的接触角达到了超疏水的效果,接触角为161.5°,且在经过氧气等离子体处理后,接触角变为0°,变为超亲水。所以处理前后这种结构的MSPF薄膜接触角变化最大,在探究接触角对细胞生长形貌影响时作为重点观察样品。
2.2 微结构薄膜在3D生物细胞培养中的应用
应用纳米压印制备的聚合物薄膜,由于其特殊的表面形貌以及不同的表面润湿性,导致在应用这些薄膜进行细胞培养时,会影响细胞的形貌、迁移等特征。因此将实验1.2中制备得到的8种不同表面性质的薄膜应用于293T细胞的培养,并对培养结构进行了详细分析,研究微结构薄膜对生物细胞的影响。图4分别为8种薄膜样品在细胞生长不同时间段的显微镜图片。

图3 亲水处理前后接触角的变化

图4 不同培养时间下各薄膜上细胞显微镜图
一号膜 (亲水性平面薄膜):2 h部分细胞贴壁;20 h大部分细胞贴壁铺展生长;30 h细胞呈明显贴壁生长,且细胞数量较多 (图4A)。
二号膜 (疏水性平面薄膜):2 h细胞漂浮到细胞液中,悬浮生长;20 h细胞聚团,仍有大部分悬浮在细胞液中;30 h细胞也呈现贴壁生长 (图4B)。
三号膜 (亲水性3 μm柱形阵列薄膜):2 h细胞大部分粘附在膜上;20 h细胞聚团粘附在膜上生长;30 h时细胞呈现贴壁,但细胞数量较多 (图4C)。
四号膜 (疏水性3 μm柱形阵列薄膜):2 h细胞粘附在膜上;20 h细胞粘附在膜上生长,由于此时细胞体积较小所以呈现3D生长;30 h细胞体积变大呈贴壁生长 (图4D)。
五号膜 (亲水性1 μm凹坑阵列薄膜):2 h细胞粘附在膜上;20 h细胞贴壁生长;30 h细胞大部分铺展生长,与平面薄膜的相似 (图4E)。
六号膜 (疏水性1 μm凹坑阵列薄膜):2 h细胞悬浮在细胞液中;20 h细胞聚团,大部分仍然悬浮在细胞液中;30 h留在薄膜上的细胞呈大面积贴壁生长 (图4F)。
七号膜 (亲水性10 μm柱形阵列薄膜):2 h细胞球状粘附在膜上;20 h部分细胞聚团,仍有球状细胞,细胞粘附在膜上,细胞3D生长效果好,且漂浮细胞很少;30 h细胞仍呈球状生长,说明在此薄膜上细胞3D生长效果较好 (图4G)。
八号膜 (疏水性10 μm柱形阵列薄膜):2 h细胞球状体落在膜上,轻微晃动大部分漂浮到细胞液中;20 h有些细胞聚团,大部分细胞仍是球状,轻微晃动少部分细胞悬浮;30 h细胞呈球状立体生长,但是粘附力差,稍微晃动就会飘落 (图4H)。
通过对比发现,随时间的延长细胞在薄膜上数量逐渐变多,细胞团体积也逐渐变大。其中在20 h时细胞在疏水性3 μm薄膜上和亲水性10 μm柱形阵列薄膜上均呈现3D生长,但随着生长时间延长,最终只有在亲水性10 μm薄膜上可一直保持3D生长状态。因此亲水性10 μm薄膜适用于制备细胞3D培养基。
从图4中还可以看出,在细胞培养到20 h时细胞数量、体积及形貌最适宜观察分析。培养时间短,形貌特征不明显;培养时间过长,细胞易分裂传代,不易观察。因此,我们选取20 h的时间节点,对这个时间段的细胞进行SEM分析。
图5为两种接触角不同的平面结构薄膜上细胞培养的结构。从图5A、B中可以看出,亲水性的平面薄膜上细胞呈现贴壁状态生长,而且细胞通过繁殖、迁移会连接成片,这是传统的细胞培养中细胞生长的状态。图5C、D为疏水性平面薄膜上的细胞状态。与亲水平面薄膜对比可以发现,当平面接触角较大时细胞会呈现球状 (图5C),接近立体生长。但是随着细胞体积的变大也会在细胞边界生长出“触角状”结构 (图5C中右边的细胞),表现出一定贴壁生长特征。这说明在平面结构薄膜上接触角对细胞生长的影响会随着细胞体积变大而减弱。

图5 细胞的SEM图. (A) 和(B) 为一号薄膜上细胞的SEM;(C) 和(D) 为二号薄膜上细胞的SEM
通过接触角不同的平面薄膜上细胞的对比,我们发现表面接触角对细胞形貌有一定的影响,同时,在实验中也发现不同表面微结构也会影响细胞的生长。图6和图7分别为亲水处理后3 μm柱形阵列薄膜和未经处理的3 μm柱形阵列薄膜上细胞培养结果。图6中薄膜的接触角为41.8°,细胞贴在薄膜表面生长,从图6C中可以发现细胞边界也有许多“触角状”结构,并且细胞包裹住柱子,“触角状”结构延伸到柱子之间并向底部生长。由于薄膜亲水性较好,细胞对薄膜的附着力较大,细胞数量较多,所以亲水处理后3 μm柱形阵列薄膜上细胞呈现贴壁生长,不能用作细胞的3D培养。

图6 亲水处理后3 μm柱形阵列薄膜上细胞的SEM

图7 未经亲水处理的3 μm柱形阵列薄膜上细胞的SEM
图7中的薄膜结构与图6中薄膜结构相同,均为3 μm柱形阵列薄膜,但是图7中的薄膜没有经过亲水处理,其接触角为75.9°。在图7C的插图中可以看出,细胞被柱子顶在顶端生长,并没有包裹住柱子,而且细胞边界没有“触角状”结构,说明细胞没有贴壁生长的特征。图7B显示细胞并没有连接成片,并且呈现出一定程度的球状生长状态,证明疏水性3 μm柱形阵列薄膜上细胞接近于三维生长。经过分析其原因是:3 μm柱形阵列结构比细胞体积小,圆包状柱子可以为细胞提供支点,使其与基底脱离,提供立体生长的空间。但由于薄膜接触角较小并没有达到疏水效果,随着细胞的生长,当体积变大时细胞就会逐渐包裹住柱子,呈扁平状并出现“触角状”结构,出现贴壁生长状态,如图7A、D所示。综上,疏水性3 μm柱形阵列薄膜适用于体积较小的组织细胞的3D培养,对于体积较大细胞的支撑效果差。
五号样品与六号样品为周期1 μm凹坑阵列薄膜,由于凹坑结构较小 (图2e),基本不会影响细胞形貌,如图8A所示,亲水性1 μm凹坑阵列薄膜上细胞呈现出明显的贴壁生长状态,与亲水性平面薄膜上细胞的生长状态相似。而疏水性1 μm凹坑阵列薄膜的接触角较大,为110.8°,比疏水性平面薄膜的接触角还要大,所以细胞在薄膜上呈球状,表现出一定程度的三维生长,如图8C所示细胞明显是球状生长,没有贴壁的特征。但是随着细胞体积的变大、迁移和聚集,细胞逐渐向贴壁的二维生长状态转化,如图8D所示,细胞边界依旧长出“触角状”结构。虽然疏水性1 μm凹坑阵列薄膜的接触角大于90°,但细胞整体数量较疏水性平面薄膜上细胞数量多。这是由于凹坑状结构为细胞提供了附着点,使“触角状”分支可以贴附在凹坑中,故其附着力较强,进而细胞数量也较多。

图8 细胞的SEM图. (A)和(B)为五号薄膜上细胞的SEM;(C)和(D)为六号薄膜上细胞的SEM
图9为亲水性10 μm柱形阵列薄膜上的细胞生长状况。从图中可以看出,细胞在柱子之间生长,柱子侧壁为细胞提供了生长支架,使细胞向三维方向生长。图9C中细胞呈现“圆润”的球状,且边界没有“触角状”结构。从图9D大面积视图来看,所有的细胞都是在柱子之间进行三维方向生长。这说明亲水性10 μm柱形阵列薄膜可以保证细胞的3D生长,是细胞3D培养基的最佳候选材料。
图10中为疏水性10 μm柱形阵列薄膜上细胞的生长状态。细胞在薄膜上被顶在柱子顶部,与薄膜底部未接触,呈现悬空状态。这防止了细胞的贴壁生长,在一定程度上保证了细胞的3D生长。随着细胞体积逐渐变大,细胞会包裹住柱子,并沿着侧壁向下生长 (图10C)。从图10D可以看出,薄膜上细胞数量较少,只有较少区域有细胞残留。原因可归结为两点:1) 细胞在柱子顶部生长,柱子周期较大故细胞附着面积较小;2) 由于薄膜的接触角较大,为161.5°,细胞与柱子的结合力小,易脱落到培养液中。通过七、八号样品的对比得出,相同结构薄膜上亲、疏水性的不同对细胞形貌、生长状态影响很大。疏水性10 μm柱形阵列薄膜并不适用于制备细胞3D培养基。

图9 七号薄膜上细胞的SEM

图10 八号薄膜上细胞的SEM
以上通过SEM从微观上研究了薄膜结构与接触角对细胞生长状态的影响。为了进一步验证上述实验结果的分析,我们使用3D激光显微镜对不同薄膜上的细胞进行了宏观上的观察,如图11所示。图11A–D为亲水性的薄膜,可以看出当薄膜接触角较小时细胞数量明显较多,生长较为牢固,且细胞团体积偏大;而疏水性薄膜,参见图11A1–D1,薄膜表面接触角较大,其细胞的数量较少,且细胞团的体积较小、细胞分散。这说明接触角会影响细胞与薄膜的附着力,进而影响细胞团的形貌。接触角大的薄膜上,细胞容易脱落漂浮在培养液中;接触角小的薄膜上,细胞容易粘附在上面,从而有利于细胞的培养、观察和分析。所以通过宏观上的观察,也证实通过调节薄膜表面微结构与润湿性可以对细胞形态进行调节。
3 结论
本研究通过纳米压印制备了不同结构微米阵列聚合物薄膜MSPF,发现不同表面微结构影响表面接触角,证明可以通过调节薄膜表面微结构对其表面接触角进行调控。同时,我们将微米阵列结构薄膜用于293T细胞的培养,主要得到以下结论:1) 细胞在亲水性10 μm柱形阵列薄膜上呈现三维生长状态,这种薄膜可能更适用制备生物细胞3D培养基;疏水性3 μm柱形阵列薄膜适用于体积小、表皮硬的组织细胞的3D培养,对于体积较大的细胞效果差。2) 当薄膜结构相同时,薄膜表面接触角会影响细胞形态。接触角越大细胞越易呈现球状生长,接触角越小则越易贴壁生长。但随着细胞体积变大接触角的影响变小。3) 薄膜表面接触角会影响细胞数量,接触角较大细胞吸附力小易脱落,接触角较小细胞吸附力较大,细胞数量也变多。
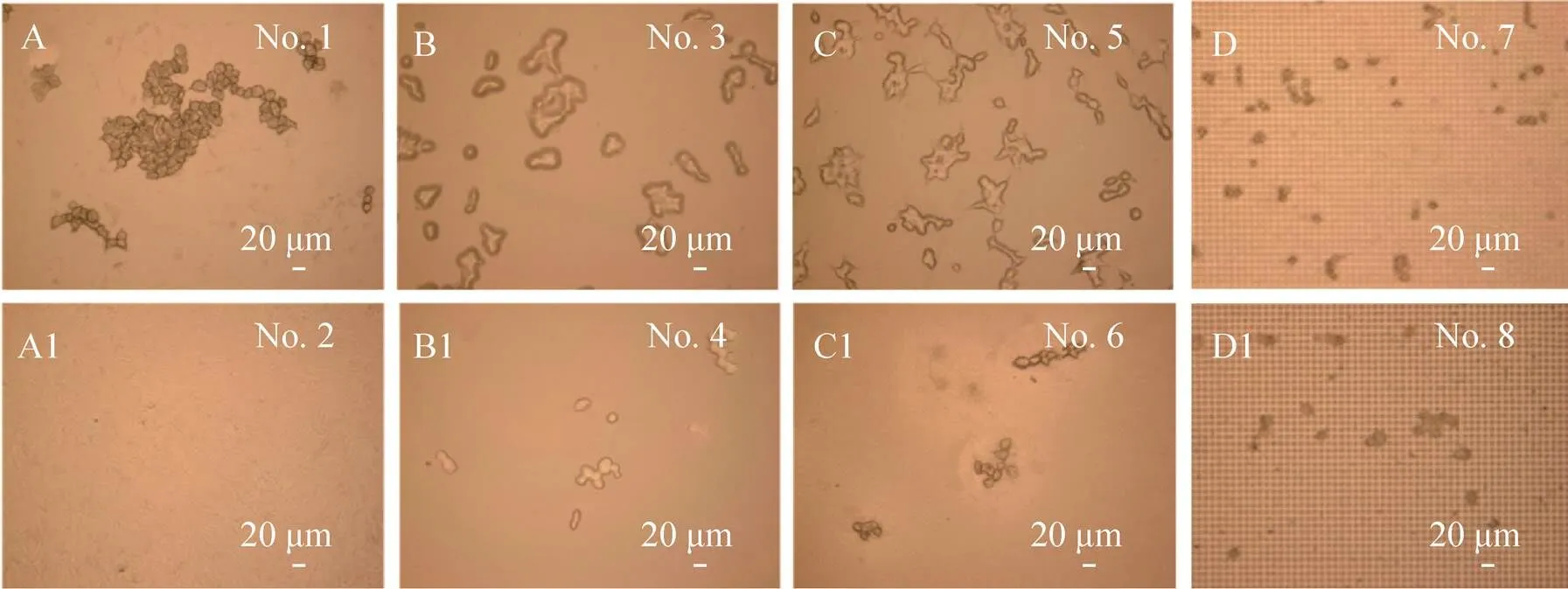
图11 各薄膜样品的激光显微镜图. (A)、(B)、(C)和(D) 为亲水性薄膜;(A1)、(B1)、(C1) 和(D1)为疏水性薄膜
[1] Kola I, Landis J. Can the pharmaceutical industry reduce attrition rates? Nat Rev Drug Discov, 2004, 3(8): 711–715.
[2] Hynds RE, Giangreco A. Concise review: the relevance of human stem cell-derived organoid models for epithelial translational medicine. Stem Cells, 2013, 31(3): 417–422.
[3] Labarbera DV, Reid BG, Yoo BH. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opin on Drug Discov, 2012, 7(9): 819–830.
[4] Ryley JF, Wilson RG. Drug screening in cell culture for the detection of anticoccidial activity. Parasitology, 1976, 73(2): 137–148.
[5] Huang GY, Li F, Zhao X, et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chem Rev, 2017, 117(20): 12764–12850.
[6] Pampaloni F, Reynaud EG, Stelzer EHK. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol, 2007, 8(10): 839–845.
[7] Lee J, Cuddihy MJ, Kotov NA. Three-dimensional cell culture matrices: state of the art. Tissue Eng Part B Rev, 2008, 14(1): 61–86.
[8] Haycock JW. 3D cell culture: A review of current approaches and techniques. Methods Mol Biol, 2011, 695: 1–15.
[9] Page H, Flood P, Reynaud EG. Three-dimensional tissue cultures: current trends and beyond. Cell Tissue Res, 2013, 352(1): 123–131.
[10] Feng ZQ, Chu X, Huang NP, et al. The effect of nanofibrous galactosylated chitosan scaffolds on the formation of rat primary hepatocyte aggregates and the maintenance of liver function. Biomaterials, 2009, 30(14): 2753–2763.
[11] Akhavan O. Graphene scaffolds in progressive nanotechnology/stem cell-based tissue engineering of the nervous system. J Mater Chem B, 2016, 4(19): 3169–3190.
[12] Fang Y, Eglen RM. Three-dimensional cell cultures in drug discovery and development. SLAS Discov, 2017, 22(5): 456–472.
[13] NanoCulture Plate[EB/OL]. [2018-04-17]. http:// www.nanocultureplate.com/products_e.
[14] Hu XB, Liu YL, Wang WJ, et al. Biomimetic graphene-based 3D scaffold for long-term cell culture and real-time electrochemical monitoring. Anal Chem, 2018, 90(2): 1136–1141.
[15] Han B. Screening miRNA for functional significance by 3D cell culture system. Methods Mol Biol, 2018,1733: 193–201.
[16] Wenzel RN. Resistance of solid surface to wetting by water. Ind Eng Chem, 1936, 28(8): 988–994.
[17] Cassie ABD, Baxter S. Wettability of porous surfaces. Trans Faraday Soc, 1944, 40: 546–551.
[18] Zhang HY. Influence of microstructure fro superhydrophobic surfaces on superhydrophobicity and its application[D]. Xiangtan: Xiangtan University, 2013 (in Chinese).张泓筠. 超疏水表面微结构对其疏水性能的影响及应用[D]. 湘潭: 湘潭大学, 2013.
[19] Jiang L, Feng L. Bioinspired Intelligent Nanostructured Interfacial Materials. Beijing: Chemical Industry Press, 2007 (in Chinese).江雷, 冯琳. 仿生智能纳米界面材料. 北京: 化学工业出版社, 2007.
Preparation of microarray-structured polymer film and its effect on 3D cell culture
Weimin Jiang1, Weikang Zhang2,3, Dongdong Li2, and Ye Song3
1 Nanjing Stomatological Hospital, Medical School of Nanjing University, Nanjing 210008, Jiangsu, China 2 Shanghai Advanced Research Institute, Chinese Academy of Sciences, Shanghai 201210, China 3 Key Laboratory of Soft Chemistry and Functional Materials of Education Ministry, Nanjing University of Science and Technology, Nanjing 210094, Jiangsu, China
The two-dimensional (2D) cell culture model is currently used to study cellular processes and drug screening for human diseases. However, the growth of cells is affected by many factors. For conventional 2D cell culture, many of the difficulties are encountered in accurately replicating the cell function in three-dimensional (3D) tissues. Compared with 2D cell culture, much attention is paid to the cell-to-cell and cell-matrix interactions for 3D cell culture systems, which can more closely mimic the growth environment for cultured cells. Therefore, the 3D cell culture system was more suitable for a variety of applications such as drug screening and cell proliferation. In this work, we prepared microarray-structured polymer films with different geometric structures by nanoimprint lithography and used the films as cell culture platforms for the culture of 293T cells. Through the adjustment of the surface morphology and water contact angle of the prepared films, the regulation of the morphological changes of cell growth was successfully realized. Experimental results demonstrated that the hydrophilic films with 10 μm-pillar microstructure are applicable to 3D cell culture, whereas the hydrophobic films with 3 μm-pillar microstructure are only suitable for 3D culture of cells with a smaller size and stiff cuticular layer. In addition, cells tended to the formation of spheroids on the hydrophobic films, while cells usually adhered to the surface and grew on the hydrophilic films. This work represents further technological progress in the development of 3D cell culture, thereby facilitating future studies of physiologically relevant processes.
nanoimprint, superhydrophobic, superhydrophilic, cell culture
April 17, 2018;
June 20, 2018
National Natural Science Foundation of China (Nos. 61474128, 51377085).
Ye Song. Tel: +86-25-84315949; E-mail: soong_ye@sohu.com
10.13345/j.cjb.180144
国家自然科学基金(Nos. 61474128,51377085) 资助。
2018-07-10
http://kns.cnki.net/kcms/detail/11.1998.Q.20180709.1036.002.html
(本文责编 郝丽芳)

