fv-gs6:一个与金针菇菌柄伸长相关的葡聚糖合酶基因
龙 莹, 严俊杰, 仝宗军, 刘媛媛, 苗 娟, 陶永新, 江玉姬, 谢宝贵
(1.福建农林大学生命科学学院菌物研究中心;2.福建农林大学园艺学院;3.福建农林大学食品科学学院, 福建 福州 350002)
真菌细胞壁的成分主要是多糖(β-1,3-葡聚糖、β-1,6-葡聚糖、几丁质和甘露糖)和糖蛋白[1,2].β-葡聚糖是构成真菌细胞壁的主要多糖,位于细胞壁的内侧,占细胞干重的40%~50%,主要是以β-1,3-糖苷键为主链,β-1,6-糖苷键为支链的多糖分子,其特殊的结构有助于激活机体的免疫系统[3,4,5].Wessels[6]曾提到真菌细胞壁的扩张包括多糖的合成与水解.β-1,6-葡聚糖合酶(β-1, 6-Glucan Synthase)是合成β-1,6-葡聚糖的关键基因,可能在细胞壁扩张过程中发挥着重要作用.Kottom et al[7]研究表明,β-1,6-葡聚糖合酶抑制剂能使卡氏肺孢子虫(Pneumocystiscarinii)中β-1,6-葡聚糖的产量降低;促进卡氏肺孢子虫编码β-1,6-葡聚糖合酶基因Pckre6 在kre6缺陷型酿酒酵母(Saccharomycescerevisiae)中表达,恢复了酿酒酵母细胞壁的完整性,推测β-1,6-葡聚糖合酶通过参与β-1,6-葡聚糖的合成,影响细胞壁合成.
金针菇(Flammulinavelutipes)味道鲜美,营养丰富,具有降血脂、降胆固醇、抗癌等功能,具有较高的食用价值和药用价值,在国际市场上被誉为“超级保健食品”[8,9].金针菇菌柄是主要食用部分,研究金针菇菌柄伸长生长机制有助于在生产过程中更好地控制生产条件,提高金针菇产量,带来更多的经济价值.Wong et al[10]研究表明,金针菇菌柄伸长时,伴随着细胞伸长,菌柄细胞数量较原基增多,且在快速伸长阶段细胞数量至少增加了40%.Kamada et al[11,12]研究表明,在长根鬼伞(Coprinusmacrorhizus)菌柄细胞伸长过程中,细胞壁组分的变化与菌柄伸长是平行的,其中多糖组分也会相应地变化.Kamada et al[13]在研究灰盖鬼伞(Coprinuscinereus)菌柄伸长时发现由β-(1→3)和β-(1→6)两种键型构成的葡聚糖组分Ⅲ的分子量显著增加.伞菌菌柄伸长过程与涉及到细胞壁多糖的合成及降解的酶类有关,如β-葡聚糖酶类、几丁质酶、几丁质合酶等[14].酶与食用菌子实体形态发育密切相关,多糖组分变化过程中涉及酶类的作用机制研究尚未成熟[15].金针菇菌柄细长且伸长速度快的特征是研究伞菌菌柄细胞壁合成、细胞伸长的较好材料.
本研究根据金针菇基因组及转录组数据获得到与金针菇菌柄伸长相关的β-1,6-葡聚糖合酶编码基因fv-gs6的序列信息,并对其进行生物信息学分析,初步探究了其在金针菇子实体不同组织及生长发育阶段的表达量,发现fv-gs6在菌柄上高表达,且在伸长期菌柄表达量最高,以期为进一步研究酶类对细胞壁合成、细胞伸长的作用机制提供参考.
1 材料与方法
1.1 供试菌株
金针菇单核菌株Fv01-10以及双核菌株Fv01均由福建省食用菌种质资源保藏与管理中心提供.Fv01是由Fv01-10和Fv01-N配对获得的双核菌株.
1.2 基因组及转录组数据
金针菇单核菌株Fv01-10基因组、金针菇双核菌株Fv01不同生长发育时期转录组数据由福建农林大学菌物研究中心提供.
1.3 样品处理及采集
分别采集Fv01子实体原基期、伸长期菌柄、伸长期菌盖、成熟期菌柄及成熟期菌盖,每个样品收集5个生物学重复.选择处于伸长期的菌柄(柄长约为12 cm),采集菌盖下方0.6~1.5 cm伸长区间及6~7 cm区间的不伸长区段样品,每个样品5个生物学重复.将收集的样品置于锡箔纸中做好标记后迅速放入液氮中保存备用.
1.4 fv-gs6基因准确性验证及结构分析
根据金针菇Fv01-10基因组数据得到fv-gs6基因序列,基因准确性验证参照严俊杰等[16]的方法,以基因序列及上下游各500 bp为参考序列,采用Zoom lite软件[17]将Fv01-10基因组测序所得reads库对参考序列进行定位(相邻paired reads距离设置为1~1 000 bp, 错配碱基数设置为0).
在基因序列上下游各延伸2 kb作为参考序列,参照Yan et al[18]的方法,用金针菇Fv01不同生长发育时期的转录组数据对目的基因及其上下游序列使用Zoom lite软件进行定位(错配碱基数设置为40),分析其基因结构信息.使用在线基因结构模型构建系统GSDS(genestructure display sever,http://gsds.cbi.pku.edu.cn/)绘制fv-gs6的基因结构图谱.
1.5 Fv-GS6蛋白生物信息学分析
蛋白结构域分析采用在线分析软件InterProScan5 (http:// www. ebi. ac. uk/ Tools/ pfa/ iprscan5/);Fv-GS6及其它真菌中的同源蛋白的基序(Motif)分析采用在线软件MEME (http://meme.sdsc.edu/meme/cgibin/meme.cgi;参数设置为:number of different motifs 12; minimum number of sites 2;maximum number of sites 10; minimum motif width 10; maximum motif width 100;P<1×10-10) ;蛋白质信号肽预测与分析采用SignalP (http://www.cbs.dtu.dk/services/SignalP/);蛋白质跨膜结构分析采用TMHMM程序(http://www.cbs.dtu.dk/services/TMHMM/);蛋白质的亚细胞定位采用softberry(http://linux1.softberry.com/berry.phtml);在UniProt网站上筛选下载Fv-GS6的同源序列,采用MEGA6软件包[19](参数为bootstrap values 1000 resamplings)构建相应序列的邻接法(Neighbor-Joining)系统进化树.
1.6 fv-gs6表达量分析
采用OMEGA E.Z.N.A.Plant RNA Kit试剂盒(Omega Bio-Tek,美国)提取样品总RNA,采用TaKaRa PrimeScript TM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa Bio Group,日本)合成cDNA.实时荧光定量PCR采用试剂BIO-RAD iTaq TM Universal SYBR Green Supermix (Bio-Rad,美国),在实时荧光定量 PCR仪(Bio-Rad CFX96,美国) 上进行.实时荧光定量反应体系及程序参考所使用试剂盒的说明书.目标基因的相对表达量使用2-△△CT法进行计算处理.以金针菇Fv01-10甘油醛-3-磷酸脱氢酶编码基因(GAPDH)为内参基因,引物序列如表1所示.
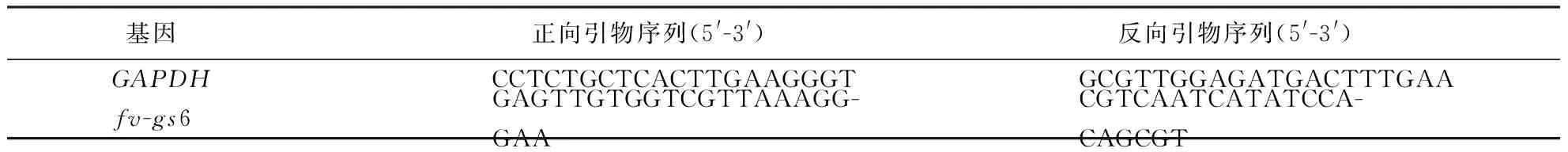
表1 实时荧光定量的引物序列Table 1 Primer sequence of quantitative real-time PCR
2 结果与分析
2.1 fv-gs6基因序列准确性验证及结构分析

图1 基因组Reads在fv-gs6序列上的定位情况Fig.1 Positioning of genomic reads on fv-gs6 sequence
Zoom lite软件reads定位结果(图1)显示fv-gs6基因序列均有Fv01-10基因组reads覆盖,且最低覆盖的reads条数为54条,说明该基因的序列准确可信.
子实体不同生长发育阶段及不同组织的转录组数据经过Zoom lite软件reads定位表明,fv-gs6全长1 439 bp,含有9个外显子,8个内含子(图2),编码339个氨基酸.此结果符合“GT-AG”内含子剪切位置的原则.fv-gs6核酸序列信息已提交至Genbank,基因登录号为MF457899.将该基因序列与Fv01-10基因组进行本地Blast,发现该序列仅定位到scaffold1上,位于3 610 934至3 609 496之间,推测其为单拷贝基因.

图2 fv-gs6基因结构Fig.2 Gene structure of fv-gs6
2.2 Fv-GS6蛋白的生物信息学分析
Fv-GS6的结构域预测结果(图3)表明该蛋白属于糖苷水解酶家族(IPR017853).通过在UniProt网站上筛选下载双孢蘑菇(Agaricusbisporus, Q9P8B3)等9种真菌β-1,6-葡聚糖合酶氨基酸序列进行基序分析,结果显示β-1,6-葡聚糖合酶基序可以分为子囊菌和担子菌两大类,金针菇属于担子菌,其Fv-GS6基序归属于担子菌、并且与双孢蘑菇相似,支持金针菇Fv-GS6属于β-1,6-葡聚糖合酶的推测(图4).
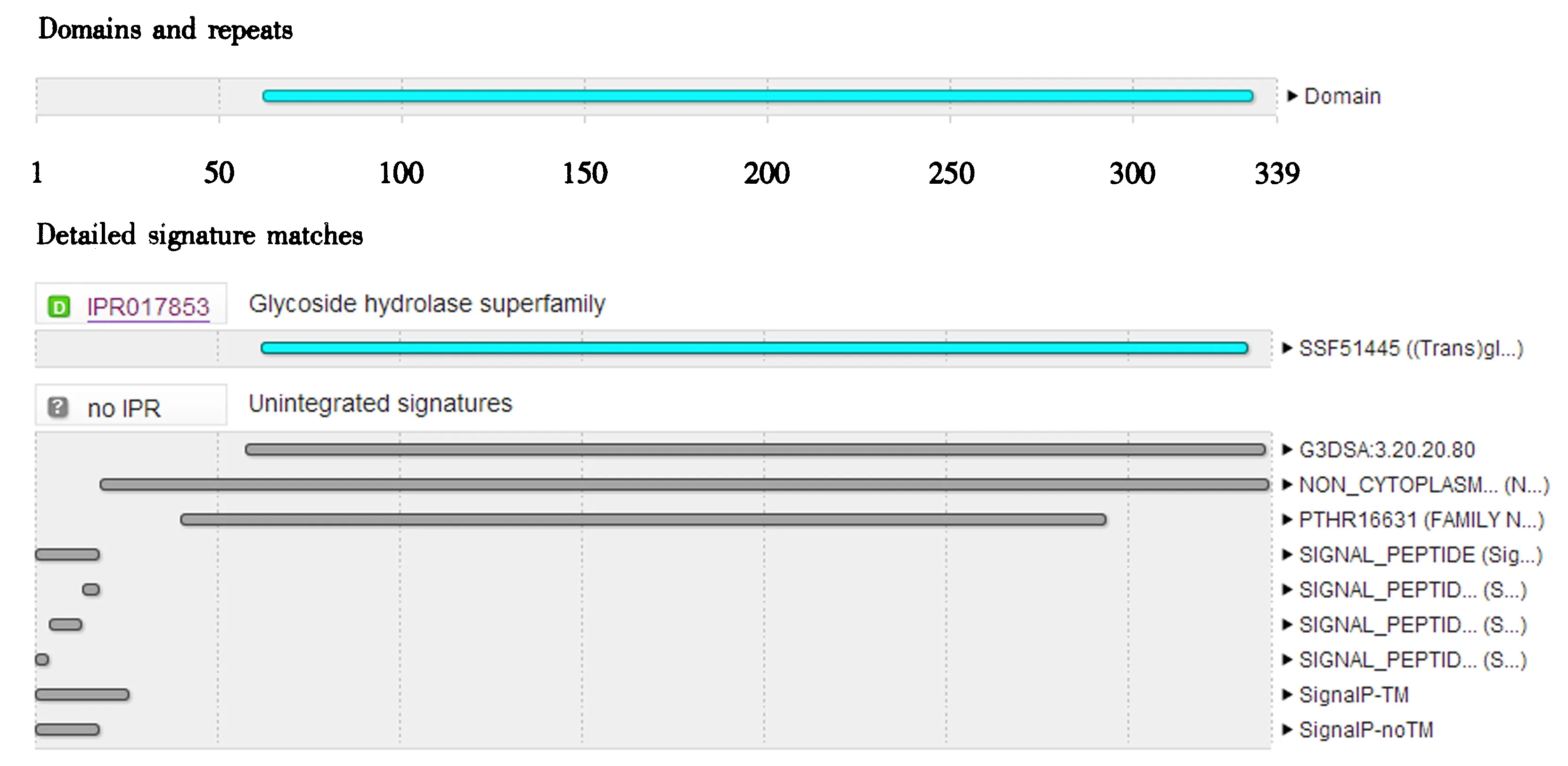
图3 Fv-GS6蛋白结构域Fig.3 Protein domain of Fv-GS6
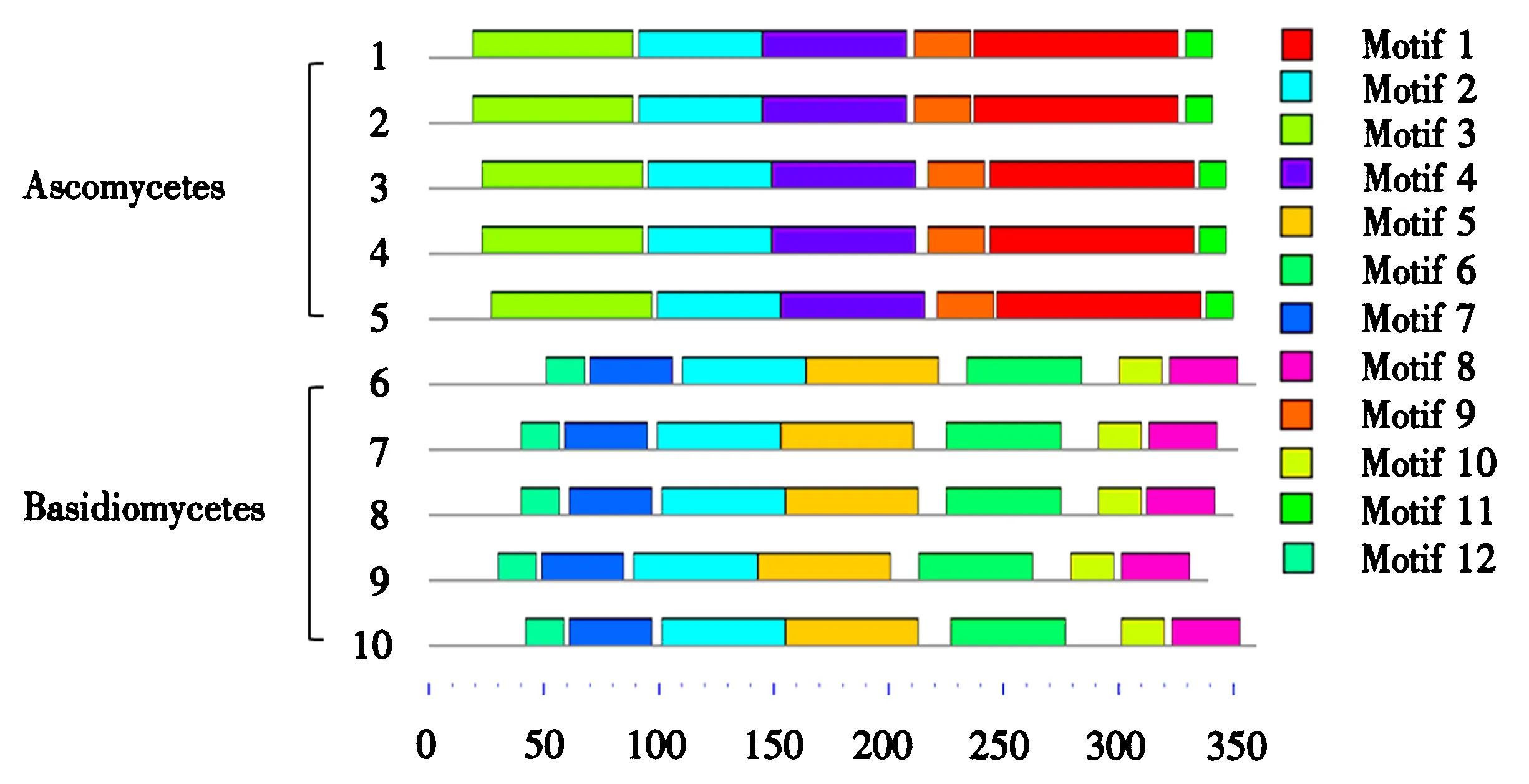
1至5:Pochonia chlamydosporia (A0A179FS78), Metarhizium anisopliae (A0A0B4GPK3), Isaria fumosorosea (A0A167PLB3), Cordyceps confragosa (A0A168BJH5), Hypocrea jecorina (A0A024S1Z0). 6至10:Agaricus bisporus (Q9P8B3), Mycena chlorophos (A0A146HY51), Moniliophthora roreri (V2XTE5), Fv-GS6, Coprinopsis cinerea (A8NUV7).图4 Fv-GS6和其它真菌中同源蛋白β-1,6-葡聚糖合酶的基序分析Fig.4 Motifs of Fv-GS6 and other fungal β-1, 6-glucan synthase homology proteins
利用在线软件对fv-gs6编码的蛋白进行信号肽预测,结果显示该蛋白具有信号肽(图5A),预示着该蛋白可能通过内质网-高尔基体途径,且通过信号肽切割位点剪切信号肽形成成熟的蛋白质,属于分泌型蛋白;亚细胞定位结果(图5B)也支持该蛋白位于细胞外.另外,跨膜结构预测结果显示Fv-GS6蛋白没有跨膜结构,不属于跨膜蛋白(图5C).
2.3 系统进化树分析
通过在UniProt网站上筛选下载双孢蘑菇(Agaricusbisporus, Q9P8B3)、灰盖鬼伞(Coprinopsiscinerea, A8NUV7)、豆薯层锈菌(Phakopsorapachyrhizi, A0A0S1MIW1)、红褐肉座菌 (Hypocreajecorina, A0A024S1Z0)等12个物种的β-1,6-葡聚糖合酶氨基酸序列,用MEGA6软件包构建邻接法(Neighbor-Joining)系统进化树.结果(图6)显示担子菌和子囊菌的β-1,6-葡聚糖合酶分别聚在两个大分支上,担子菌这一大分支中又可以分为两小类,金针菇中的Fv-GS6蛋白与双孢蘑菇(Agaricusbisporus)聚在同一小分支上.Fv-GS6蛋白归属于担子菌这一分支,它与基序的分析结果相一致.
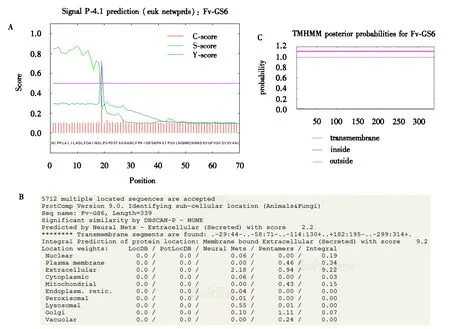
A为Fv-GS6信号肽预测结果;B为Fv-GS6亚细胞定位结果;C为Fv-GS6跨膜结构预测结果.图5 Fv-GS6信号肽(A)、亚细胞定位(B)及跨膜结构预测(C)结果Fig.5 Signal peptide (A), subcellular localization (B) and transmembrane structure prediction (C) of Fv-GS6
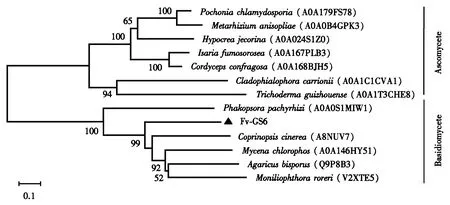
图6 Fv-GS6系统发育进化分析Fig.6 Phylogeny analysis of Fv-GS6
2.4 fv-gs6在金针菇子实体各个生长发育阶段表达量检测
fv-gs6的qRT-PCR结果(图7A)显示:以原基时期的表达量为对照,fv-gs6在伸长期菌柄、伸长期菌盖、成熟期菌柄、成熟期菌盖的表达量分别是原基的97.94倍、0.38倍、64.15倍、0.08倍.在金针菇子实体生长发育阶段,fv-gs6在菌柄的表达量远高于在其它组织或发育阶段的表达量,且在伸长期菌柄的表达量高于在成熟期菌柄的表达量,该结果说明fv-gs6可能在伸长期菌柄中发挥着比较重要的作用.对fv-gs6在金针菇菌柄伸长区段与非伸长区段的表达量进行检测,qRT-PCR结果(图7B)显示fv-gs6在菌柄伸长区段的表达量是不伸长区段的5.42倍.结果表明fv-gs6的表达量与金针菇菌柄伸长速度呈正相关.
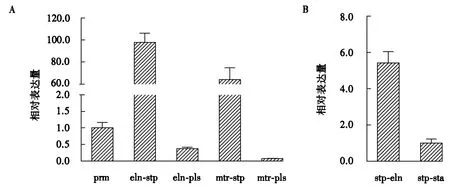
A为fv-gs6在金针菇子实体各个生长发育阶段表达量;B为fv-gs6在金针菇菌柄不同伸长区段的表达量prm:原基,eln-stp:伸长期菌柄,eln-pls:伸长期菌盖,mtr-stp:成熟期菌柄,mtr-pls:成熟期菌盖,stp-eln:菌柄伸长区段,stp-sta:菌柄非伸长区段.图7 fv-gs6在金针菇子实体中的表达量Fig7 Relative expression level of fv-gs6 in F.velutipes fruit body
3 讨论
Humbel et al[20]通过抗体标记等方法,在酿酒酵母的高尔基体、小囊泡、细胞膜底层检测到了β-1,6-葡聚糖的存在,推测β-1,6-葡聚糖的合成始于内质网,途经高尔基体,最后定位于细胞表面.本研究对Fv-GS6蛋白的信号肽、跨膜结构及亚细胞定位的分析显示该蛋白具备完整的信号肽,且亚细胞定位结果显示在细胞外,可以被分泌到细胞外合成并行使催化功能.有研究表明[20],仅有少量的β-1,6-葡聚糖定位在细胞内,而绝大多数分布于细胞膜外;Montijn et al[21]的研究结果也显示β-1,6-葡聚糖的合成大部分发生在细胞表面.据此推测:β-1,6-葡聚糖可能大部分在细胞外合成并直接用于组成细胞壁结构,仅有少部分在细胞内合成并通过内质网——高尔基体途径被分泌到细胞外而发挥作用.
Gilbert et al[22]研究发现在新型隐球菌(Cryptococcusneoformans)中,KRE(killer toxin resistant)家族的KRE5、KRE6与β-1,6-葡聚糖合成相关,具有维持细胞壁完整性等作用,在这些基因突变株中发现β-1,6-葡聚糖含量减少、生长速度减慢且表型异常.Mol et al[23]研究双孢蘑菇(Agaricusbisporus)时发现在菌柄快速伸长阶段β-葡聚糖中由β-1,6-糖苷键连接的葡聚糖侧链比重增加.Eastwood et al[24]研究表明,在双孢蘑菇采收后,β-1,6-葡聚糖合酶的编码基因的转录水平仍有所提高,Braaksma et al[25]研究表明,在双孢蘑菇后熟阶段菌柄、菌盖、菌褶都有生长,推测β-1,6-葡聚糖合酶可能影响细胞壁成分变化.本研究结果显示,fv-gs6在金针菇菌柄中高表达,在伸长期菌柄的表达量高于成熟期菌柄的表达量,且在菌柄伸长区段的表达量高于非伸长区段的表达量;推测该基因的高表达可以提高菌柄细胞β-1,6-葡聚糖的合成量,增加细胞壁合成速度,从而促进菌柄伸长.
致谢:国家食用菌品种改良中心福建分中心、福建省食用菌工程技术研究中心为本研究提供了试验与分析条件,在此表示感谢!

