外泌体源性oar-miR-10b在绵羊痘病毒感染绵羊睾丸细胞中的动态表达及靶基因的鉴定
孔贺磊,吴金恩,郑亚东,何贵天,李雅婷,丁军涛*
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046;2.中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,甘肃兰州 730046)
MicroRNA(miRNA)是一类长度为19个~23个核苷酸、参与调控基因表达的内源性单链非编码RNA分子[1],广泛存在于各种动物、植物和病毒中。miRNA能通过与mRNA 3′UTR以完全或不完全配对的方式降解或抑制靶基因的表达,具有调控生物体发育、细胞分化、细胞凋亡、肿瘤形成及病毒感染等多种生物学功能[2]。已有研究报道,哺乳动物有50%以上的蛋白表达基因受miRNA调控[3]。病毒作为一种严格细胞内寄生病原体,它的感染会导致细胞内RNA的动态平衡发生改变,特别是细胞内miRNA。目前已有研究证实,哺乳动物痘病毒和痘苗病毒能通过自身编码的Poly A聚合酶VP55降解宿主细胞中的miRNA[4],从而为痘病毒的感染创造条件。由此可见,痘病毒的感染过程与miRNA之间存在一定的相应关系。
作为miRNA的一员,miR-10b不仅在哺乳动物中广泛分布,而且具有高度保守性,这暗示着miR-10b在生物体中可能扮演着重要角色。已有大量研究表明,miR-10b在肿瘤细胞中普遍高表达,如在肝癌[5]、食管癌[6]、胰腺癌[7]和鼻咽癌[8]等肿瘤组织中都有异常表达,这种异常与肿瘤的侵袭和转移密切相关[9],且不影响细胞的活力和增殖能力。但是有关miR-10b在病毒感染方面的研究报道很少。
本实验室前期通过Cytoscape生物信息软件中的bioNGO插件进行关联分析,发现oar-miR-10b分别与PAPOLA、HOXA1、INHBB、GATAD2A及BCL2L2等基因相互作用。已有研究证实[10-11],PAPOLA、HOXA1、INHBB、GATAD2A等基因主要参与癌症的发生发展,而BCL2L2基因参与细胞凋亡过程。当BCL2L2的表达量升高时,细胞的凋亡就会受到抑制,这可能进而为病毒的存活、繁殖和潜伏感染提供条件。
本研究以绵羊痘病毒(Sheop poxvirus,SPPV)感染绵羊睾丸细胞4 h后外泌体中miRNA的高通量测序结果为基础,采用实时荧光定量PCR方法检测绵羊痘病毒感染绵羊睾丸细胞0、4、24、48、72 h外泌体中oar-miR-10b的动态表达变化情况,验证基因BCL2L2与oar-miR-10b的相互作用关系,为进一步研究oar-miR-10b在绵羊痘病毒感染过程中的作用机制奠定基础。
1 材料与方法
1.1 材料
绵羊睾丸细胞、293FT细胞为本实验室保存,大肠埃希菌感受态细胞DH5α购自北京全式金生物有限公司;限制性内切酶SacⅠ、XhoⅠ、DNA Marker、T4 DNA连接酶、克隆载体pMD18-T、PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒等购自宝生物工程(大连)有限公司;cel-miR-39、引物、BCL2L2-MUT和oar-miR-10b的合成及测序均由上海生物科技有限公司完成;实时荧光定量PCR检测试剂购自上海生工生物工程有限公司;Trizol LS 试剂及脂质体 R2000 Reagent购自Invitrogen公司;双荧光素酶报告载体PmirGLO、DualGGlo RLuciferase Assay System检测试剂盒购自Promega公司;质粒小提试剂盒、胶回收试剂盒均购于天根科技有限公司。
1.2 方法
1.2.1 引物设计与合成 从miRBase数据库中查取miR-10b序列,并选取Cel-miR-39作为外参基因,用DNAMAN和Primer 5.0软件设计引物,并送往上海生工生物工程有限公司进行合成(表1)。
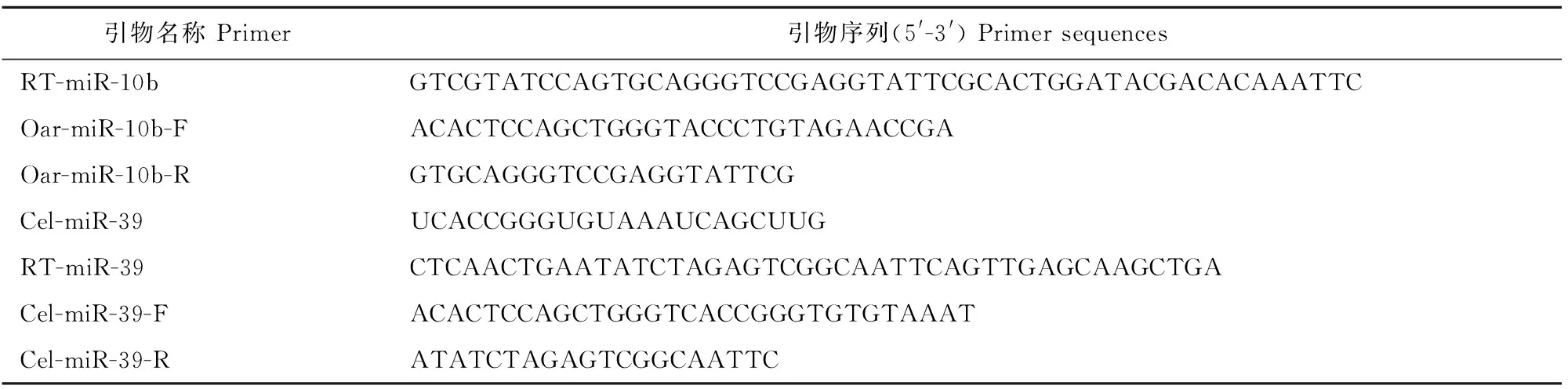
表1 oar-mir-10b和Cel-miR-39基因扩增引物
1.2.2 Oar-miR-10b和Cel-miR-39的实时荧光定量PCR检测 应用细胞培养液总外泌体提取试剂(invitrogen)分别分离感染绵羊痘病毒0 h、4 h、24 h、48 h和72 h后的绵羊睾丸细胞的外泌体,同时,不同时期的外泌体中分别加入人工合成的Cel-miR-39基因作为外参基因。应用Trizol LS分别提取5个不同时期外泌体中的总RNA,并以其为模板,反转录成cDNA第一条链(图1),将合成的cDNA按照10倍梯度稀释后,按照PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒进行操作,将反应溶液充分混匀后,按照以下反应条件进行实时荧光定量PCR检测。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,60 ℃ 30 s,40个循环。

图1 miRNA检测原理
1.2.4 双荧光素酶报告载体的构建 转化、提取PmirGLO空载体并进行双酶切,将双酶切的目的片段BCL2L2和PmirGLO 16℃过夜连接,将构建的重组载体转化入DH5α感受态细胞,培养18 h后提取重组质粒,并进行双酶切鉴定。
1.2.5 双荧光素酶报告基因的检测 取生长状态良好的293FT细胞,以5×104CPU接种于96孔板,过夜培养后,弃掉培养液后每孔加入100 μL的DMEM无血清培养基,置于室温平衡15 min以上。每孔加入100 μL的Dual-Glo®Luciferase Reagent,室温下避光放置15 min以上,用GloMax96荧光检测仪检测萤火虫荧光素酶活性并进行数据采集。加入100 μL的Dual-Glo®Stop&Glo®Reagent后至少等待15 min后再检测海肾荧光素酶活性。海肾荧光素酶活性检测方法同萤火虫荧光素酶活性检测方法相同,加入100 μL的Dual-Glo®Luciferase Reagent,室温避光放置15 min后,用GloMax96荧光检测仪检测海肾荧光素酶活性并记录数值。
分组如下。A组:PmirGLO空载体+Oar-mir-10b类似物;B组:PmirGLO空载体+阴性对照(NC);C组:PmirGLO BCL2L2-WT+Oar-mir-10b类似物;D组:PmirGLO BCL2L2-WT+阴性对照(NC);E组:PmirGLO BCL2L2-MUT+Oar-mir-10b类似物;F组:PmirGLO BCL2L2-MUT+阴性对照(NC)。
转染体系的配制:以A组为例,取无RNA酶1.5 mL EP管3个,分别标记为A1、A2和A3,在A1管中加入98 μL DMEM无血清培养基和1 μL PmirGLO空载体(0.45 μg/mL),A2中加入98.2 μL DMEM无血清培养基1.8 μL脂质体2000,A3中加入95 μL无血清培养基10 μL Oar-mir-10b类似物,各管混匀后冰上静置5 min。分别在A2管中取50 μL混合液加入A1和A3,混匀后室温静置5 min。将A1和A3混匀,室温静置10 min。同理配制其他组溶液。在无菌条件下,将各组混合液吸取100 μL分别加入96孔板对应组内,置于37℃、5% CO2培养箱培养24 h后进行荧光检测。
1.2.6 统计学分析 应用统计学分析软件Prism 5对各组的双荧光素酶活性比值进行分析,并用One-way ANOVA进行组内的差异性分析,而组间则用Student′s t检验进行分析。*代表P<0.05,**代表P<0.01。
2 结果
2.1 外参cel-miR-39基因检测及oar-miR-10b在病毒感染不同时段的动态表达分析
从cel-miR-39的溶解曲线和标准曲线以及miR-10b的溶解曲线可知,两种引物都具有较高的特异性。分别在绵羊痘病毒感染绵羊睾丸细胞后0 h、4 h、24 h、48 h和72h对外泌体中的oar-miR-10b进行实时荧光定量PCR检测。结果表明,在绵羊痘病毒感染的不同时期,外泌体中的oar-miR-10b呈现不同的差异表达,主要为先增加后减少的趋势,在感染后24 h的差异表达量最大,达到2.15倍(图2),随后逐步降低。感染4 h后的实时荧光定量PCR结果与高通量测序结果分析表明,miR-10b的变化情况基本一致。
2.2 BCL2L2 RT-PCR扩增
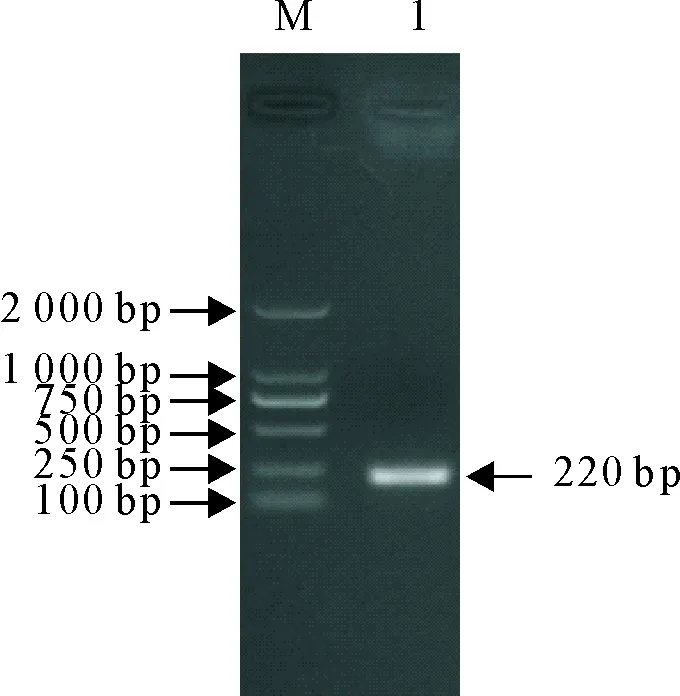
对提取的细胞总RNA进行RT-PCR扩增后,将所得产物经10 g/L琼脂糖凝胶电泳检测,结果显示目的条带大小在220 bp左右,与预期目的条带大小一致(图3)。
2.3 pMD-18-T-BCL2L2-WT、PmirGLO-BCL2L2-WT、PmirGLO-BCL2L2-MUT重组质粒的鉴定
根据DNA纯化试剂盒说明书将目的片段回收纯化后,与pMD-18-T载体进行过夜连接。将连接产物转化至DH5α中并挑取单克隆菌株进行摇菌培养。菌液PCR检测获得目的条带后小提质粒并进行SacⅠ和XhoⅠ双酶切鉴定,琼脂糖凝胶电泳结果显示,酶切获得的目的条带与预期大小一致,分别为2700 bp和220 bp左右(图4A),测序结果与预期碱基序列完全一致。将提取的pMD-18-T-BCL2L2-WT阳性重组质粒进行双酶切后,用DNA回收试剂盒回收220 bp左右的目的条带并与PmirGLO载体进行连接,转化至DH5α后进行抗性筛选,挑取单克隆菌株并进行摇菌培养。用DNA小提质粒试剂盒提取重组质粒并进行SacⅠ、XhoⅠ双酶切鉴定,酶切条带大小与预期一致,分别为7360 bp和220 bp左右(图4B)。将人工合成的BCL2L2-MUT与PmirGLO空载体进行SacⅠ、XhoⅠ双酶切,产物回收后用T4连接酶过夜连接、转化和摇菌培养。提取质粒并进行酶切鉴定,检测结果显示目的条带与预期大小一致,分别为7 360 bp和230 bp左右(图4C)。
A.cel-miR-39的实时定量;B.cel-miR-39的原始荧光值;C.cel-miR-39的溶解曲线;D.cel-miR-39的RT-qRCR标准曲线;E.Oar-miR-10b的实时定量;F.oar-miR-10b的原始荧光值;G.oar-miR-10b 的溶解曲线;H.oar-miR-10b在不同感染时期的表达量
A.Real-time quantification of cel-miR-39; B.The original fluorescence value of cel-miR-39; C.Dissolution curve of cel-miR-39; D.RT-qRCR standard curve for cel-miR-39; E.Real-time quantification of oar-miR-10b; F.The original fluorescence value of oar-miR-10b; G.Dissolution curve of oar-miR-10b; H.Oar-miR-10b expression at different stages of infection
图2 Oar-miR-10b实时荧光定量PCR扩增
Fig.2 Real-time qPCR amplification of oar-miR-10b
M.DNA标准DL 2 000;1.BCL2L2基因片段M.DNA Marker DL 2 000; 1.BCL2L2 gene fragment
2.4 Dual-PmirGLO报告载体基因荧光强度检测
分别将构建好的PmirGLO-BCL2L2-MUT和PmirGLO-BCL2L2-WT重组质粒与Oar-miR-10b mimic和miRNA Negative control根据分组共转染293FT细胞中,其作用位点见图5,转染24 h后进行Dual-PmirGLO报告载体基因荧光检测。检测结果表明,PmirGLO-BCL2L2-WT和oar-miR-10b mimic共转染组与PmirGLO-BCL2L2-WT+miRNA Negative Control共转染对照组相比差异极显著(P<0.01),其检测到的相对荧光强度值下降至对照组的0.58倍(图6),而PmirGLO-BCL2L2-MUT和 oar-miR-10b mimic共转染组与对照组相比差异不显著(P>0.05),表明oar-miR-10b可以显著抑制BCL2L2基因的表达,同时也说明BCL2L2是oar-miR-10b的靶基因,其转录后的翻译受oar-miR-10b的调控。

A.pMD-18-T-BCL2L2-WT重组载体双酶切鉴定的凝胶电泳图;M.DNA标准DL 5 000;1.pMD-18-T-BCL2L2-WT双酶切;B.PmirGLO-PmirGLO-BCL2L2-WT双酶切鉴定的凝胶电泳图;M.DNA标准DL 15 000;1.PmirGLO-BCL2L2-WT双酶切;C.PmirGLO-BCL2L2-MUT双酶切鉴定的凝胶电泳图;M.DNA标准DL 15 000;1.PmirGLO-BCL2L2-MUT双酶切
A.Agarose gel electrophoresis analysis of restriction enzyme digestion of recombinant plasmid pMD-18-T-BCL2L2-WT bySacⅠ andXhoⅠ; M.DNA Marker DL 5 000; 1.Double enzyme digestion of pMD-18-T-BCL2L2-WT;B.Agarose gel electrophoresis analysis of restriction enzyme digestion of recombinant plasmid PmirGLO-PmirGLO-BCL2L2-WT bySacⅠ andXhoⅠ; M.DNA Marker DL 15 000; 1.Double enzyme digestion of PmirGLO-BCL2L2-WT;C.Agarose gel electrophoresis analysis of restriction enzyme digestion of recombinant plasmid PmirGLO-BCL2L2-MUT bySacⅠ andXhoⅠ;M.DNA Marker DL 15 000; 1.Double enzyme digestion of PmirGLO-BCL2L2-MUT
图4重组质粒的双酶切鉴定
Fig.4 Identification of recombinant plasmids by double enzyme digestion
图5 oar-miR-10b靶向BCL2L2的作用关系
3 讨论
miRNA是一类长度为19 nt~23 nt的保守核苷酸序列,其可通过结合到靶基因的mRNA上,在转录后水平调控基因的表达,对增殖、分化、凋亡等基本细胞过程具有重要的调控作用。miR-10b作为miRNAs家族中的一员,目前对其的研究多集中于同肿瘤之间的关系。如已有研究证实,在食管癌[6]、胰腺癌[7]和鼻咽癌[8]等肿瘤组织中都有异常表达,主要为miR-10b的上调,并且这种异常与肿瘤的侵袭性和远处转移密切相关[9]。另有研究表明,抑制miR-10b,降低了T-bet mRNA、RORyt mRNA表达水平,同时也降低了IFN-γ和IL-17表达水平,这说明了抑制miR-10b表达减弱了TH1和TH17细胞诱导的炎症反应[12]。由此可见,miR-10b的上调可以诱导细胞癌变,甚至增强肿瘤侵袭和转移,而下调则会引起宿主细胞的炎症反应。

“WT ”为野生株;“MUT”为突变株
“WT ”wild strain;“MUT”mutant strain
图6 Oar-miR-10b直接靶向重组载体
PmirGLO-BCL2L2的3′UTR
Fig.6 Direct targeting of BCL2L2 3′UTR by oar-miR-10b
with recombination of PmirGLO vector
探究miRNA的作用机制,关键是认识miRNA与其靶基因的相互作用关系。本研究中,通过生物信息学软件预测并结合靶基因功能分析,筛选出与细胞凋亡过程密切相关的BCL2L2作为miR-10b的候选靶基因。BCL2L2也称为Bcl-w,是BCL-2蛋白家族的成员,该家族蛋白为一类凋亡过程中重要的调控因子,包含抗凋亡蛋白(BCL-2、BCL-XL、BCL-W、MCL-1、CED9等)和促凋亡蛋白(Bax、Bak、BCL-XS、Bad、Bik、Bid等)[13]。大量研究证实,BCL2L2为原癌基因,具有抑制细胞凋亡的功能,BCL2L2由于与促凋亡成员相互拮抗作用以及它们之间作用的不平衡竞争状态导致对细胞产生不同的影响,当BCL2L2在二聚体中占据优势时可以抑制细胞凋亡起到促进细胞生长的作用[14]。
病毒感染宿主细胞后往往会导致两种结果:一是通过直接诱导宿主细胞启动细胞凋亡机制以限制病毒生长;二是由于病毒蛋白或病毒感染诱导细胞蛋白抑制细胞凋亡,从而为病毒的繁殖、潜伏感染和后续的持续感染创造条件[15]。有研究已报道,PEDV[10]、EBV[16]和HCMV等病毒感染宿主细胞后会上调BCL2家族基因,进而阻断P53诱导细胞凋亡机制[17]。本研究用双荧光素酶报告载体鉴定BCL2L2与oar-miR-10b的关系,研究结果表明,PmirGLO-BCL2L2-WT+oar-miR-10b mimic共转染组与PmirGLO-BCL2L2-WT+miRNA Negative Control共转染对照组相比差异极显著,初步鉴定出BCL2L2为oar-miR-10b的靶基因,试验结果提示上调的BCL2L2基因可能在绵羊痘病毒感染过程中起着重要作用,这为羊痘病毒感染后的繁殖、调控等机理研究提供了理论基础。

