鸭源H6N6亚型禽流感病毒贵州株NA基因序列分析
万 润,华 敏,龙立书,贺欣薇,张明洋,周碧君,2,王开功,2,程振涛,2,文 明,2*
(1.贵州大学动物科学学院,贵州贵阳 550025;2.贵州省动物疫病研究室,贵州贵阳 550025)
禽流感(Avian influenza,AI)是由A型流感病毒(Avian influenza virus,AIV)引起家禽和野生鸟类等发生感染死亡的一种急性高度接触性传染病[1]。由于AI对养禽业造成严重的经济损失,世界动物卫生组织(OIE)将其列为必须报告的传染病。AIV属于A型流感病毒,依据其外膜血凝素(HA)和神经氨酸酶(NA)蛋白抗原性的不同,可分为18个H亚型(H1~H18)和11个N亚型(N1~N11),其组合可以产生众多亚型[2-3]。除H17N10和H18N11亚型分离自蝙蝠,目前已知的各亚型流感病毒均可在禽类中分离得到[4]。
目前,我国N6亚型AIV具有较高的分离率。2007年-2015年,我国江苏、云南、上海等地在饲养鸡中检测到H4N6亚型AIV[5-7];2009年-2014年,广西、湖南、贵州等地在饲养鸭中检测到H6N6亚型AIV[8-10]。2014年5月,四川省南充市发现全球第1例人感染H5N6亚型AIV并致死病例,随后在浙江、广东也出现了人感染H5N6 AIV病例,H5N6亚型AIV开始成为人感染病例的主流[11-12]。毕玉海等[13]研究发现H5N6亚型AIV毒株中的NA基因多来源于H6N6亚型AIV。因此,开展N6亚型AIV流行毒株N6基因遗传变异分析对H5N6亚型AIV感染的防控具有重要意义。本试验对H6N6亚型AIV贵州株N6基因进行克隆和序列分析,以期为禽流感分子流行病学研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 毒株 H6N6亚型AIV贵州株4株分别为A/duck/Guizhou/01/2017(H6N6)(GenBank №MG43499)、A/duck/Guizhou/02/2017(H6N6)(GenBank №MG434500)、A/duck/Guizhou/03/2017(H6N6)(GenBank №MG434501)和A/duck/Guizhou/04/2017(H6N6)(GenBank №MG434502);阳性对照H6N6亚型AIV毒株A/duck/Guizhou/013/2014(H6N6)(GenBank №KU76236),均为贵州大学动物疫病研究所分离鉴定并保存。
1.1.2 主要试剂 PM19-T Vector、限制性内切酶EcorⅠ和HindⅢ、琼脂糖、2xTaqPCR Mix、DNA Marker DL 2 000、Marker DL 5 000、DH5α感受态细胞、反转录试剂盒、RNA提取试剂盒等,为宝生物工程(大连)有限公司产品;DNA凝胶回收纯化试剂盒、质粒DNA提取试剂盒等,为OMEGA公司产品。
1.2 方法
1.2.1 引物设计 参照GenBank上AIV N6基因序列(登录号为KJ484613),设计N6基因特异性引物(N6-F:5′-GCCGGAATTCATGAATCCAAATCAAAAGATAAC-3′(EcoRⅠ)和N6-R:5′-GGCCGAAGCTTCTACTTAAAGTAGATGATTTCA- GC-3′(HindⅢ),引物预期扩增片段大小为1 413 bp,由上海英淮捷基有限公司合成。
1.2.2 目的基因PCR扩增 采用鸭胚增殖病毒后,收集鸭胚尿囊液,RNA提取试剂盒提取病毒RNA,反转录成cDNA,N基因引物进行PCR扩增。扩增体系为50 μL:ddH2O 19 μL、2×TaqPCR Mastermix 25 μL、N6-F/N6-R各2 μL和模板DNA 2 mL;反应条件:94℃ 5 min;94℃ 40 s、56℃ 50 s,72℃ 2 min,35个循环;最后72℃ 10 min。同时以A/duck/Guizhou/013/2014(H6N6)毒株和ddH2O作为阳性及阴性对照。取9 μL样品PCR产物经12 g/L琼脂糖凝胶电泳检测,观察结果。
1.2.3 目的基因克隆测序 采用DNA凝胶回收试剂盒回收目的片段,加Solution Ⅰ连接酶,与pMD19-T载体连接过夜,转化DH5α感受态细胞,菌落蓝白斑筛选;挑取白色菌落接种在含Amp+的LB液体培养基,37℃振荡培养12 h,提取质粒进行双酶切鉴定;取阳性重组质粒送至上海Invitrogen公司测序。
1.2.4 目的基因序列分析 取测序得到的目的基因序列,与GenBank中AIV代表株NA基因序列(表1)进行BLAST分析和系统发生树绘制,分析目的基因遗传进化情况。

表1 GenBank中NA基因参考株序列信息
2 结果
2.1 目的基因PCR扩增结果
用AIV N6基因特异性引物进行PCR扩增,12 g/L琼脂糖凝胶电泳,发现4株毒株样本均可得到一条约为1 380 bp的目的条段(图1),与预期扩增片段大小相一致,说明本试验成功扩增出H6N6亚型AIV贵州株N6基因。
2.2 目的基因克隆和测序
取阳性重组质粒进行EcoRⅠ和Hind Ⅲ双酶切,12 g/L琼脂糖凝胶电泳,发现有约为2 700 bp的载体条段和约为1 380 bp的目的条段,与预期酶切片段大小相一致,说明本试验成功构建了H6N6亚型AIV贵州株N6基因重组质粒。
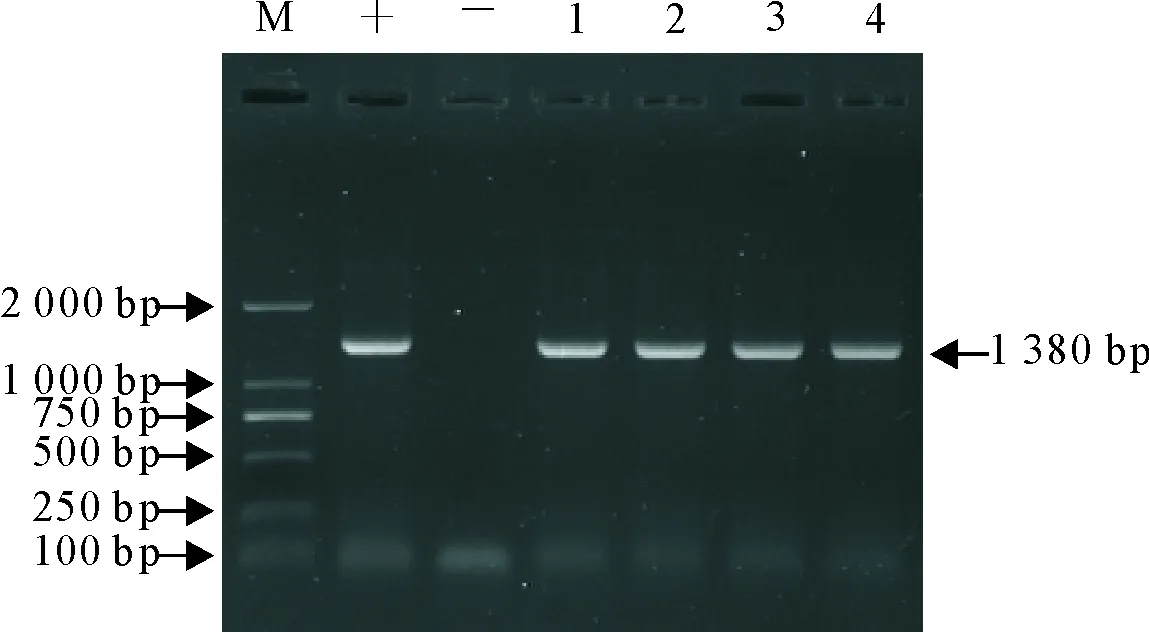
M.DNA标准DL 2 000;1~4.NA基因PCR扩增产物;+.阳性;-.阴性
M.DNA Marker DL 2 000;1-4.NA gene PCR amplification products;+.Positive;-.Negative control
图1 NA基因PCR扩增产物电泳图
Fig.1 PCR products of NA genes
2.3 AIV贵州株N6基因同源性分析
经同源性分析显示,4株H6N6亚型AIV贵州株N6基因间的同源性为96.0%~99.1%,与2007年H6N6亚型AIV贵州株同源性仅为87.0%,与2014年H6N6AIV贵州株同源性为93.0%。4株AIV贵州株N6基因与江西H10N6毒株和越南H5N6毒株的同源性在97%以上,其中A/duck/Guizhou/01/2017(H6N6)与江西H10N6毒株同源性最高(97.7%),与越南H5N6毒株同源性为97.5%;A/duck/Guizhou/02/2017(H6N6)与越南H5N6毒株同源性为98.5%,与江西H10N6毒株同源性为98.2%;而A/duck/Guizhou/03/2017(H6N6)和A/duck/Guizhou/04/2017(H6N6)与日本H5N6毒株同源性达99.0%,与越南H5N6毒株和江西H10N6毒株同源性为达97.0%。除上述N6基因外,4株H6N6亚型AIV贵州株N6基因与其他亚型毒株N6基因同源性在88%左右,与其他AIV毒株非N6基因的同源性均低于60%。
2.4 AIV贵州株N6基因遗传进化分析
系统进化树分析显示,4株H6N6亚型AIV贵州株N6基因在遗传进化树上处于同一大分支(图2),表明4株H6N6亚型AIV贵州株同源关系比较接近,其中A/duck/Guizhou/03/2017(H6N6)和A/duck/Guizhou/04/2017(H6N6)与日本H5N6毒株和韩国H5N6毒株处于同一分支上;而A/duck/Guizhou/01/2017(H6N6)和A/duck/ Guizhou/02/2017(H6N6)与越南N5N6毒株、云南H5N6毒株、江西H10N6毒株和湖南H3N6毒株处于一分支上。从进化树整体看,所有N6亚型毒株与其他非N6亚型毒株明显位于2个分支上。
2.5 AIV贵州株N6基因编码蛋白变异分析结果
经对N6基因编码蛋白氨基酸序列比对分析发现,4株H6N6亚型AIV贵州株N6基因均可编码459个氨基酸,其中398处位点氨基酸序列与日本H5N6毒株、越南H5N6毒株、韩国H5N6毒株、江西H10N6毒株、湖南H3N6毒株和云南H5N6毒株的N6基因编码区相应序列一致。选取同源性较高的N6毒株与4株H6N6亚型AIV贵州株进行蛋白变异分析(图3),发现4株H6N6亚型AIV贵州株N6基因编码蛋白在第53-63位出现11个氨基酸缺失,感染人毒株的N6基因编码蛋白除在上述位置缺失11个aa外,在第2-23位aa还缺失22个氨基酸。
3 讨论
禽流感病毒神经氨酸酶(NA)在病毒感染过程中发挥双重功能,一方面对A、B型流感病毒的复制起重要作用;另一方面它可酶切去掉易感细胞表面的唾液酸受体,使细胞免受禽流感病毒的感染,也正是这一功能让NA成为抗禽流感研究中的活跃领域[14]。在已知流感病毒亚型中,NA有着相似的空间结构和功能结构域,但其茎部区长度变化较大。这种改变是由于发生插入或缺失造成,通常是3个或者3倍数个核苷酸的插入或缺失,而这些缺失可能改变AIV的宿主特异性及毒力[15-16]。本试验于2017年收集的4株H6N6亚型AIV贵州株,其NA基因茎部区缺失33个(175-207)核苷酸,这一结果与万春和等[15]研究的H6N6基因(GenBank:GU595163)分析结果一致,而这一缺失是否导致其宿主特异性及毒力发生改变,有待进一步考究。进行编码蛋白变异分析结果发现,对AIV贵州株N6基因与同源性较高的几株毒株N6基因均在编码蛋白第53-63 aa出现11个氨基酸缺失,但A/duck/Guizhou/1128/2007(H6N6)、A/duck/Guizhou/013/2014(H6N6)这两株病毒并未发生缺失,2014年H6N6 AIV贵州株的N6基因编码蛋白第55位由S变为了P,从2014年1个氨基酸的变异到11个氨基酸的缺失,可见NAJ基因的进化相对还是比较快,这可能与AIV的不断变异和重组有关,也可能与宿主对外界变化的适应性相关。4株H6N6亚型AIV贵州株N6基因与H3N6毒株、H5N6毒株和H10N6毒株N6基因处于同一分支上,这些贵州株N6基因是该毒株NA基因发生点突变所致还是与其他毒株N6基因发生重组而来,也有待进一步研究。
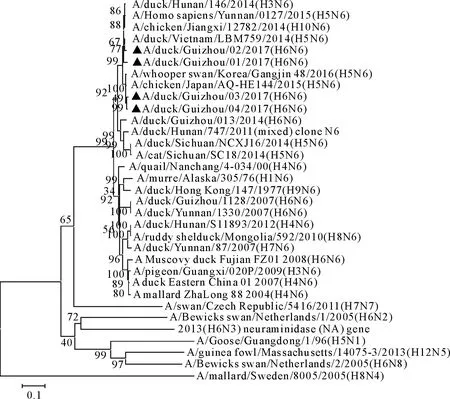
图2 NA基因核苷酸序列系统进化树

图3 NA基因氨基酸序列变异位点分析
近年来,N6亚型禽流感病毒毒株在我国呈流行规模逐渐扩大化且宿主范围多样性。但到目前为止,N6亚型AIV并没有引起人们的关注。自2007年以来,以H6N6亚型AIV的分离率较高,最早分离于鸭,后陆续在鸡、鹅体内检出[17-18]。2012年我国华南地区首次从猪分离到H6N6亚型AIV[19-20],提示N6亚型毒株可能具有突破种间屏障获得感染哺乳动物的能力。2014年四川省南充市首次发现一例人感染H5N6亚型AIV并致死病例,其NA基因来源于H6N6亚型AIV。同年12月,广东也发现一例人感染H5N6亚型AIV病例,其NA基因同样来源于H6N6亚型AIV[13]。本试验发现贵州株A/duck/Guizhou/03/2017(H6N6)和A/duck/Guizhou/04/2017(H6N6)的N6基因与韩国及日本H5N6毒株处于同一分支上,提示N6亚型AIV可能与H5亚型AIV发生自然重组,并可能在不断进化过程中突破种间屏障而获得感染人的能力。贵州株A/duck/ Guizhou/01/2017(H6N6)和A/duck/Guizhou/02/2017(H6N6)与江西H10N6及湖南H3N6毒株处于同一分支上,提示N6亚型AIV业可能与H10及H3亚型AIV发生自然重组。因此,有必要加强N6亚型AIV监测,关注N6亚型AIV变异趋势,才能做好禽流感防控工作。

