sFRP4基因在肉鸡胫骨软骨发育不良中的表达及生物信息学分析
王春霞,喻 进,卢晓晓,宁官保,张 鼎,马海利,高文伟,高诗敏,李建慧,李桂兰,闫 芳,赵宇军*,田文霞*
(1.山西农业大学动物科技学院,山西太谷 030801)
胫骨软骨发育不良(Tibial dyschondroplasia,TD)是家禽胫跗骨近端生长板形成不能矿化及血管化的软骨栓,从而导致站立困难及运动障碍的群发性疾病[1-2]。该病导致肉鸡抗病性能下降和生产性能降低,从而给养禽业造成巨大损失,因此对其发病机理的研究成为当前研究热点之一。为了探究TD的发病机制,田文霞等[3-5]通过使用福美双诱发TD,发病率高,稳定性好,病理变化与正常发病一致,由此成功构建肉鸡TD模型,为深入研究TD发病机理提供可靠、充足的试验基础。基于福美双诱发的TD模型,Tian等[6]应用抑制性消减杂交技术(SSH)结合cDNA芯片筛选差异表达基因发现,在TD发生过程中,sFRP4基因表达上调,同时,Tian等[7]后续通过Affymetrix芯片筛选不同发育阶段差异表达基因发现,sFRP4基因也表达上调,并在诱导TD后第1、2、6天分别上调高达2.8、73.5、11.6倍,这正好验证了前期应用SSH筛选中的基因差异表达结果。
作为sFRP家族蛋白成员之一,分泌型卷曲相关蛋白4(secreted frizzled-related protein 4,sFRP4)是Wnt信号通路的拮抗剂。Wnt信号通路控制着如细胞凋亡、细胞增殖以及干细胞和祖细胞的自我更新等多种过程[8]。除此之外,Wnt信号通路与软骨内骨化的发生有着密切的关系[9]。Tamamura等[10]研究认为Wnt/β-Catenin信号通路对生长板形成、调节软骨细胞成熟以及软骨内骨化都有着至关重要的作用。Kerkhofs等[11]和Andrade等[12]同样证明Wnt信号通路参与调控软骨内骨化。体外研究表明Wnt信号通路与软骨细胞的成熟高度相关,而且活化的β-Catenin与TCF/LEF转录因子可加快软骨细胞分化[13],并促进软骨内骨化[14]。体内研究也表明激活的Wnt信号通路可促进软骨细胞肥大及成熟[15]。sFRP家族蛋白通过与Frizzled(Fz)蛋白竞争性结合Wnt蛋白,发挥抑制Wnt信号通路的生物学作用,同时间接影响与Wnt通路相交联的其他信号通路。Wang等[16]研究证实sFRP1能通过Wnt信号通路调节由糖皮质激素诱导的骨质疏松,可见sFRP家族蛋白对Wnt信号通路有一定的影响。因而研究和分析sFRP4基因及其蛋白的特性与信息,对后续研究Wnt信号通路与TD发病机理之间的关系有着重大意义。
本研究通过real-time PCR对基因芯片筛选的sFRP4基因差异表达结果进行验证,并对sFRP4基因及其预测蛋白进行相关生物信息学分析,为后续的进一步研究提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 组织样品 肉鸡(艾维茵)胫骨软骨生长板组织(福美双诱导TD后第1、2、6天),样品获得见文献[17],由山西农业大学国家动物医学示范中心生物制品实验室提供。
1.1.2 主要试剂 Trizol Reagent,Invitrogen公司产品;SYBR®Green Realtime PCR Master Mix,Toyobo公司产品,TaqDNA聚合酶、dNTP、DNase-I,武汉晶美生物工程有限公司产品。
1.2 方法
1.2.1 引物的设计与合成 所用引物根据NCBI数据库中Gallus的sFRP4基因的序列作模板,用Primer Premier 5.0软件进行引物设计。序列为上游引物5′GCTGAATCTATCTGCTGTTGGG3′,下游引物5′CTAACACTGTAAGCATATTCCTGGC3′,扩增片段136bp;内参基因RPS16引物序列的上游引物5′ACAAACTGCTTGAACCTGTCCTC3′,下游引物5′GCTTTGGAAATAGCTTGACGG3′,扩增片段127bp。引物由上海捷瑞生物工程有限公司合成。
1.2.2 生长板总RNA的提取与质量检测 取本实验室保存的生长板样品,按照Trizol试剂盒操作步骤提取总RNA,并通过琼脂糖凝胶电泳和核酸测定仪检测总RNA质量和浓度,置-70℃保存备用。
1.2.3 Real-time PCR验证差异表达基因 用上述合成的引物进行real-time PCR的扩增体系(总体积25 μL):cDNA 1 μL,SYBR®Green Realtime PCR Master Mix 12.5 μL,上、下游引物各0.5 μmol/L,灭菌水补足体系。反应条件为:95℃ 3 min;94℃ 20 s,60℃ 30 s,72℃ 20 s,40个循环。
1.2.4 Real-time PCR数据分析 以各对照组为参照,使用2-△△Ct法计算sFRP4在各组中的相对表达量,取攻毒组与对照组的差异倍数均值。
1.2.5 鸡生长板sFRP4基因的生物信息学分析 通过NCBI中Gene数据库获得sFRP4基因定位及组成等信息,同时采用在线ORF Finder(http://www.ncbi.nlm.nih.gov/)分析该基因。经ProtParam程序(http://web.expasy.org/protparam/)分析蛋白理化性质,经ProScale程序(http://web.expasy.org/protscale/)分析蛋白疏水性,经DictyOGlyc 1.1(http://www.cbs.dtu.dk/services/DictyOGlyc/)进行蛋白糖基化位点分析,经NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸化位点分析,经Signal-4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,经TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白的跨膜区,经PROSITE程序(http://prosite.expasy.org/)分析蛋白结构域,同时应用PredictProtein(http://www.predictprotein.org/)与SOPMA(http://npsa-pbil.ibcp.fr)对蛋白二级结构进行预测。运行SWISS-model(http://swissmodel.expasy.org/interactive)预测蛋白三级结构,最后通过STRING(http://string-db.org/),限定相关蛋白数,自动构建与sFRP4蛋白相互作用的蛋白网络。
2 结果
2.1 Real-time PCR验证sFRP4的差异表达
用real-time PCR技术对芯片结果中的表达差异基因sFRP4进行检测,real-time PCR获得的基因差异表达结果与基因芯片中结果基本一致,在第1、2、6天均为上调表达,将两者表达信息对比(图1)。

图1 实时定量PCR与微阵列结果的比较
2.2 鸡sFRP4基因结构信息
sFRP4基因位于2号染色体46 736 104~46 746 404之间,基因全长10 300 bp,外显子有6个,mRNA全长2 847 bp,通过ORF Finder分析得到一个993 bp的开放阅读框,推测编码331个氨基酸。
2.3 鸡sFRP4蛋白基本理化性质
理论分子质量为37 704.7 u,理论等电点为9.50,负电荷氨基酸残基(天冬氨酸+谷氨酸)30个,正电荷氨基酸残基(精氨酸+赖氨酸)53个,原子组成为C1638H2663N489O477S27,原子总数为5 294。N端第1个氨基酸是蛋氨酸,蛋白不稳定系数为63.13(大于40认为该蛋白质不稳定),脂肪系数为73.63,平均亲水性为-0.582。含强酸性氨基酸(D、E)31个,占总氨基酸9.3%,强碱性氨基酸(K、R)54个,占16.2%,极性氨基酸(N、C、Q、S、T、Y)103个,占30.9%,疏水氨基酸(A、I、L、F、W、V)71个,占21.3%(图2)。

图2 各氨基酸组成百分比
2.4 鸡sFRP4蛋白疏水性分析
经分析,sFRP4的最大疏水指数为2.5,最小疏水指数为-2.95。根据指数越小,亲水性越强的规律来看,从图中可以看出亲水性氨基酸均匀分布于整条多肽链,且多于疏水性氨基酸,推测该蛋白为可溶性蛋白(图3)。
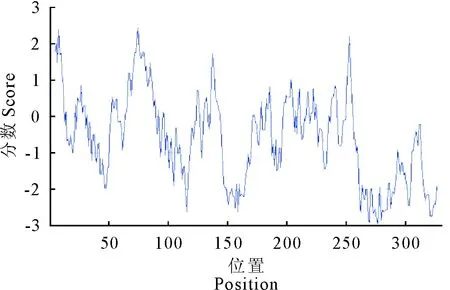
图3 sFRP4蛋白质疏水性分析
2.5 鸡sFRP4蛋白糖基化位点分析
糖基化是蛋白质翻译后修饰的方式之一,经过分析预测,O-糖基化位点只有1个(图4)。
2.6 鸡sFRP4蛋白磷酸化位点分析
蛋白质磷酸化主要发生在苏氨酸(Thr)、丝氨酸(Ser)与酪氨酸(Tyr)3种主要磷酸化部位。经分析,该蛋白磷酸化位点共13个,其中Ser11,Thr1,Tyr1(图5)。
2.7 信号肽分析
信号肽一般位于分泌蛋白的N端,当蛋白发生跨膜转移后被切掉。运行Signal P 4.1分析预测,会出现4个分值:Y-score maximum指预测的真实的信号肽切割位点得分;C-score maximum指可能的信号肽切割位点得分;S-score maximum指信号肽组成的可能的大小得分;S-score mean指S-score的平均得分。一般认为S-score mean>0.5,则预测为分泌性蛋白,存在信号肽。经过分析,C值0.728,Y值0.729,S值0.864,S平均值0.729,大于0.5,剪切位点位于20与21残基之间,推测sFRP4蛋白有信号肽(图6)。
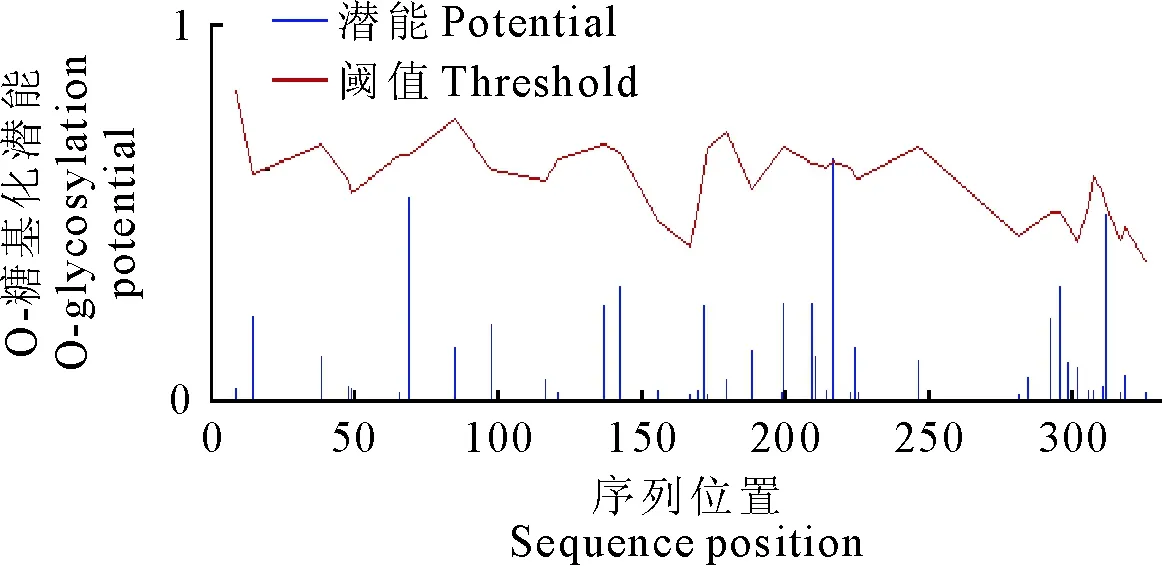
图4 sFRP4蛋白的糖基化位点分析

图5 sFRP4蛋白磷酸化位点分析
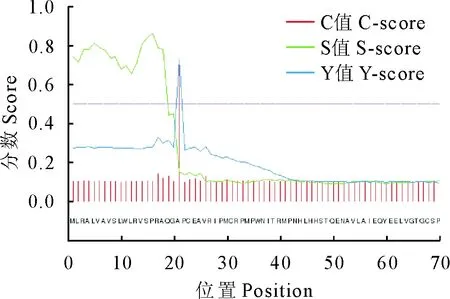
图6 sFRP4蛋白信号肽的预测
2.8 跨膜区分析
TMHMM Server 2.0程序采用隐马氏模型,分析综合了电荷偏离、膜蛋白拓扑学限制和螺旋长度、跨膜区疏水性等特征,并结合统计学方法对膜内外及跨膜区进行整体预测。预测显示sFRP4蛋白无跨膜区,整个蛋白都位于膜外(图7)。
2.9 二级结构预测
经SPOMAN分析显示,α螺旋占27.19%,延伸链占13.60%,无规则卷曲占58.01%,β转角占1.21%。推测α螺旋与无规则卷曲是sFRP4蛋白主要的二级结构原件,延伸链与β转角则散在于整个蛋白(图8)。

图7 sFRP4蛋白跨膜区的预测

h.α螺旋;c.无规则卷曲;t.β转角;e.β折叠延伸链h.Alpha helix; c.Random coil; t.Beta turn; e.Beta sheet extended strand
2.10 三级结构预测
运行SWISS-model程序,以sFRP3蛋白为模板同源建模,可见α螺旋与无规则卷曲为sFRP4蛋白三级结构主要原件(图9)。
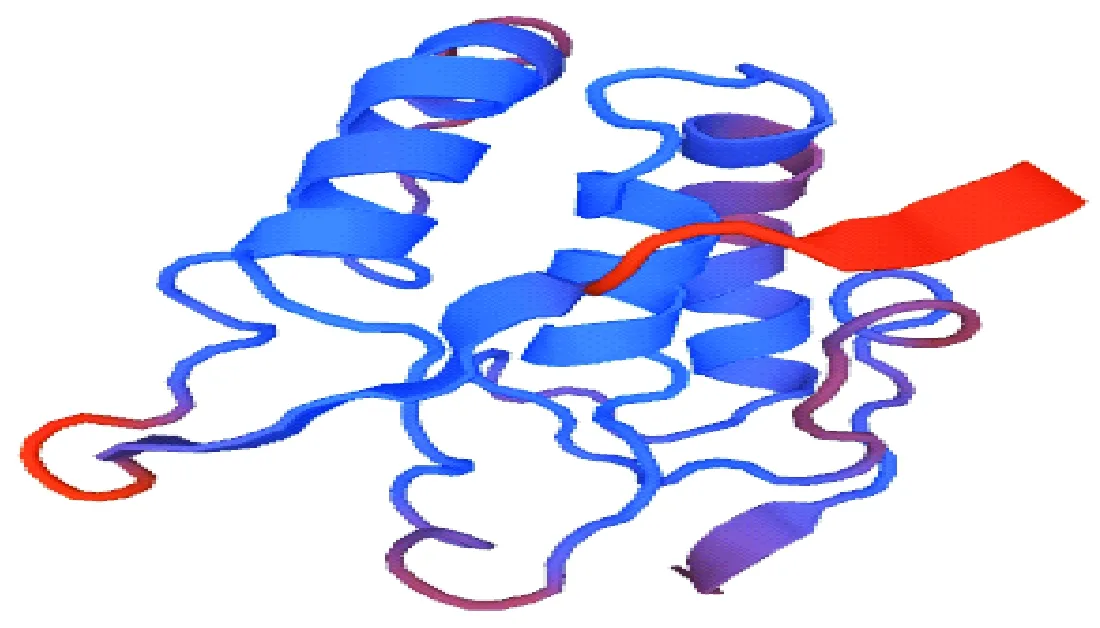
图9 sFRP4蛋白三级结构的预测
2.11 sFRP4蛋白结构域分析
经ScanPtosite程序分析,蛋白质有FZ和NTR两个保守结构域(访问号分别为PS50038,PS50189)(图10)。

图10 sFRP4蛋白质结构域分析
Fz结构域由120个氨基酸组成,由于包含了10个非常保守的半胱氨酸,也叫做CRD(cysteines-rich domine)。Fz结构域的晶体结构显示主要为α螺旋,此外还有β折叠,保守的半胱氨酸形成二硫键。Fz结构域是与Wnt相互作用的部位,对于Wnt配体的结合是必要的。NTR结构域由130个氨基酸组成,共包含6个保守的半胱氨酸,可能在内部形成二硫键。通过该程序对sFRP家族蛋白(sFRP1、sFRP2、sFRP3、sFRP5)进行分析,显示均含有Fz与NTR结构域。
2.12 蛋白相互作用网络
经STRING分析,默认搜索与sFRP4蛋白相关的蛋白限制在10个之内,构建蛋白之间的相互作用网络。分析显示sFRP4蛋白与Fz蛋白竞争性结合Wnt蛋白,结果见图11。

图11 sFRP4蛋白与其相关蛋白相互作用网络
3 讨论
Wnt信号通路在各组织的发育与内稳态中起着至关重要的作用,已经证实软骨形成和软骨内骨化与此通路有很大关系[18]。本课题组应用基因芯片筛选TD发育不同时期差异表达基因发现,sFRP4基因差异表达显著,而sFRP4是Wnt信号通路的拮抗剂,这表明sFRP4可能通过Wnt信号通路从而影响TD的发生与发展。但是,sFRP4通过Wnt信号通路是否是主要影响TD的原因,或者是通过与之交联的其他信号通路发挥作用,这些都还不得而知,并且国内外关于sFRP4的研究鲜见于报告,因而在深入分子水平具体研究之前,sFRP4基因及其蛋白的生物信息学分析是很有必要的。
本研究应用real-time-PCR技术对基因芯片筛选的结果进行验证,结果表明两者变化趋势一致,结论相互印证,说明了基因芯片的可靠性,同时也表明了sFRP4基因差异表达的保真性,为后续研究提供了可靠的数据和理论支撑。sFRP4基因的生物信息学分析显示,其编码331个氨基酸,蛋白平均亲水性-0.582,整条多肽链中亲水性氨基酸多于疏水性氨基酸,表现为亲水性,推测为可溶性蛋白质;通过二级结构、同源建模分析,二级结构主要以α螺旋与无规则卷曲为主。这些都为后续研究如蛋白表达、提纯,以及功能的研究提供有价值的参考。
糖基化是蛋白翻译后的修饰方式之一,总共有四类,其中O-糖基化在高尔基体中进行,以丝氨酸、苏氨酸、羟赖氨酸和羟脯氨酸的羟基为连接点。糖基化的结果使不同的蛋白质带上不同的标记,改变多肽的构象与增加蛋白质的稳定性。分析预测整条多肽链中只有一个糖基化位点,sFRP4蛋白不稳定,可能极少的糖基化位点是该蛋白不稳定的原因之一;同时磷酸化也是蛋白质翻译后的修饰方式,整条多肽链共有13个磷酸化位点,其中大部分位于sFRP4蛋白的两个保守结构域(CRD、NTR)内。研究表明,CRD是Fz蛋白的保守结构域, Wnt蛋白通过CRD结构域与Fz蛋白结合,从而启动Wnt信号通路[19]。sFRP4蛋白具有信号肽,无跨膜区,提示其可能在胞内进行磷酸化等翻译后修饰,随后分泌出胞外,发挥竞争性结合Wnt蛋白的作用,而存在磷酸化位点的CRD保守结构域则是其发挥功能的重要原因。
不同的研究表明,Wnt信号通路对于软骨细胞成熟、肥大,以及骨的形成是不可或缺的[20]。Enomoto等[21]研究表明在鸡发育过程中,Wnt8A过表达可促进软骨细胞成熟、肥大、钙化,同样Wnt9A过表达也会加快软骨细胞的肥大[22]。通过STRING分析蛋白的相互作用网络显示,sFRP4蛋白与Fz蛋白可竞争性结合Wnt3A、Wnt8A、Wnt9A、Wnt10A等蛋白,提示其可能通过竞争性结合Wnt8A等蛋白,从而抑制Wnt信号通路,进而影响正常软骨内骨化。
本研究验证了前期用芯片技术筛选的差异表达基因sFRP4的准确性与可靠性,并对sFRP4基因及其预测蛋白进行了生物信息学分析,为今后研究sFRP4蛋白生物学功能及其参与Wnt信号通路对TD的影响奠定一定的理论基础。

