高产杂交水稻两优培九衰老进程中剑叶差异蛋白质组学分析
王莹慧,孙萌萌,汪育文,吴 敏,陈国祥
(南京师范大学生命科学学院,江苏 南京 210023)
剑叶全展后杂交水稻籽粒灌浆所需干物质的60%以上来自叶片的光合作用[1],但杂交水稻在生育后期存在若干限制性因素,比如功能叶片提前衰老,叶绿体加速降解,光合能力显著降低等,这在一定程度上影响着杂交水稻干物质的积累。因此,深入探究杂交水稻剑叶衰老机制,利用生物技术手段延缓或控制叶片早衰,增强作物在灌浆充实期“源”的积累,改善籽粒充实度,这将对杂交水稻高产潜力的充分发挥具有重要意义[2]。
在水稻叶片衰老研究领域,近些年已经取得了重要进展,但多数研究仅从水稻衰老生理或光合性状等方面开展,从分子生物学层面精准揭示水稻叶片衰老机理的研究并不多见[1,3-4]。随着分子生物学的迅速发展,越来越多的研究者试图从分子水平上探究植物叶片衰老的机制[1,5-7]。本研究借助蛋白质组学分析手段,以超高产杂交水稻两优培九为研究材料,探究水稻剑叶发育过程中的蛋白质表达差异性,从蛋白质水平阐明水稻叶片发育以及衰老的机理,以期为揭示杂交水稻衰老的分子机理提供依据。
1 材料与方法
1.1 材料种植
杂交水稻两优培九于2013年5月中旬种植于南京师范大学仙林校区植物园,常规施肥管理,及时防治病虫害。于8月15日和9月25日,取孕穗期和乳熟期这2个生殖生长关键时期的水稻剑叶进行蛋白质组学分析。
1.2 叶绿素含量的测定
参照Arnon[8]的方法测定剑叶叶绿素含量。
1.3 蛋白质组学分析
1.3.1 蛋白质的提取与浓度测定 采用三氯乙酸-丙酮沉淀法提取水稻剑叶蛋白质。称取1.0 g叶片,加液氮充分研磨成粉末,加入10 ml预冷的三氯乙酸沉淀液(含10.00%三氯乙酸、0.07%巯基乙醇的丙酮溶液)充分混合,-20 ℃放置l h,4 ℃、15 000g离心15 min,取沉淀。加入l0 ml样品洗涤液(含0.07%巯基乙醇的丙酮溶液)悬浮振荡沉淀,-20 ℃静置1 h,4 ℃、15 000g离心15 min,取沉淀并真空干燥成粉末状。以20 ml/g比率加入蛋白质溶解液[7 mol/L尿素、2 mol/L硫脉、4.0% 3-[3-(胆酰胺丙基)二甲氨基]丙磺酸内盐(CHAPS)、1% 二硫苏糖醇(DTT)、0.5%固相pH梯度胶条缓冲液(IPG Buffer pH 4~7,GE Healthcare)溶解样品粉末,振荡混匀,37 ℃温浴l h,室温下15 000g离心l0 min,上清液即为蛋白质提取液。运用Bradford法测定蛋白质浓度,以牛血清蛋白(BSA)(Bio-Rad公司产品)作为蛋白质标准品。
1.3.2 等电聚焦电泳 用pH 3~10、长24 cm的IPG胶条(Bio-Rad公司产品)进行第一向等电聚焦,每个样品均独立重复3次,每次蛋白质上样量为150 μg。聚焦程序为:20 ℃被动水化12 h,250 V线性聚焦30 min,1 000 V快速聚焦1 h,10 000 V线性聚焦5 h,10 000 V 快速聚焦8 h,500 V快速聚焦10 h。等电聚焦完成后,IPG胶条分别在平衡液I [0.375 mol/L Tris-HCl (pH 8.8)、6.000 mol/L尿素、20.0%甘油、2.0% SDS、2.0% DTT]和平衡液II [0.375 mol/L Tris-HCl (pH 8.8)、6.000 mol/L尿素、20.0%甘油、2.0% SDS、2.5%碘乙酰胺]中平衡15 min。在室温下进行12% SDS-PAGE、600 V恒压电泳分离,凝胶用参照Chevallet等[9]的方法进行银染。
1.3.3 凝胶图像处理 用Epson Expression 11000XL扫描仪扫描凝胶,通过PDQuest v7.4(Bio-Rad)软件分析孕穗期和乳熟期蛋白质表达谱的差异,以及差异蛋白质的名称、分子量和等电点。在3次重复中均出现,且丰度变化≥2倍,同时t检验满足P<0.05的蛋白质点作为差异蛋白质点。
1.3.4 胶内酶解 挖取差异蛋白质凝胶置于96孔板中,加入ddH2O超声波清洗5~10 min,加50 μl乙腈脱水至胶粒彻底变白,真空抽干5 min,加入50 μl处理液I [10 mmol/L DTT、25 mmol/L NH4HCO3],56 ℃水浴1 h,冷却至室温,吸干,迅速加入50 μl处理液II [55 mmol/L碘乙酰胺、25 mmol/L NH4HCO3],25 ℃避光45 min,加入25 mmol/L NH4HCO3、50%乙腈洗脱,至胶粒完全变白,真空抽干5 min,每孔加2~3 μl 10 ng/μl胰蛋白酶液(用25 mmol/L NH4HCO3配制),4 ℃静置30 min,吸去剩余酶液,加入10~15 μl 25 mmol/L NH4HCO3覆盖胶粒,37 ℃温浴,过夜(10~14 h),加0.1%三氟乙酸(TFA)以终止酶解反应,振荡离心,用于质谱分析。
1.3.5 质谱分析 使用基质辅助激光解吸电离串联飞行时间质谱分析仪(MALDI-TOF/TOF,型号Ultraflex II)进行肽质量指纹图谱(Peptide mass fingerprint,PMF)鉴定。所得PMF图谱用Flexanalysis 3.0软件处理,肽段检测算法为SNAP算法,信噪比(S/N)、质量因子的域值分别为1.5和50.0,用胰蛋白酶(Porcine trypsin)的自解片段(Trypsin,m/z=842.509 4、2 211.104)作为内参校准。用Matrixscience网站的站内Mascot查找系统对肽质量指纹谱进行数据库检索(http://www.matrixscience.com)。检索要求:误差允许范围(Mass tolerance) 0.01%,可以有1个氨基酸的误切(Miss cleavage),修饰包括半胱氨酸的甲酰化(Carbamidomethyl)和甲硫氨酸的氧化(Methionine oxidation),实验和理论肽质量指纹谱匹配的肽段至少有5个。
1.3.6 生物信息学分析 通过UniProtKB (http://www.uniprot.org)数据库对鉴定的差异蛋白质进行分子功能和细胞定位分析。将鉴定的差异蛋白质通过UniProtKB的Blast功能搜索定位到相应的拟南芥同源基因,并使用GeneMania (http://genemania.org)进行蛋白质网络互作预测。
2 结果与分析
2.1 杂交水稻两优培九剑叶衰老过程中叶绿素含量的变化
叶绿素作为吸收和传递光能的主要功能载体,在叶片衰老过程中逐渐被降解,叶色变黄。两优培九剑叶全展后,叶绿素总含量和叶绿素a/b值均呈现出逐渐下降趋势且下降幅度显著(图1)。由此可见,水稻剑叶全展后叶片逐渐进入衰老状态。
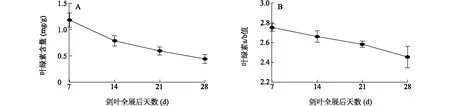
图1 杂交水稻两优培九剑叶全展后叶绿素含量变化Fig.1 Changes of chlorophy II content of flag leaves of hybrid rice Liangyoupeijiu during days after full expansion
2.2 杂交水稻两优培九剑叶衰老过程中蛋白质表达谱的变化
在3张重复试验的等电聚焦电泳凝胶上都可以检测到超过1 000个清晰的蛋白质点(图2)。对孕穗期和乳熟期2个时期的凝胶图像进行对比和解析,共发现78个蛋白质点表达谱存在差异。与孕穗期(剑叶全展后7 d)相比,乳熟期(剑叶全展后28 d)有21个蛋白质点表达量增加,57个蛋白质点表达量下降。
2.3 杂交水稻两优培九剑叶衰老过程中差异表达蛋白质的鉴定和功能分类
经过MALDI-TOF/TOF串联质谱分析,乳熟期剑叶中78个差异表达蛋白质点中53个被成功鉴定,这53个蛋白质点的详细信息列于表1。从表1中发现存在多个蛋白质点鉴定为同一蛋白质的情况,比如核酮糖-1,5-二磷酸羧化/加氧酶激酶(蛋白质点1 132和1 166),核酮糖-1,5-二磷酸羧化/加氧酶激酶活化酶(蛋白质点976和1 101),核糖体蛋白(蛋白质点1 156和1 136)。在其他研究中也有类似的现象[10]。这可能是由蛋白质的降解或者甲基化、磷酸化修饰等原因造成。根据UniProtKB (http://www.uniprot.org/uniprot/)网站上每个蛋白质的注释及其参与的生化途径进行功能分类和亚细胞定位分类[11]。按照其功能,这些蛋白质被归于8类:光合作用(Photosynthesis)18.9%,能量代谢(Eenergy metabolism)3.8%,蛋白质代谢(Protein metabolism)15.1%,脂质代谢(Lipid metabolism)3.8%,碳水化合物及氨基酸代谢(Carbohydrate and amino acid metabolism)3.8%,信号转导(Signal transduction)7.5%,胁迫响应(Stress response)11.3%,未知功能(Unknown function)35.8% (图3-A)。通过亚细胞定位发现,这些蛋白质分别位于叶绿体、线粒体、过氧化物酶体、内质网、高尔基体、液泡、细胞质、细胞核和细胞膜上,但是有32.1%的蛋白质在细胞中的具体位置和分布尚不清楚,除此之外位于叶绿体中的蛋白质数目最多,占30.2% (图3-B)。

A:孕穗期(剑叶全展后7 d);B:乳熟期(剑叶全展后28 d)。图2 杂交水稻两优培九生殖生长关键时期剑叶蛋白质双向电泳图Fig.2 The two-dimensional electrophoresis protein maps of flag leaves of hybrid rice Liangyoupeijiu during the critical periods of reproductive growth
2.4 杂交水稻两优培九剑叶衰老过程中差异蛋白质的表达变化
2.4.1 光合相关蛋白质的表达变化 通过蛋白质组学分析发现,乳熟期剑叶中与光合作用相关的蛋白质整体表达下降(表1)。光反应相关蛋白质CP23蛋白(Chloroplast 2.3×104polypeptide of photosystem II)、放氧复合体蛋白1(Oxygen-evolving complex protein1)、铁氧化还原蛋白-NADP(H)氧化还原酶(Putative ferredoxin-NADP(H) oxidoreductase)、ATP合酶CF1β亚基(ATP synthase CF1 beta subunit,ATPB)和atpB基因编码产物(atpBgene product)的表达下调,碳固定与转化的相关蛋白质RuBisCO酶大小亚基及其前体和RuBisCO活化酶及其小同工型前体的表达也呈现下降趋势。
2.4.2 代谢相关蛋白质的表达变化 植物的生长发育过程伴随着氨基酸、蛋白质、糖类和脂质的代谢。乳熟期剑叶中与细胞代谢相关的蛋白质胼胝质合成酶(GSL11)、半胱氨酸合成酶(OASA1)、甘油-3-磷酸乙酰转移酶(GPAT3)表达下调,同时光合相关蛋白质表达也下降,说明叶片衰老过程中蛋白质合成受阻。此外,核蛋白质合成的60S、40S、质体及线粒体蛋白质合成的30S和50S相关蛋白质表达量降低,例如核糖体蛋白S19(Ribosomal protein S19)、核糖体蛋白L1家族蛋白(Ribosomal protein L1 family protein)、核糖体蛋白S3(Ribosomal protein S3) 和糖基化修饰相关的N-糖胺酰转移酶(CGL1) 表达量也下降,而蛋白质转运相关的Ras蛋白(RABA5C)及脂质转运有关的磷脂转运ATP酶2(ALA2)含量上升。
2.4.3 信号转导及胁迫响应相关蛋白质的表达变化 植物叶片衰老过程中,细胞与细胞器的结构与功能发生一系列改变,包括丙二醛和活性氧的产生,叶绿体类囊体膜完整性的破坏,膜脂过氧化严重等。为了抵御过氧化造成的损伤,植物大量表达与逆境胁迫、防御相关的蛋白质。本研究中,乳熟期剑叶中过氧化物酶21和转录因子类似R2R3MYB结构域蛋白(Similar to R2R3MYB-domain protein) 表达量都表现出上升的趋势,但与胁迫响应相关的Harpin蛋白结合蛋白1(Harpin binding protein 1)、叶绿体4.1×104RNA茎环结合蛋白b(Chloroplast stem-loop binding protein of 4.1×104b)和 S受体激酶PK3前体样蛋白(S-receptor kinase PK3)出现表达量下降趋势。在信号转导通路蛋白质方面,形成素样蛋白5(Formin protein5)和Shaggy相关的蛋白激酶κ也出现表达下调。
表1通过质谱分析鉴定的53个水稻剑叶差异表达蛋白质的具体信息
Table1Detailedinformationofthefifty-threedifferentlyexpressedproteinsofriceflagleavesidentifiedbymassspectrometry
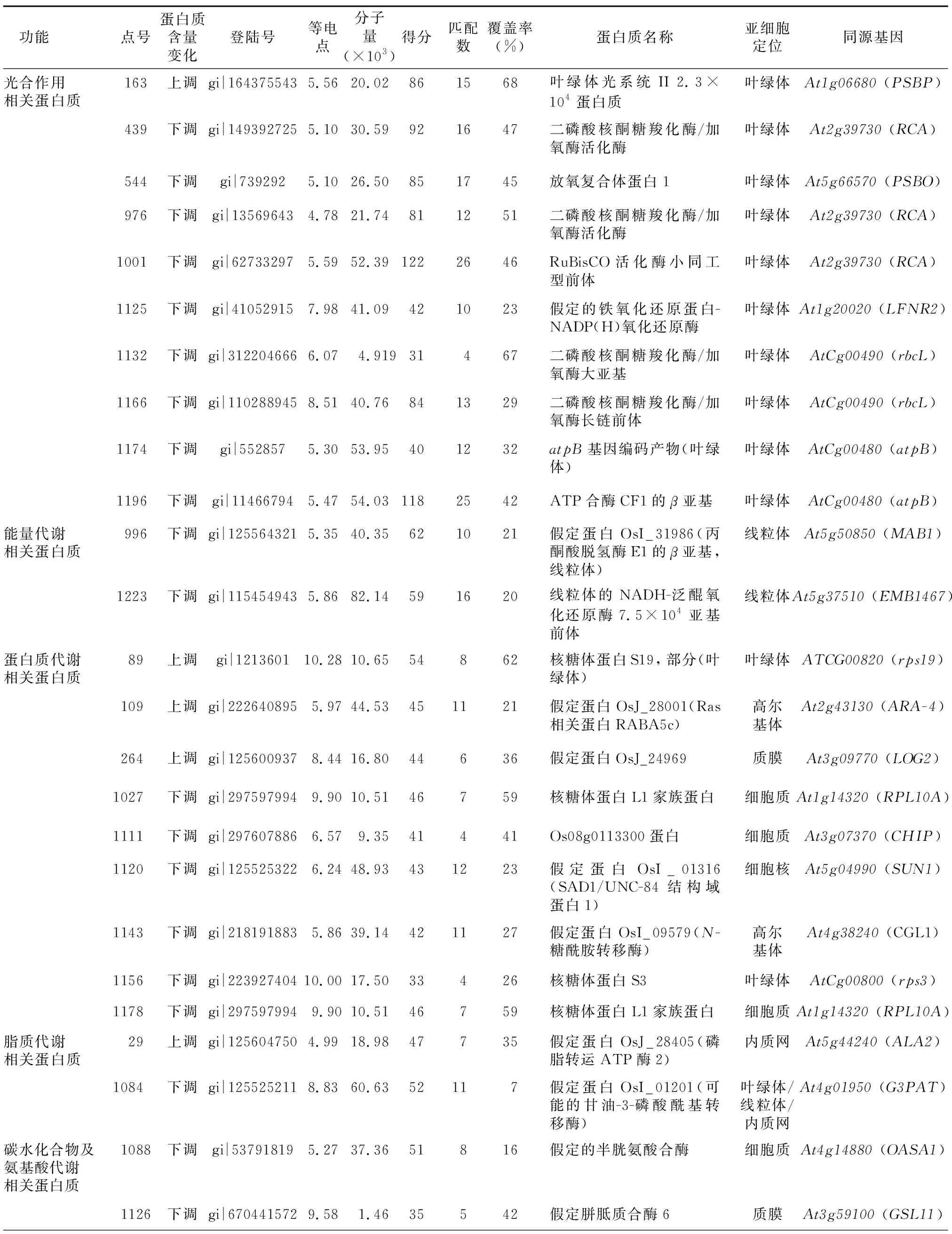
功能 点号蛋白质含量变化登陆号等电点分子量(×103)得分匹配数覆盖率(%)蛋白质名称亚细胞定位同源基因光合作用相关蛋白质163上调gi|1643755435.5620.02861568叶绿体光系统II 2.3×104蛋白质叶绿体At1g06680 (PSBP)439下调gi|1493927255.1030.59921647二磷酸核酮糖羧化酶/加氧酶活化酶叶绿体At2g39730 (RCA)544下调gi|7392925.1026.508517 45放氧复合体蛋白1叶绿体At5g66570 (PSBO)976下调gi|135696434.7821.74811251二磷酸核酮糖羧化酶/加氧酶活化酶叶绿体At2g39730 (RCA)1001下调gi|627332975.5952.391222646RuBisCO活化酶小同工型前体叶绿体At2g39730 (RCA)1125下调gi|410529157.9841.09421023假定的铁氧化还原蛋白- NADP(H)氧化还原酶叶绿体At1g20020 (LFNR2)1132下调gi|3122046666.074.91931467二磷酸核酮糖羧化酶/加氧酶大亚基叶绿体AtCg00490 (rbcL)1166下调gi|1102889458.5140.76841329二磷酸核酮糖羧化酶/加氧酶长链前体叶绿体AtCg00490 (rbcL)1174下调gi|5528575.3053.95401232atpB基因编码产物(叶绿体)叶绿体AtCg00480 (atpB)1196下调gi|114667945.4754.031182542ATP合酶CF1的β亚基叶绿体AtCg00480 (atpB)能量代谢相关蛋白质996下调gi|1255643215.3540.35621021假定蛋白OsI_31986(丙酮酸脱氢酶E1的β亚基,线粒体)线粒体At5g50850 (MAB1)1223下调gi|1154549435.8682.14591620线粒体的NADH-泛醌氧化还原酶7.5×104亚基前体线粒体At5g37510 (EMB1467)蛋白质代谢相关蛋白质89上调gi|121360110.2810.6554862核糖体蛋白S19, 部分(叶绿体)叶绿体ATCG00820 (rps19)109上调gi|2226408955.9744.53451121假定蛋白OsJ_28001(Ras相关蛋白RABA5c)高尔基体At2g43130 (ARA-4)264上调gi|1256009378.4416.8044636假定蛋白OsJ_24969质膜At3g09770 (LOG2)1027下调gi|2975979949.9010.5146759核糖体蛋白L1家族蛋白细胞质At1g14320 (RPL10A)1111下调gi|2976078866.579.3541441Os08g0113300蛋白细胞质At3g07370 (CHIP)1120下调gi|1255253226.2448.93431223假定蛋白OsI_01316(SAD1/UNC-84结构域蛋白1)细胞核At5g04990 (SUN1)1143下调gi|2181918835.8639.14421127假定蛋白OsI_09579(N-糖酰胺转移酶)高尔基体At4g38240 (CGL1)1156下调gi|22392740410.0017.5033426核糖体蛋白S3叶绿体AtCg00800 (rps3)1178下调gi|2975979949.9010.5146759核糖体蛋白L1家族蛋白细胞质At1g14320 (RPL10A)脂质代谢相关蛋白质29上调gi|1256047504.9918.9847735假定蛋白OsJ_28405(磷脂转运ATP酶2)内质网At5g44240 (ALA2)1084下调gi|1255252118.8360.6352117假定蛋白OsI_01201(可能的甘油-3-磷酸酰基转移酶)叶绿体/线粒体/内质网At4g01950 (G3PAT)碳水化合物及氨基酸代谢相关蛋白质1088下调gi|537918195.2737.3651816假定的半胱氨酸合酶细胞质At4g14880 (OASA1)1126下调gi|6704415729.581.4635542假定胼胝质合酶6质膜At3g59100 (GSL11)
续表1Continued1
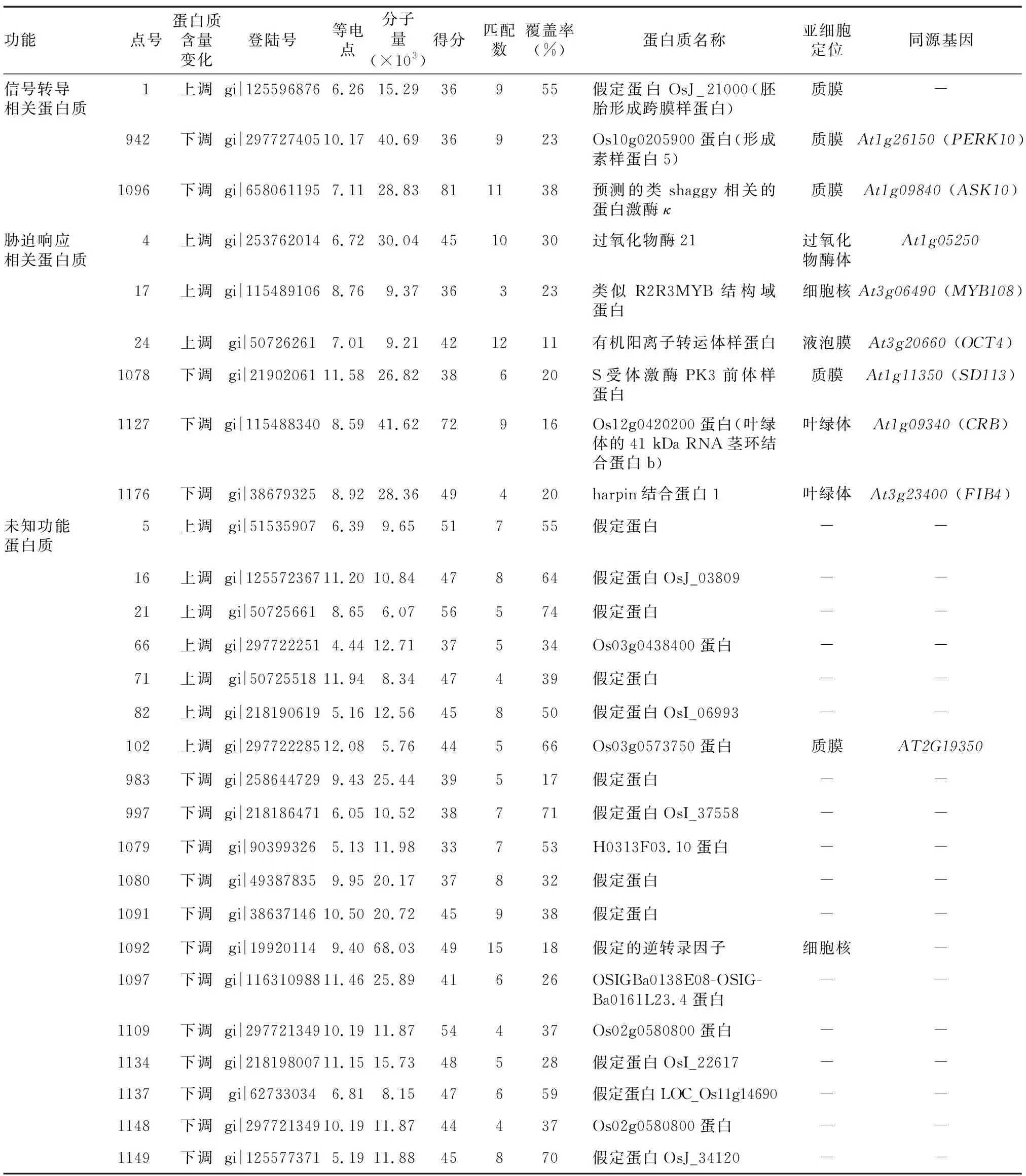
功能点号蛋白质含量变化登陆号等电点分子量(×103)得分匹配数覆盖率(%) 蛋白质名称亚细胞定位同源基因信号转导相关蛋白质1上调gi|1255968766.2615.2936955假定蛋白OsJ_21000(胚胎形成跨膜样蛋白)质膜-942下调gi|29772740510.1740.6936923Os10g0205900蛋白(形成素样蛋白5)质膜At1g26150 (PERK10)1096下调gi|6580611957.1128.83811138预测的类shaggy相关的蛋白激酶κ质膜At1g09840 (ASK10)胁迫响应相关蛋白质4上调gi|2537620146.7230.04451030过氧化物酶21过氧化物酶体At1g0525017上调gi|1154891068.769.3736323类似R2R3MYB结构域蛋白细胞核At3g06490 (MYB108)24上调gi|507262617.019.21421211有机阳离子转运体样蛋白液泡膜At3g20660 (OCT4)1078下调gi|2190206111.5826.8238620S受体激酶PK3前体样蛋白质膜At1g11350 (SD113)1127下调gi|1154883408.5941.6272916Os12g0420200蛋白(叶绿体的41 kDa RNA茎环结合蛋白b)叶绿体At1g09340 (CRB)1176下调gi|386793258.9228.3649420harpin结合蛋白1叶绿体At3g23400 (FIB4)未知功能蛋白质5上调gi|515359076.399.6551755假定蛋白--16上调gi|12557236711.2010.8447864假定蛋白OsJ_03809--21上调gi|507256618.656.0756574假定蛋白--66上调gi|2977222514.4412.7137534Os03g0438400蛋白--71上调gi|5072551811.948.3447439假定蛋白--82上调gi|2181906195.1612.5645850假定蛋白OsI_06993--102上调gi|29772228512.085.7644566Os03g0573750蛋白质膜AT2G19350983下调gi|2586447299.4325.4439517假定蛋白--997下调gi|2181864716.0510.5238771假定蛋白OsI_37558--1079下调gi|903993265.1311.9833753H0313F03.10蛋白--1080下调gi|493878359.9520.1737832假定蛋白--1091下调gi|3863714610.5020.7245938假定蛋白--1092下调gi|199201149.4068.03491518假定的逆转录因子细胞核-1097下调gi|11631098811.4625.8941626OSIGBa0138E08-OSIG-Ba0161L23.4蛋白--1109下调gi|29772134910.1911.8754437Os02g0580800蛋白--1134下调gi|21819800711.1515.7348528假定蛋白OsI_22617--1137下调gi|627330346.818.1547659假定蛋白LOC_Os11g14690--1148下调gi|29772134910.1911.8744437Os02g0580800蛋白--1149下调gi|1255773715.1911.8845870假定蛋白OsJ_34120--
登陆号、得分、匹配数和覆盖率通过Mascot软件从NCBInr、Swiss Prot和EST数据库数据分析获得。覆盖率:蛋白质氨基酸序列被匹配的肽段所覆盖的百分比;得分:肽段分子质量计算得分;匹配数:肽段氨基酸序列匹配数; -:未知。
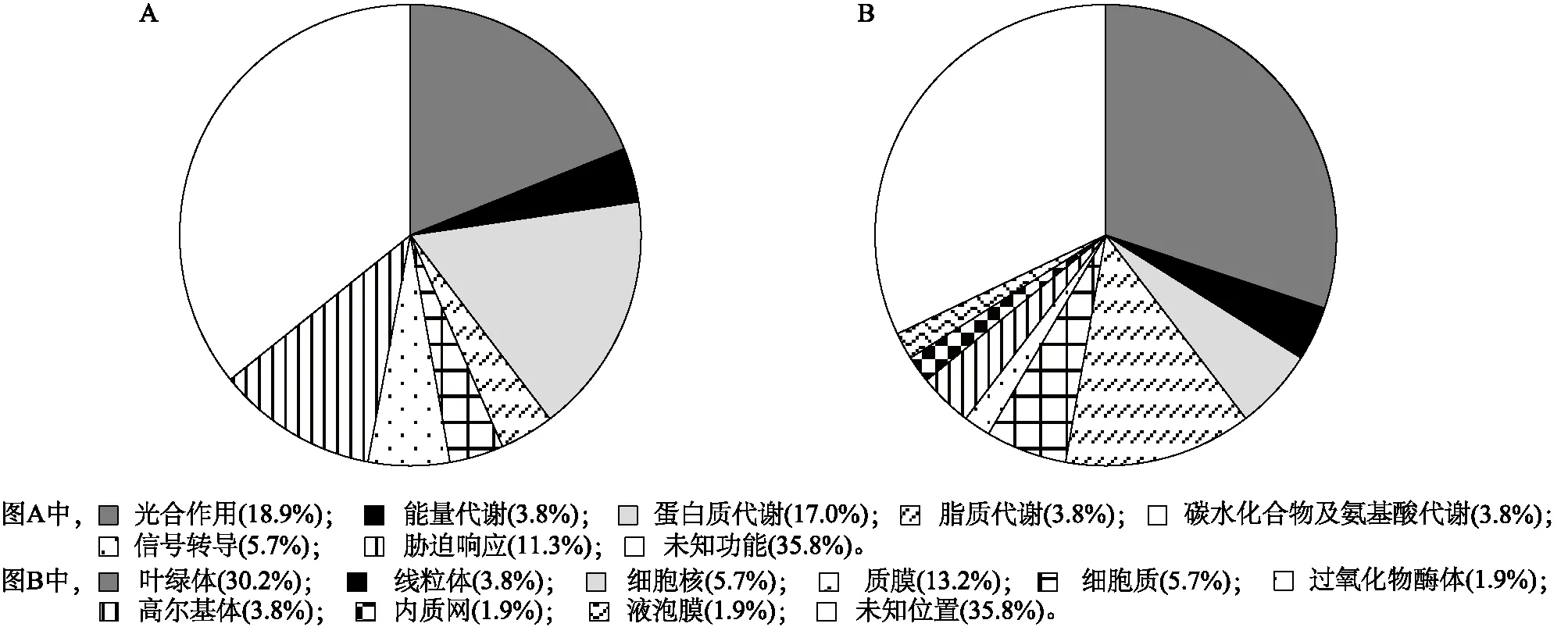
图3 鉴定的53个水稻剑叶差异表达蛋白质的功能分类(A)和亚细胞定位(B)Fig.3 Functional classification and distribution (A) and protein subcellular locations (B) of all 53 identified differently expressed proteins of rice flag leaves
2.5 杂交水稻两优培九剑叶衰老过程中差异蛋白质的互作网络分析
通过UniProtKB的Blast分析,我们得到了34个已鉴定蛋白质的拟南芥同源基因(表1)。利用GeneMANIA 对这些同源基因进行蛋白质互作预测,以寻找在孕穗期和乳熟期水稻叶片中蛋白质网络的关键节点蛋白质。蛋白质互作网络分析结果(图4)显示,围绕光合作用的蛋白质,例如RuBisCO大亚基(RBCL)、RuBisCO活化酶(RCA)、ATP合酶CF1β亚基(ATPB)、捕光复合体蛋白(LHC)等核心蛋白质形成了1个大的功能群,涵盖了所有7个已知功能分类的21个蛋白质。甘油-3-磷酸乙酰转移酶(GPAT3)与甘油醛-3-磷酸脱氢酶(GAPA1)和光系统IG亚基(PSAG)存在相互作用。磷脂转运ATP酶2(ALA2)与ATP合酶β亚基(ATPB)存在相互联系。半胱氨酸合成酶(OASA1)和线粒体NADH-辅酶Q脱氢酶(EMB1467)、丙酮酸脱氢酶(PDH2)存在相互作用,且与光系统I叶绿素a-b结合蛋白(LHCA1、LHCA3)、PSII捕光复合物(LHCB4.1、LHCB5)、PSII放氧复合物I(PSBO1)、PSI F亚基(PSAF)共表达。
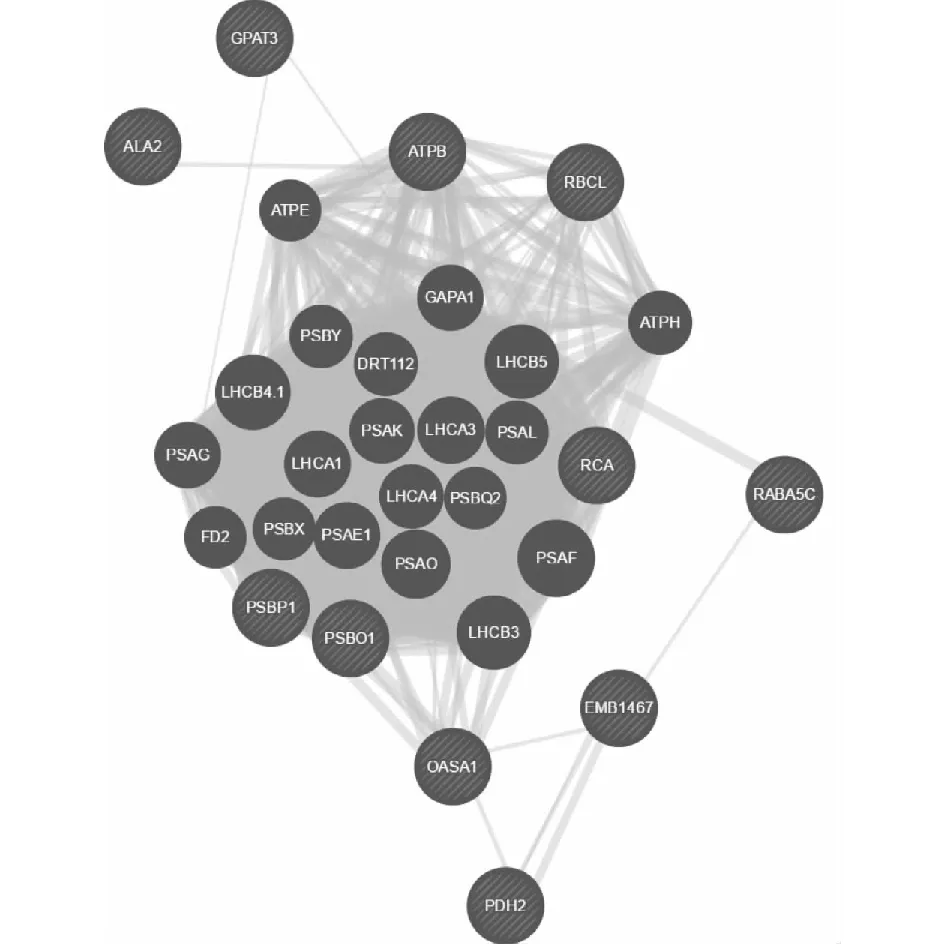
图4 水稻孕穗期和乳熟期剑叶差异表达蛋白质(拟南芥同源蛋白质)的互作网络Fig.4 Interaction network of differentially expressed proteins (homologous proteins in Arabidopsis thaliana) in rice flag leaves during booting stage and milk stage
3 讨 论
叶片衰老是一个精密调节、规范有序、具有策略的生理活动过程[12-14],最显著的特点是受到衰老调控的蛋白质和基因表达量的连续微小的变化[15-19]。本研究采用双向电泳技术对高产杂交水稻两优培九衰老进程中剑叶蛋白质表达进行了分析,结果表明孕穗期与乳熟期剑叶中差异表达的蛋白质点涉及诸多代谢途径,包括光合作用、能量代谢、蛋白质代谢、脂质代谢和氨基酸及碳水化合物代谢。
两优培九乳熟期剑叶衰老过程中,光合相关的蛋白质表达量降低,这些蛋白质涉及光反应各个途径。在暗反应中,RuBisCO、RuBisCO前体和RuBisCO活化酶3个主要蛋白质表达量发生变化。RuBisCO含量降低将削弱暗反应中CO2的浓缩与固定,进而不利于作物有机物的积累。RuBisCO活化酶为RuBisCO的伴侣分子,能够调节其活性,其主要作用是通过移除RuBisCO活化位点上的抑制性糖类实现对RuBisCO的激活[20]。有研究结果表明,受某种因素影响,未活化的RuBisCO与RuBP(1,5-二磷酸核酮糖)紧密结合,形成RuBisCO-RuBP复合物,使RuBisCO钝化,不能进行反应;在光下,RuBisCO活化酶水解ATP并使RuBisCO-RuBP复合物解离,RuBP被释放;RuBisCO被氨甲酸化,与Mg2+形成三元复合物(RuBisCO-CO2-Mg2+,ECM),ECM与RuBP结合即可启动羧化反应[21]。RuBisCO活化酶含量和活性的减少将加速RuBisCO酶含量与活性的下降[22-23]。由此可以看出,RuBisCO和RuBisCO活化酶的表达是相互关联的。这说明剑叶衰老时,光反应和暗反应过程的许多蛋白质表达量均有变化。
在细胞代谢方面,两优培九乳熟期剑叶在衰老进程中,表现出氨基酸、蛋白质、糖类和脂质的合成代谢下降,物质转运活跃的趋势。核糖体蛋白在蛋白质生物合成中发挥着重要作用,其在乳熟期剑叶中表达下调可能是RuBisCO大亚基和RuBisCO活化酶表达下调的原因之一。N-糖胺酰转移酶(CGL1)是蛋白质N型糖基化修饰的关键酶,N-糖胺酰转移酶表达的下调可能对糖蛋白的含量有调控作用。起蛋白质转运作用的P型环状核苷三磷酸水解酶超家族蛋白(ARA4)随着剑叶衰老而上调[24]。此外,Keech等[25]证实拟南芥叶片的衰老进程伴随着细胞微管系统的解体。本研究中连接细胞核骨架和细胞骨架的LINC复合体组分蛋白SAD1/UNC-84结构域蛋白表达量的下降表明细胞骨架结构系统的变化也是叶片衰老的重要标志。
半胱氨酸合成酶(OASA1)的功能是催化半胱氨酸的合成,而半胱氨酸是合成抗氧化剂谷胱甘肽的重要底物之一[26]。乳熟期剑叶中半胱氨酸合成酶(OASA1)的表达量下调,说明谷胱甘肽的合成逐渐减少。蛋白质网络分析结果显示,OASA1和多个光合蛋白质(LHCA1、LHCA3、PSBO1等)以及线粒体NADH-辅酶Q脱氢酶(EMB1467)、丙酮酸脱氢酶(PDH2)共表达,推测其在叶绿体和线粒体功能衰退方面存在一定影响。胼胝质合成酶6(GSL11)通常参与细胞壁延伸,同时能够抵抗环境胁迫和病原体侵染,其表达量的下调说明水稻植株在衰老过程中抵御逆境的能力逐步下降[26-28],这可能也是两优培九在生殖生长后期衰老加速的原因之一。
甘油-3-磷酸乙酰转移酶(GPAT3)是甘油磷脂合成步骤中第一步反应的关键酶,在甘油三脂(TG)和甘油磷脂(Phosphatidylchoine)的生物合成中扮演重要角色。乳熟期剑叶中GPAT3含量的减少从源头上造成类囊体膜的减少,继而导致叶片光合能力下降,推测叶绿体的衰老是膜-蛋白质系统协同变化的结果。然而,磷脂转运ATP酶含量上升则说明供给内膜系统的磷脂可能增加,推测在叶片衰老进程中,作为膜系统主要构成组分的磷脂系统在不同细胞区域的周转具有异质性。值得注意的是,脂质代谢与蛋白质代谢类似,均呈现出合成受阻而转运活跃的规律。
植物衰老进程中大分子物质的分解代谢越旺盛,消耗的能量则越多,而线粒体作为主要的产能细胞器,需保持活性以满足衰老过程中的能量需求,因此,与叶绿体不同,线粒体的衰老往往是滞后的[29]。本研究中,水稻剑叶线粒体中的NADH-辅酶Q脱氢酶和丙酮酸脱氢酶的表达量在乳熟期显著下降,限制了糖酵解产生的NADH和丙酮酸进入线粒体再利用,说明在叶片衰老后期线粒体氧化磷酸化效率降低可能与分解代谢逐渐削弱有关。
R2R3MYB结构域蛋白是植物中广泛存在且功能多样的一类MYB蛋白质,参与次生代谢调节,细胞形态建成,激素刺激和逆境胁迫响应,分生组织形成及细胞周期控制等诸多生物过程,R2R3MYB基因受各种逆境胁迫的诱导[30-32]。R2R3MYB在乳熟期表达量上升,我们推测水稻衰老进程中,MYB转录因子与序列为TAACTG的核心元件结合,激活多个功能基因发挥作用,延缓植物衰老[33-36]。此外,作为液泡离子转运蛋白的重要类型之一,有机阳离子转运样蛋白(Organic cation transporter-like protein)的表达量增加表明其在水稻衰老进程中具有重要作用[37]。HrBP1是植物叶绿体内产生的受体蛋白,能够与病原菌侵染植株时产生的Harpin信号蛋白特异性结合,乳熟期剑叶中HrBP1蛋白表达的显著下调可能导致叶绿体对活性氧的氧化压力变得敏感,促进光系统蛋白的降解,加速叶绿体的衰老进程[38-39]。此外,先前的研究结果表明叶绿体RNA茎环结构结合蛋白b(Chloroplast stem-loop binding protein of 41kDa b,CRB/CSP41b)对叶绿体RNA的转录和翻译有调控作用[40]。但近年来的研究结果显示CSP41b也是一个与干旱、盐渍等逆境响应相关的蛋白质,可能与脱落酸(ABA)信号转导有关[41-42]。本研究中,乳熟期剑叶CSP41b表达量的下调可能对叶绿体基因编码蛋白质有调控作用,且同叶绿体核糖体蛋白的翻译水平调控一致,但其对叶片衰老的具体调控机制还需进一步研究。随着生长发育进程,过氧化物酶表达量增加,推测过氧化物酶兼具两方面效应:一是作为抗氧化物酶类,负责清理代谢产物H2O2自由基;二是过氧化物酶同时还有生成H2O2的功能[43-44],可能在水稻剑叶衰老过程中促进H2O2生成,最后导致水稻细胞膜发生过氧化,结构完整性遭到破坏,表现为促进衰老的效应。因此,细胞氧化压力的增加和抗氧化系统性能的逐步降低是叶片衰老进程的重要特征。

