葡萄赤霉素合成关键基因VvGA20ox2的克隆、亚细胞定位和表达分析
高世敏,董 阳,王 武,陶建敏
(南京农业大学园艺学院,江苏 南京 210095)
赤霉素作为一种植物内源激素,在种子的萌发,茎和根的伸长,叶片伸展,花和果实的发育等植物生长的整个生命周期起着重要的调控作用[1-7]。目前关于赤霉素生物合成路径的研究已趋于完善[8-11],此过程需要多种酶参与完成,包括参与 GA 合成早期步骤的一些酶,如古巴焦磷酸合成酶(CPS)、内根-贝壳杉烯合成酶(KS)、内根-贝壳杉烯氧化酶(KO)和内根-贝壳杉烯酸氧化酶(KAO)及参与后期步骤的一些酶,如GA20-氧化酶(GA20ox)、GA3β羟基化酶(GA3ox) 和GA2-氧化酶(GA2ox),其中,CPS、GA20ox和GA3ox被认为是整个赤霉素的生物合成过程中起关键作用的酶,GA20ox的主要作用是通过多步反应将 GA12和GA53催化合成 GA9和 GA20,从而形成有生物活性的GAs[12-13]。
葡萄是世界上广泛种植的果树之一,中国的鲜食葡萄产量占全球葡萄产量的 14%[14],金手指葡萄(Golden Finger,V.viniferaL. ×V.larbruscaL.)为鲜食葡萄的一种,甘甜爽口,有浓郁的冰糖味和牛奶味,且果粒形状奇特美观,深受广大消费者喜爱。由于自然环境及自身生长因素的影响,在成熟时葡萄果粒往往形态大小不一致,造成商品质量下降。为了更加有效地提高生产质量,开展葡萄果实形状的研究变得尤为重要。传统的改良果实形状的育种方法主要是杂交实生选种,这需要较长的时间和较大的种植规模[15]。目前生产上多使用植物生长调节剂调节果实发育,改善果实品质,外源赤霉素(GA3)作为一种重要的生长调节剂,在果实的发育及膨大方面起着重要作用,可调节果实形状[16-18]。有研究结果表明外源GA3处理对葡萄的果形指数影响较大,郑焕等[17]发现钟山红葡萄果形指数随着盛花期使用GA3浓度的增加而增大,当浓度达到一定值后,果形指数并无显著提高。但赤霉素调节葡萄果实形状的分子机制仍不清楚,GA20ox作为赤霉素合成过程中的关键酶,可能调节果实发育,影响葡萄果形变化。染色质免疫共沉淀表明AtGA20ox1基因作为AtOFP1的靶基因调控着果实的发育,AtOFP1转录因子通过抑制AtGA20ox1的表达,从而抑制下胚轴细胞的生长,产生矮小的植株表型,过量表达AtOFP1的拟南芥角果纵径变短[19]。目前在葡萄中关于GA20ox2基因的研究主要集中在GA20ox在赤霉素合成过程中的调控,因此探讨GA20ox2基因在葡萄果实形状上的作用具有重要的实际意义和参考价值。
针对金手指葡萄果形的特异性,掌握合适的GA3处理时间及浓度对果实的生长及形状的一致性尤为关键,本试验以金手指葡萄盛花后7 d的幼果为材料,克隆出VvGA20ox2基因,对其进行序列特征及表达分析,以期从分子水平上初步了解赤霉素调控葡萄果实发育机理,为葡萄果形方面的研究提供理论依据。
1 材料与方法
1.1 试验材料
试验于2017年5月在南京农业大学汤山葡萄试验基地进行。供试品种为5年生金手指葡萄,采用平棚架避雨栽培,株行距为 3.0 m×6.0 m, T型架,常规田间管理。
1.2 试验方法
1.2.1 田间处理 选取3株长势一致的金手指葡萄树,为了增强试验的可靠性,在处理前统一修剪花序,序尖留约4 cm,试验进行3次生物学重复,在每株树的两臂分别为处理组和对照组。以每个花序一半以上的小花开放时期作为盛花期,在盛花后7 d,用质量浓度为25 mg/L的赤霉素溶液对幼果进行浸泡处理,处理时间大约为10 s,以清水处理作为对照(CK)。
1.2.2 样品采集 分别采集处理后1 d、3 d、5 d、7 d、14 d 5个时期的对照组及处理组葡萄果实样品,从3 次生物学重复的植株上随机采集,取样时兼顾阴阳两面,用液氮速冻,带回实验室,保存于-80 ℃冰箱中待用。果实成熟时,在处理组和对照组中各选取30粒果粒用冰盒带回实验室,测量其纵横径。
1.2.3 RNA的提取及cDNA第一条链的合成 采用多糖多酚植物组织总RNA提取试剂盒(成都福际公司产品)提取上述各时期样品的总RNA,利用反转录试剂盒PrimeScriptTM1st Strand cDNA Synthesis Kit (TaKaRa公司产品)反转录合成 cDNA 第一条链,稀释后的 cDNA 用于实时荧光定量 PCR。
1.2.4VvGA20ox2基因ORF的克隆及生物信息学分析 根据已知RNA-seq测序结果,在NCBI中查找到GA20ox2在葡萄中的预测序列(XP_002266536.1),其CDS区在GenBank的登录号为KC898186,利用DNAMAN 8.0设计特异性引物M1(表1),以盛花后7 d果实 cDNA为模版,进行PCR扩增,反应体系(25.0 μl)为:稀释后的cDNA 1.0 μl,5×PrimeSTAR GXL buffer 5.0 μl,dNTP mixture 2.0 μl,PrimeSTAR GXL DNA polymcrace 0.5 μl,上、下游引物各0.5 μl,灭菌后ddH2O 15.5 μl;反应程序:98 ℃预变性5 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸80 s,35个循环;68 ℃延伸10 min,4 ℃保存。琼脂糖凝胶电泳检测后用 DNA凝胶回收试剂盒回收目标片段,并连接到pEASY-Blunt载体(全式金),转化大肠杆菌 DH5α 感受态细胞,阳性克隆鉴定后由擎科公司进行测序。
利用BioXM和 Prot-Param 在线软件对VvGA20ox2基因编码的氨基酸序列、蛋白质分子量和等电点等理化性质及结构进行预测分析,利用MEGA5.0软件进行同源性分析和系统进化树构建。
表1引物序列
Table1Sequenceofprimers
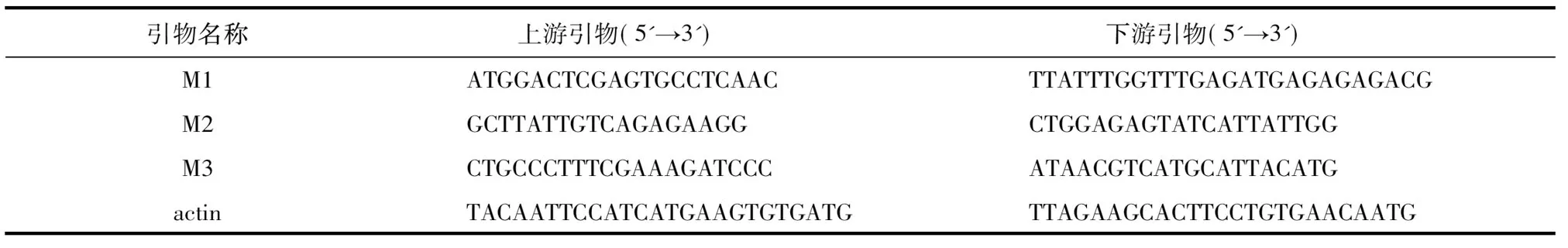
引物名称 上游引物(5'→3') 下游引物(5'→3')M1ATGGACTCGAGTGCCTCAACTTATTTGGTTTGAGAT-GAGAGAGACGM2GCTTATTGTCAGAGAAGGCTGGAGAGTATCATTATTGGM3CTGCCCTTTCGAAAGATCCCATAACGTCATGCATTACATGactinTACAATTCCATCATGAAGTGT-GATGTTAGAAGCACTTCCTGTGAA-CAATG
1.2.5VvGA20ox2基因的亚细胞定位 通过Gateway系统,构建PMDC43-GFP/VvGA20ox2表达载体。首先将已鉴定测序正确的VvGA20ox2基因连接到入门级载体pDONR221,然后使用BsrGI将其单酶切线性化,通过同源重组与PMDC43 载体进行连接,从而完成PMDC43-GFP/VvGA20ox2瞬时表达载体的构建,最后将获得的连接产物转化到EHA105农杆菌感受态细胞中,经PCR 扩增(引物M3见表1)筛选阳性克隆,并对阳性克隆进行测序验证正确后,进行烟草瞬时侵染试验。
农杆菌介导重组载体的烟草瞬时转化及激光共聚焦扫描显微镜观察亚细胞定位的方法参考已有报道[20]进行。
1.2.6VvGA20ox2基因的表达分析 根据VvGA20ox2基因碱基序列设计实时荧光定量 PCR 特异引物M2(表 1),以葡萄Actin(XM_002265440)作为内参基因。PCR反应体系(20.0 μl)为: cDNA 1.2 μl,2×SYBR PremixExTaqTM (TaKaRa公司)10.0 μl,上、下游引物各 0.4 μl,灭菌后ddH2O补足至20.0 μl。反应程序为:95 ℃ 4 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 40 s,40个循环。每个样品设3次重复,采用ABI7300system 软件和 2-△△Ct[21]方法分析数据。
1.2.7 果实纵、横径的测量及果形指数的计算 果实成熟后,每个处理各取30个有代表性的果粒,用电子游标卡尺测量其纵、横径,计算果形指数。数据采用SAS 9.1软件进行方差分析。
2 结果与分析
2.1 葡萄VvGA20ox2基因的克隆
根据先前RNA-seq研究结果中选择差异表达基因GA20ox2,在NCBI中获得此基因的预测序列。以盛花后14 d金手指葡萄幼果为材料,扩增出一条1 000 bp左右的片段(图1)。测序并通过DNAMAN软件将得到的序列与预测序列(XP_002266536.1)进行比对发现,CDS序列长度一致,长度为1 134 bp。第547位核苷酸发生突变,由TGG变成AGG,其编码氨基酸由色氨酸变成精氨酸(图2)。
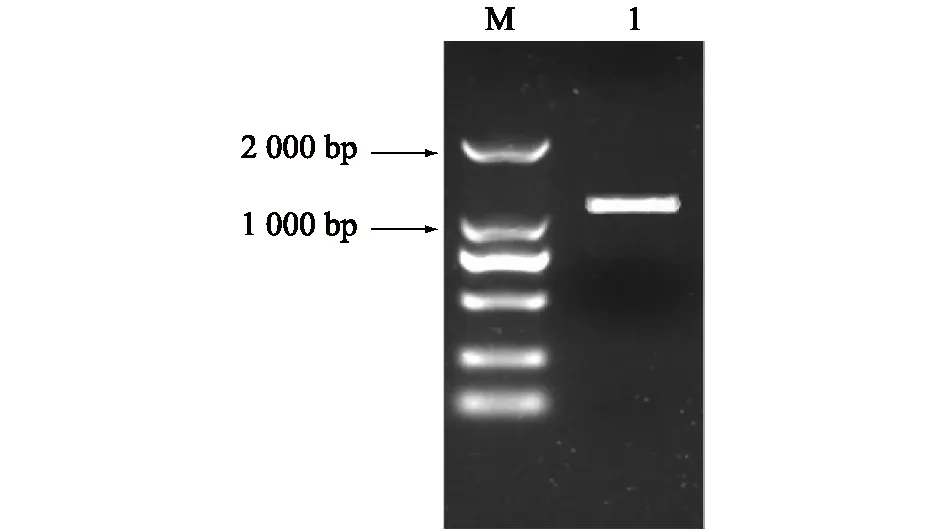
M:DL2000 market;1:VvGA20ox2基因片段扩增产物。图1 VvGA20ox2基因扩增结果Fig.1 Amplification of VvGA20ox2 gene

方框内为突变位点。图2 VvGA20ox2基因ORF及其推导的氨基酸序列Fig.2 The open reading frame of VvGA20ox2 and the sequence of deduced amino acid
2.2 葡萄VvGA20ox2蛋白生物信息学分析
2.2.1 VvGA20ox2蛋白的理化性质分析VvGA20ox基因编码377个氨基酸,包含51个酸性氨基酸(Asp+Glu),49个碱性氨基酸(Arg+Lys),编码产物相对分子量为42 788.605,等电点为6.93,蛋白质的不稳定系数是32.8,平均亲水系数为-0.649,属于亲水蛋白质。
2.2.2 VvGA20ox2蛋白的疏水性、信号肽和跨膜结构分析 疏水性分析结果表明,VvGA20ox2蛋白没有明显的疏水性区域,属于亲水蛋白。 TMHMM Servecr v.2.0分析结果表明,VvGA20ox2蛋白没有跨膜区域。利用SignalP4.0软件预测信号肽,结果表明VvGA20ox2蛋白没有信号肽。
2.2.3 VvGA20ox2蛋白的二级结构和卷曲螺旋预测 VvGA20ox2蛋白包含32.10%的α-螺旋(Alpha helix),21.49%的β-折叠(Extended strand),10.61%β-转角(Beta turn)和35.81%的无规则卷曲(Random coil),利用在线网站Net NES1.1预测VvGA20ox2蛋白的NES,结果表明VvGA20ox2蛋白仅有4个NES保守位点,分别是亮氨酸(197,202),异亮氨酸(199,205)。
2.2.4 VvGA20ox2蛋白的系统进化树 在Pfam数据库(http://pfam.xfam.org/)中查找葡萄VvGA20ox2蛋白的结构域,发现第59~171氨基酸位点为DIOX_N结构域,第221~320位点是2OG-Fell_Oxy结构域。
将VvGA20ox2蛋白氨基酸序列与其他物种的同源氨基酸序列进行比对(图3),试验结果表明,所有氨基酸序列均含有上述两个结构域,说明GA20ox蛋白在各个物种中是相对保守的,通过同源性比对分析,发现VvGA20ox2基因编码的氨基酸序列与多种植物GA20ox氨基酸序列相似性在51%~67%,其中,与可可(EOX92603.1)和杨树(PNT28192.1)的同源性较高,分别达到65%和67%,与草莓(ABB00359.1)、番茄(NP_001234070.1)、拟南芥(AGW24332.1)、水稻(AER45797.1)、玉米(AQK99102.1)、烟草(XP_016471245.1)的同源性分别为53%、55%、53%、55%、54%、56%,而与小麦(CFV04355.1)的同源性为51%。系统进化树分析结果表明(图4),葡萄VvGA20ox2蛋白与可可和杨树亲缘关系较近,与模式植物拟南芥、番茄等植物亲缘关系较远,系统进化树与物种进化关系一致。

黑色方框代表DIOX_N结构域,红色方框代表2OG-Fell_Oxy结构域。图3 葡萄VvGA20ox2与其他植物GA20ox蛋白氨基酸序列的同源性比对Fig.3 Multiple sequence alignment of the VvGA20ox2 and GA20ox from other plants
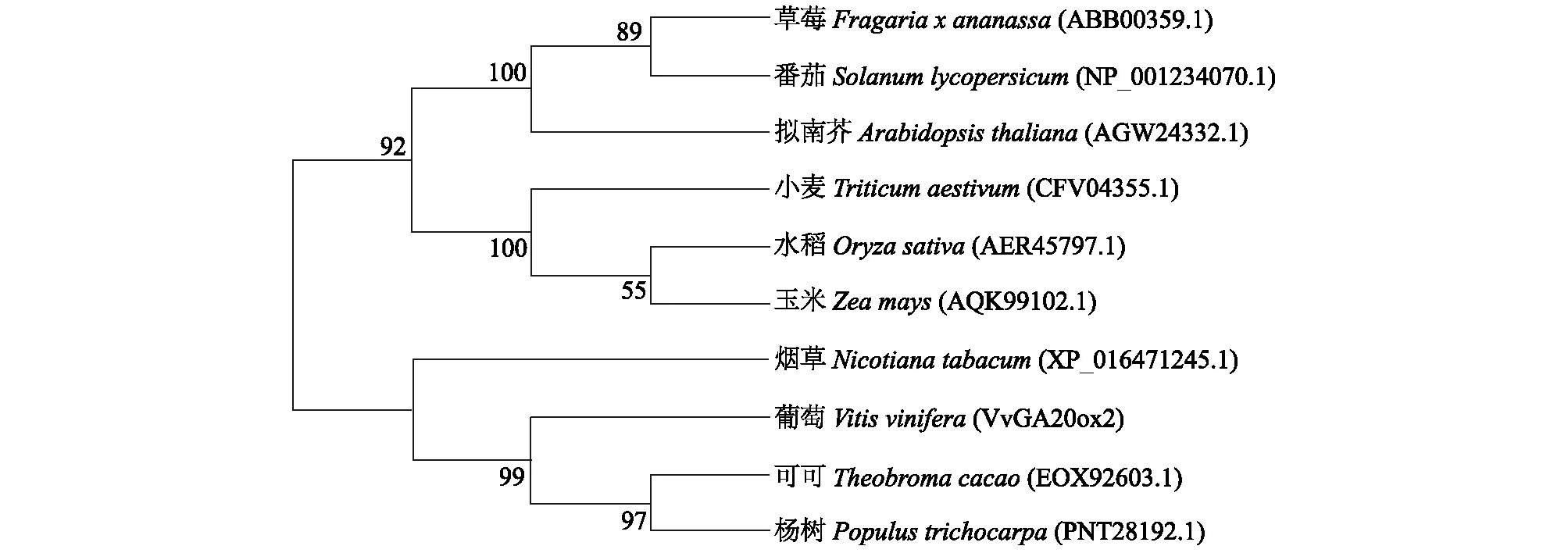
图4 葡萄VvGA20ox2与其他物种GA20ox蛋白氨基酸序列的系统进化树Fig.4 Phylogenetic tree of VvGA20ox2 in grapevine and the GA20ox protein amino acid sequence in other species
2.3 VvGA20ox2蛋白亚细胞定位
为探索VvGA20ox2基因所编码蛋白在植物亚细胞结构中的分布情况,进一步构建了VvGA20ox2的瞬时表达载体35S-VvGA20ox2-GFP,并将其转化到烟草细胞内,借助绿色荧光蛋白来确定目标蛋白在细胞内的分布情况。利用农杆菌介导法转化烟草细胞,在侵染后将烟草暗培养3 d后,制作临时切片,用激光共聚焦扫描显微镜观察绿色荧光蛋白信号。结果显示,PMDC43-GFP空载体在整个细胞范围内都显示出绿色荧光信号(图5),而瞬时表达载体35S-VvGA20ox2-GFP表达的融合蛋白不仅在细胞核上有荧光信号,在细胞膜上也可观察到绿色荧光(图5)。
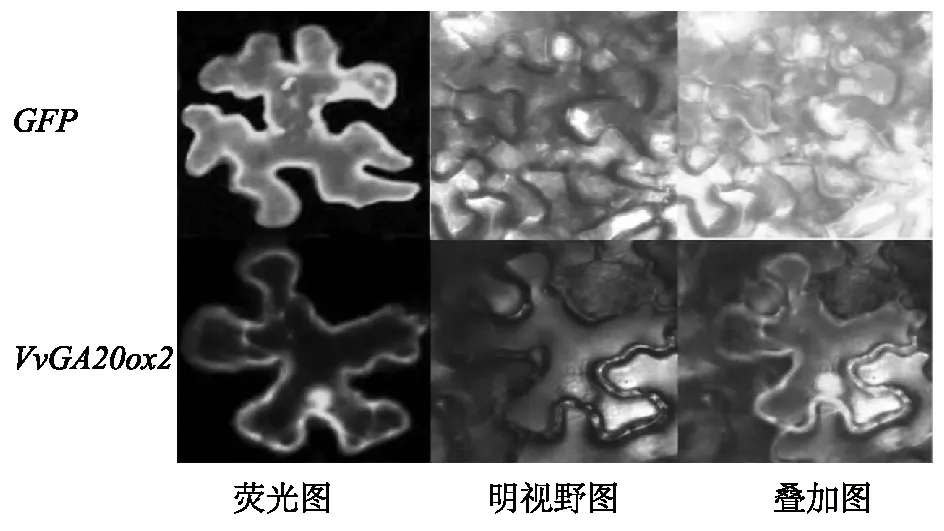
图5 VvGA20ox2在烟草表皮细胞中的亚细胞定位Fig.5 Subcellular localization of VvGA20ox2 in tobacco epidermal cells
2.4 VvGA20ox2 基因在GA3处理后表达分析
GA3处理后不同时期金手指葡萄果实VvGA20ox2基因表达实时荧光定量分析结果显示(图6),在GA3处理后第1 d,VvGA20ox2基因处理组的VvGA20ox2基因表达量显著低于对照,呈现显著下降趋势。随后在GA3处理后第2 d,处理组VvGA20ox2基因表达急速上升,在第3 d时相对表达量达到最高。在GA3处理后第7 d,此基因表达水平与对照相比差异较小,在GA3处理后第14 d几乎检测不到该基因的表达。
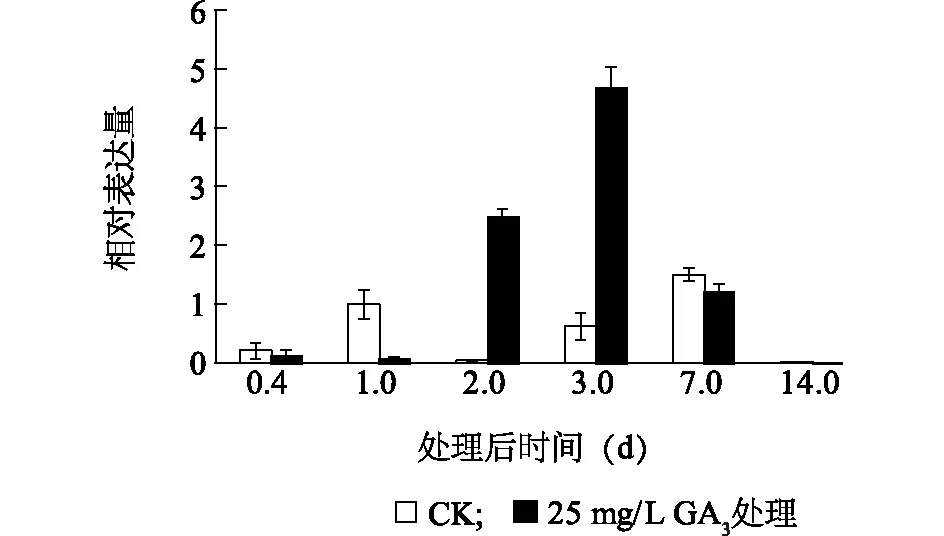
图6 VvGA20ox2 基因在赤霉素处理的金手指葡萄果实中不同时期的表达水平Fig.6 Expression level of VvGA20ox2 gene of Gold Finger grape treated by gibberellin at different development stages
2.5 果粒纵、横径及果形指数
葡萄果粒纵径在赤霉素处理下相比对照均有增长,且差异极显著(表2)。GA3处理下葡萄果粒横径增大,相比对照差异不显著,25 mg/L赤霉素处理后果形指数与对照差异极显著,说明葡萄果形发生显著变化。
表2赤霉素处理对果粒形状的影响
Table2Effectofgibberellintreatmentonfruitshape
同列数据不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
3 讨 论
在赤霉素生物合成途径中,参与GA合成早期步骤的一些酶由单基因编码,而参与后期步骤的一些酶则由多基因家族编码。目前,许多赤霉素合成代谢中的关键基因在葡萄上已经被克隆并进行了研究[22-24],GA20ox家族基因是植物体内合成活性赤霉素的关键基因,在活性赤霉素的合成过程起着极其重要的作用。在葡萄中关于GA20ox2基因的研究多集中于对赤霉素合成的调控,主要研究赤霉素处理葡萄在不同花期VvGA20ox3表达的变化[25]。改变基质浓度研究GA20ox2对其基因调控产物 GA12合成的影响[26],及在不同品种中的GA20ox家族的组织特异性表达差异[27],并未深入探讨GA20ox2基因在赤霉素调控合成中的作用对果实形状的影响。本试验通过对金手指葡萄果形转录组的分析,找到差异表达基因VvGA20ox2,并在金手指葡萄中克隆出VvGA20ox2基因,与NCBI中预测基因相比,该基因发生点突变,但突变位点不在功能结构域内,这可能是由于测序品种和试验品种不同造成的。多序列比对和系统发育树分析结果显示,在葡萄、杨树、番茄、拟南芥、水稻、烟草、可可、小麦、草莓和玉米等 10 种植物中,VvGA20ox2基因与杨树同源基因亲缘关系最近,并且在10种植物中具有相似的保守结构域,说明GA20ox2基因功能是相对保守的。
农杆菌介导法转化烟草细胞瞬时表达结果显示,VvGA20ox2蛋白同时定位在细胞核和细胞膜中,说明此基因编码的产物不仅在细胞核上有功能,而且在细胞膜上起作用。由于膜上的蛋白质主要有载体蛋白、与细胞活动相关的离子泵、通道蛋白和蛋白受体等,因此VvGA20ox2的编码产物对细胞质膜的稳定或控制蛋白转运具有一定的作用[28]。与VvGA20ox1蛋白定位结果一致[22],推测可能发挥相似的功能。
利用外源GA对花序和幼果处理可有效地提高果实品质,促进果实发育及膨大,在许多果树生产中应用广泛。本试验采用外施GA3处理葡萄幼果,在果实成熟时,处理后的果实纵径显著增长,与对照相比,果形发生明显变化。为了进一步了解VvGA20ox2基因在调节葡萄果形方面的功能,试验利用实时荧光定量PCR技术对该基因在处理与对照样品间的表达特性进行了分析,试验结果表明,在GA3处理后1 d内,VvGA20ox2的表达受到抑制,其原因可能在于GA20ox2基因的转录水平受到GAs初期的反馈调节影响。由于施用了外源 GA 使得果实内 GA 含量增高,进而抑制了该基因的表达,这与 GA 应答系统与活性 GA 含量之间存在着前馈和反馈调节的关系相一致,在GA3处理1 d后表达量迅速升高,并在第3 d达到峰值。在拟南芥中,AtGA20ox1 和AtGA20ox2基因可以促进下胚轴生长及角果的伸长[29],推测AtGA20ox同源基因VvGA20ox2可能参与了葡萄果形拉长的调控,从而促进果实的增长,产生长形果实。在GA3处理后第7 d,基因的表达逐渐下降,在第14 d几乎没有表达,可能与赤霉素的作用减弱有关。有研究结果表明,外源GA3的作用效果可以持续7~15 d[30]。
关于GA3对葡萄果实形状的调控作用,研究仍未深入,从拟南芥果形相关的研究中可知,AtGA20ox1基因作为AtOFP1的靶基因调控着果实的发育,影响植株大小。本试验从葡萄活性赤霉素合成中关键活性基因的序列功能及表达进行了分析,通过GA3处理后GA20ox2基因在幼果中的表达变化,调节内源赤霉素含量,从而影响果实发育,控制果形变化。同时,推测GA20ox2基因可能作为控制果形OVATE基因的靶基因调控果实发育,影响果实形状,但具体的调控机制仍不清楚,需要后续试验验证两者的关系,关于GA20ox2基因的在果形上的功能需要通过基因沉默和超表达进一步研究。

