四倍体艾纳香植株诱导及其倍性鉴定
,, ,,,,*
(1. 北京中医药大学 中药学院,北京102488;2. 北京师范大学良乡附属中学,北京102488;3. 北京林业大学 林学院,北京100083)
艾纳香[Blumeabalsamifera(L.) DC.]为菊科多年生植物,其叶片和嫩枝是提取艾片(左旋龙脑)的原料[1]。现代医学研究表明,艾片有抗炎镇痛、抗茵、抗病毒、保护心脑、双向调节神经系统、提高其他药物生物利用等作用[2],并且其解热持续作用及持续强度大于天然冰片及合成冰片[3]。新鲜或干燥地上部分也作药用,具有温中止泻、活血解毒、祛风除湿功能[4],在临床上的应用极为广泛。
目前,左旋龙脑的提取工艺较为成熟,但是其在艾纳香叶片和嫩枝中的含量较低,范围在0.015%~0.220%[5],严重制约了艾纳香产业升级,选育出高含量的优良品种是其产业开发的重点。另一方面,多倍体植物具有器官“巨大性”,并且其营养成分及内源物质含量含量增加[6]。因此,培育四倍体植物新品种是中药材丰产优质的有效途径之一,特别是对于以单体化合物提取的某些药用植物而言意义重大。
前人对艾纳香的化学组成及提取工艺研究较多,如王秋萍等建立HPLC-RID同时测定艾纳香叶中左旋樟脑、左旋龙脑及异龙脑含量的方法[7];吴丽芬等人研究出建立GC法测定艾纳香油中β-蒎烯、芳樟醇、樟脑、L-龙脑、β-石竹烯5个成分的含量[8]。本课题组以艾纳香植株不同部位叶片和茎为材料,系统开展了总黄酮提取工艺优化方法研究,并确定了总黄酮含量测定的方法[9]。到目前为止,仍未见四倍体艾纳香诱导及倍性鉴定的研究报道。本研究应用组织培养技术,采用秋水仙素诱导艾纳香组培苗,产生变异体并对其进行倍性鉴定为研究内容,研究结果为艾纳香新品种选育提供科学依据。
1 材料与方法
1.1 材料
2013年4月,艾纳香一年生苗取自贵州罗甸,种植于北京中医药大学药用植物园。2013年5月,取艾纳香植株茎尖,经过75%乙醇30 s及0.1%升汞5 min消毒处理后,再用无菌水冲洗3次,在培养基MS+6-BA 1.0 %+NAA 1.5 %+蔗糖3% +琼脂1%(pH5.8)上诱导并继代培养。培养条件: 温度(25±2) ℃,光照强度1 000~1 500 lx,光照时间14 h/d。继代培养出的艾纳香组培苗应用于本研究。
1.2 方法
观察艾纳香组培苗生长动态,确定组培苗分裂旺盛期范围,绘制Logistic生长曲线。采用浸泡法和混合培养两种方法进行多倍体诱导,每种方法均设置若干组处理时间和浓度梯度,研究不同秋水仙素浓度及处理时间对诱变率的影响。
1.2.1 Logistic生长曲线
选取(0.2±0.02) g的艾纳香茎尖组织,在继代培养基上进行培养,每天取出称重,算出每天的增重量(g),绘出Logistic生长曲线。
1.2.2 秋水仙素诱导
浸泡法:在组培苗继代培养7 d后,挑选生长一致、茎节粗壮的组培苗,切成长1~2 cm的带节茎段,放入经过高压灭菌浓度为0.04%、0.06%、0.08%的秋水仙素溶液中,分别浸泡6 h、12 h、18 h,以无菌水浸泡为对照。将各处理后的材料用无菌水冲3遍后,培养在继代培养基上,培养30 d后及下一代进行死亡率和变异率调查。
混合培养法:在组培苗继代培养7 d后,选取生长一致、茎节粗壮的组培苗,切成长1~2 cm的带节茎段,接种到分别添加0.015%、0.025%、0.035%秋水仙素溶液的继代培养基上,分别经过5 d、7 d、9 d诱导培养后,将处理后的材料转入不含秋水仙素的继代培养基中继续培养,培养30 d后及下一代进行死亡率和变异率调查。
1.2.3 形态学考察
以二倍体为参照,对变异植株从形态学进行考察,包括株高、叶长、叶宽、叶厚、茎粗等指标。
1.2.4 细胞学考察
上午9:00~10:00取全展叶片,用水保湿,用镊子撕取叶片下表皮制片,用OLYMPUS 光学显微镜观测气孔及其保卫细胞的大小,并计算气孔密度。
1.2.5 细胞中DNA含量检测
采用流式细胞仪检测分析细胞中DNA含量,参考周玉丽等[10]和张虹等[11]的方法。将艾纳香嫩叶在盛有3 mL提取缓冲液的培养皿中剪碎,200目尼龙网过滤,1 000 r/min离心漂洗3次。制备的核悬液离心后弃去上层液体,加入2 mL染色缓冲液,暗处低温下染色10 min,500目尼龙网过滤,滤液用标准试管收集,随即上机测定。提取缓冲液成分:15 mol/L Tris-HCl (pH 7.5),80 mol/L KCl,20 mol/L NaCl,20 mol/L EDTA-Na2,15 mol/L 巯基乙醇,0.05%的 TritionX-100。染色缓冲液为提取缓冲液内加入20 mg/L RNA酶A和20 mg/L碘化丙啶。
2 结果与分析
2.1 Logistic生长曲线
艾纳香组培苗Logistic生长曲线如图1所示。图1表明,在接种第7 d时增重量最大,此时为植株细胞分裂旺盛期,故选择接种7 d左右的组培苗作为秋水仙素诱导的材料。
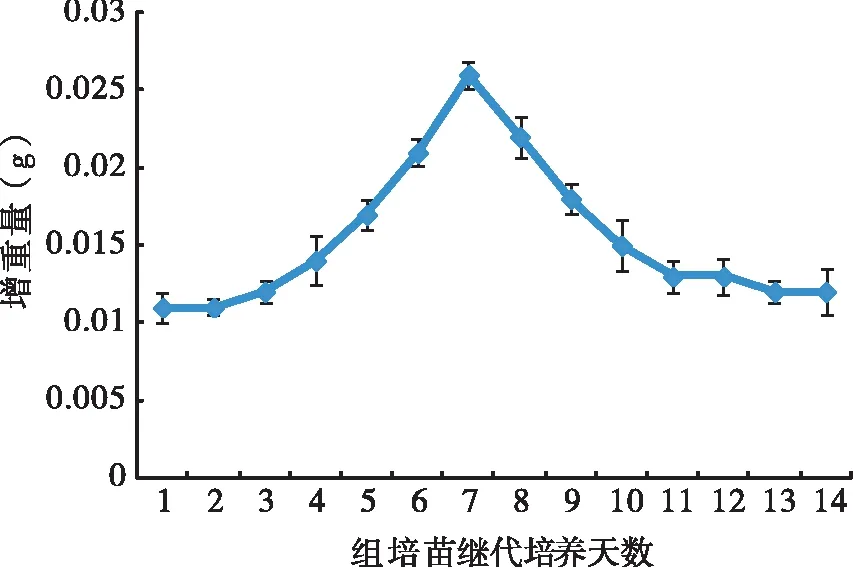
图1 艾纳香组培苗Logistic生长曲线
2.2 不同秋水仙素处理方法对艾纳香组培苗变异率的影响
以形态学和气孔变异显著作为变异的指标,考察秋水仙素浸泡法和混合培养法对艾纳香组培苗变异率的影响,结果如表1和表2所示。表1表明,在浸泡法处理中,秋水仙素浓度为0.06%、时间为12 h组合时,艾纳香组培苗的变异率最高,达到36.7%,以及子二代变异率也最高(63.3%)。表2表明,在混合培养法处理中,秋水仙素浓度为0.025%、时间为9 d组合时,艾纳香组培苗的变异率最高,达到65%,以及子二代变异率也较高(74.4%)。本研究结果表明,浸泡法和混合培养法均能有效的诱导艾纳香植株发生变异,以混合培养法更适合艾纳香植株诱变,其秋水仙素浓度为0.025%并处理7~9 d为宜。
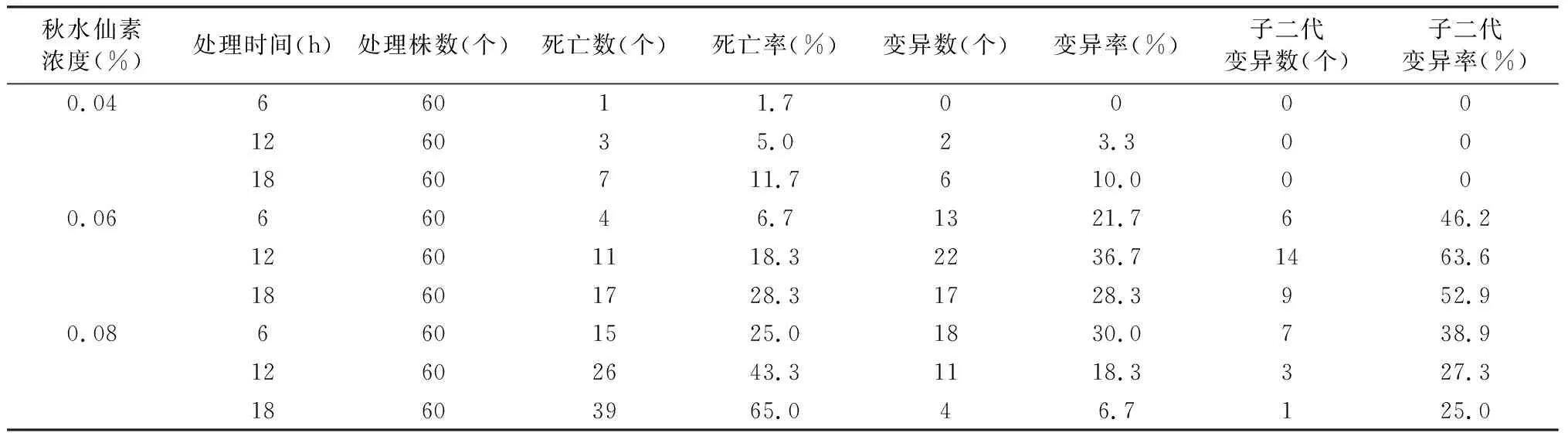
表1 秋水仙素浸泡法对艾纳香组培苗变异率的影响
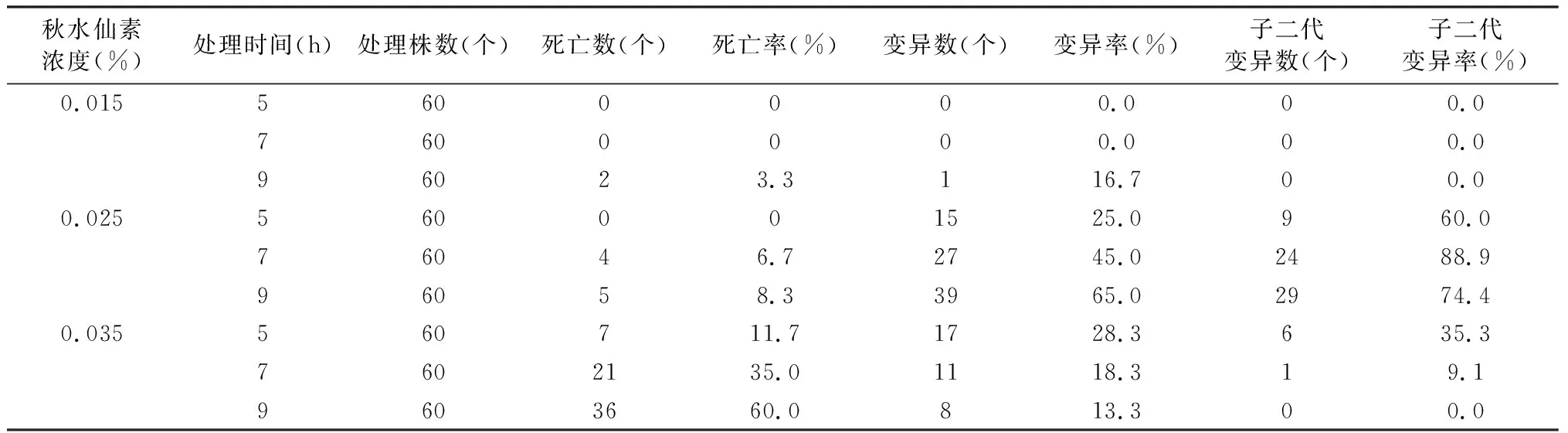
表2 秋水仙素混合培养法对艾纳香组培苗变异率的影响
2.3 形态学考察
与对照相比,经过秋水仙素处理的艾纳香变异植株的生长较为缓慢,株高较二倍体矮小了40.5%,而叶长、叶宽、叶厚及茎基部粗度较二倍体,分别显著或极显著增加了70.8%、96.5%、86.1%、53.8%(表3和图2)。

表3 二倍体和四倍体艾纳香组培苗的形态学比较

图2 二倍体(左)四倍体(右)艾纳香组培苗
2.4 细胞学考察
细胞学考察表明,四倍体艾纳香植株叶片气孔长径、短径以及保卫细胞长和宽,均较二倍体差异显著或极显著(表4)。表4表明,二倍体艾纳香植株叶片气孔为63.3 μm × 42.4 μm,而四倍体则为84.9 μm ×50.3 μm,极显著或显著增加34.1%和18.6%。同样,四倍体艾纳香植株叶片的保卫细胞的长和宽,较二倍体分别显著增加49.6%和47.1%。四倍体艾纳香植株叶片气孔密度为6.0个/mm2,极显著低于二倍体(6.0个/mm2)。

表4 二倍体和四倍体艾纳香组培苗的气孔及其保卫细胞比较
2.5 细胞DNA含量检测
流式细胞仪检验结果如图3所示。图3表明,直方图的纵坐标为细胞数(表示的是细胞的相对数),横坐标为道数(Channel No.),实质上是所测的荧光的强度。二倍体植株仅在相对荧光强度值为256的位置上出现1个单峰(图3左),而四倍体植株在约在512的位置上出现1个单峰(图3右),后者为前者的 2 倍,这表明四倍体植株细胞中的DNA 含量也相应增加了一倍,表明四倍体细胞中DNA含量已倍增,说明秋水仙素诱导四倍体艾纳香植株获得了成功。
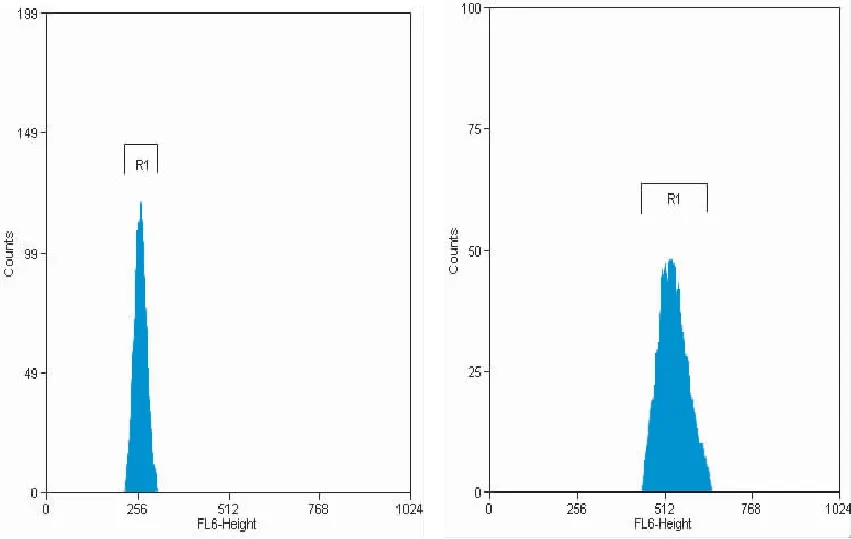
图3 二倍体(左)和四倍体(右)艾纳香组培苗叶片细胞中DNA含量
3 讨 论
艾纳香组培苗进行Logistic生长曲线表明,组培苗细胞的旺盛分裂期约在继代培养第6~8 d,故在此期诱导能够提高诱变成功率,这是本研究后续诱变成功的关键。
四倍体诱导率因秋水仙素浓度和处理时间不同而差异显著。在本研究中,混合培养法在 0.015%~0.025%浓度范围内,均表现出多倍体诱导率随处理时间的增加而升高,但随着处理时间延长,生长点都会受到严重伤害,组培苗的存活率降低;当浓度大于0.025%时,多倍体诱导率随处理时间的增加而降低且死亡率显著升高。在浸泡法中,秋水仙素的浓度变化对植株影响不如混培法明显,但是处理时间对植株的死亡率影响也很大,并且其诱变率明显低于混合培养法。本研究认为,与浸泡法相比,混合培养法更适合四倍体艾纳香诱导。
秋水仙素诱导的变异株表现为叶色变绿,叶片变大、变厚,茎段变粗等。同时,其气孔大小及密度均与二倍体有显著差异,这与相关研究报道相一致[12]。因此,根据形态学及细胞学上的显著差异进行多倍体初步筛选,再结合细胞中DNA含量及染色体数目检测是确定其倍性的有效方法。
本研究建立了诱导同源四倍体艾纳香的方法,通过继代培养获得了更多的四倍体无菌苗,现正在进行炼苗移栽,下一步进行田间观察与测试,期望筛选出药用成分含量高、丰产且抗逆性好的优良品种。

