黄芪甲苷与阿魏酸合用调控JAK-STAT通路促进血管内皮细胞增殖作用的研究
李玉梅,鲍慧玮,王楚盈*,张亚杰,韩 冬,潘建衡,方 晶,黄金秋,刘仲康
(1. 长春中医药大学药学院,长春 130117;2. 吉林大学化学学院麦克德尔米德实验室,长春 130012)
近年来,提出血管新生的概念,血管新生是机体正常发育和组织修复的基础,是一系列复杂的生物学行为。缺血性心脏病、糖尿病所致的伤口不易愈合等,其根本原因均与血管新生功能不良有关[1-2]。治疗性血管新生则是使机体在缺血或缺氧等状态下,通过修复以及重塑或是促进新生血管,改善缺血缺氧等病理状态。而在治疗性血管新生过程中,最关键环节则是内皮细胞的增殖、迁移和分化。
中医药在治疗性血管新生方面历史悠久,中医认为祛瘀血可以生新络,益气、活血、化瘀等药物均对血管新生具有一定疗效,如黄芪为传统的补气药,黄芪中的黄芪甲苷可以促进缺氧内皮细胞的增殖,有利于血管生成[3-4]。当归为补血药,当归中的阿魏酸则具有抑制血小板聚集,辅助建立侧枝循环,改善缺血区供血,促进血管再生。然而二成分合用如何促进新生血管,机制尚不完全明确,因此本实验采用氯化钴建立HUVECs缺氧损伤模型,探索黄芪甲苷与阿魏酸合用对血管生成影响的潜在机制,为临床治疗与血管新生相关疾病奠定基础。
1 材料和方法
1.1 实验材料
人脐静脉内皮细胞(HUVECs)(上海澳赛尔斯生物技术有限公司)。
1.2 主要试剂与仪器
阿魏酸(纯度> 98%,批号:GR-134-170925,南京广润生物制品有限公司);黄芪甲苷(纯度> 98%,批号:150202,成都锦泰和医药化学技术有限公司);HUVECs完全培养液(批号:170521,澳赛尔斯生物技术有限公司);HUVECs基础培养基(批号:170525,澳赛尔斯生物技术有限公司);胰蛋白酶(批号:42H10121,北京鼎国昌盛生物技术有限责任公司;CCK-8(上海翊圣生物科技有限公司);BD MatrigelTMBasement Membrane Matirx基质膜(批号:7345017,Corning Incorporated);AG490(批号:X15A7Y19393,上海源叶生物科技有限公司)。SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司);MCO-18AIC二氧化碳培养箱(日本三洋公司);YLD-6000恒温震荡培养箱(江苏金坛市亿通电子有限公司);XI5300荧光倒置显微镜(日本Olympus);酶标仪(美国伯乐公司);TDL-80-2B低速离心机(上海安亭科学仪器厂);WD-9405B水平摇床(北京六一);DYY-7C电泳仪(北京六一);DYCZ-40D转移槽(北京六一);DYCZ-24DN北京双垂直蛋白电泳仪(北京六一);WD-9413B凝胶成像系统(北京六一)。
1.3 实验方法
1.3.1 内皮细胞培养及给药处理
HUVECs接种于96孔板,置于37℃、5% CO2培养箱中培养24 h,吸弃培养液各给药组进行如下操作:①正常对照组:给予等体积的基础培养基;②模型对照组:给予氯化钴250 μmol/L;③黄芪甲苷组,给予终浓度为250 μmol/L氯化钴及50 μmol/L的黄芪甲苷;④阿魏酸组,给予终浓度为250 μmol/L氯化钴及100 μmol/L的阿魏酸;⑤黄芪甲苷+阿魏酸合用组:给予终浓度为250 μmol/L氯化钴、50 μmol/L的黄芪甲苷及100 μmol/L的阿魏酸。⑥AG490组:给予100 μmol/L AG490;⑦黄芪甲苷+阿魏酸组+ AG490组:给予终浓度为100 μmol/L AG490、50 μmol/L的黄芪甲苷及100 μmol/L的阿魏酸,上述各组,继续培养24 h。
1.3.2 内皮细胞增殖检测
药物干预结束后采用CCK-8法检测各组细胞活力,吸出含药培养基,每孔中重新加入100 μL内皮细胞完全培养基及10 μL CCK-8溶液,继续培养1 h后,采用酶标仪,检测波长为450 nm测定各组细胞吸光度值。采用死活细胞染色技术,观察死活细胞情况,将钙黄素及碘化丙啶(PI)染色液加依次加到细胞孔中,37℃培养箱内放置5 min。吸弃染色液,在荧光倒置显微镜下观察,活细胞为绿色,死细胞为红色,拍照记录。
细胞存活率(%)=各组吸光度值/正常对照组吸光度值×100%。
1.3.3 荧光染色观察内皮细胞形态
HUVECs按1.3.1方法处理后使用4%多聚甲醛溶液进行细胞固定,每孔加入100 μL罗丹明标记的鬼笔环肽(TRITC phalloidin)工作液,室温避光孵育30 min,用PBS清洗3次,100 μL DAPI溶液对细胞核进行染色,约30 s,在倒置荧光显微镜下观察细胞形态的变化。
1.3.4 细胞迁移实验
接种细胞前先用标记笔在24孔板各孔底部划井字线,调整细胞浓度并接种于24孔板,培养24 h,待细胞铺满整个培养孔底部,吸弃培养液,用1 mL移液枪头沿中轴划一道划痕,用PBS清洗细胞表面2次除去漂浮的细胞,同时进行划痕部位拍摄,拍摄后按1.3.1方法给药,继续培养24 h,在同一位置再次拍照,用Image J图像处理软件测量迁移距离,与自身划痕距离作对比,计算迁移率,判断细胞的生长运动能力。
1.3.5 内皮细胞体外成管实验[5]
基质胶至于4℃冰箱,冰浴过夜进行解冻。将基质胶铺于96孔板中每孔50 μL,放置于培养箱30 min使其凝固。将细胞用含药培养基配置成细胞悬液,接种于基质胶上,每孔50 μL,培养箱中培养4 h,于倒置显微镜下观察微管形成情况,选取6个不同视野,记录平均节点数。
1.3.6 Western blot检测p-JAK2和p-STAT3蛋白的表达
将HUVECs调整浓度至每孔1 × 105个,置于6孔板中,按照1.3.1中方法进行处理,给药培养24 h后,吸弃培养液,加入蛋白裂解液,冰上静置5 min,低温冷冻离心,12 000 r/min 4℃离心10 min。分离上清为所得的蛋白质抽提物,用5× loading buffer和PBS稀释蛋白样品,于沸水浴中煮沸5 min。行聚丙烯酰胺凝胶电泳,转印,用TBST缓冲液配制5%(质量/体积)脱脂奶粉封闭1 h,孵育一抗分别为p-JAK2抗体、p-STAT3抗体,孵育二抗为羊抗兔IgG,TBST漂洗后进行ECL底物发光。将胶片进行扫描,用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.4 统计学方法
2 实验结果
2.1 黄芪甲苷与阿魏酸合用对氯化钴损伤的HUVECs增殖的影响结果
实验结果显示,经过氯化钴处理后的HUVECs的存活率(模型组)明显低于对照组(P< 0.05)。阿魏酸、黄芪甲苷干预后细胞存活率有所增加。二药合用与单独给药相比,细胞存活率显著增加(P< 0.001)。给予AG490通路抑制剂后,明显抑制细胞增殖,给予阿魏酸、黄芪甲苷两药后,与AG490组比较,细胞明显增多。两药合用具有明显的拮抗AG490对内皮细胞的抑制作用(表1)。死活细胞染色结果与酶标仪检测结果一致(图1)。
表1 药物对HUVECs细胞活力的影响Table 1 Effects of drugs on the viability of HUVECs
注:与对照组比较,▲P< 0.05;与模型组比较,*P< 0.05,**P< 0.01,***P< 0.001;与AG490组比较,#P< 0.05,##P< 0.01。
Note. Compared with the control group, ▲P< 0.05. Compared with the model group,*P< 0.05,**P< 0.01,***P< 0.001. Compared with the AG490 group,#P< 0.05,##P< 0.01.
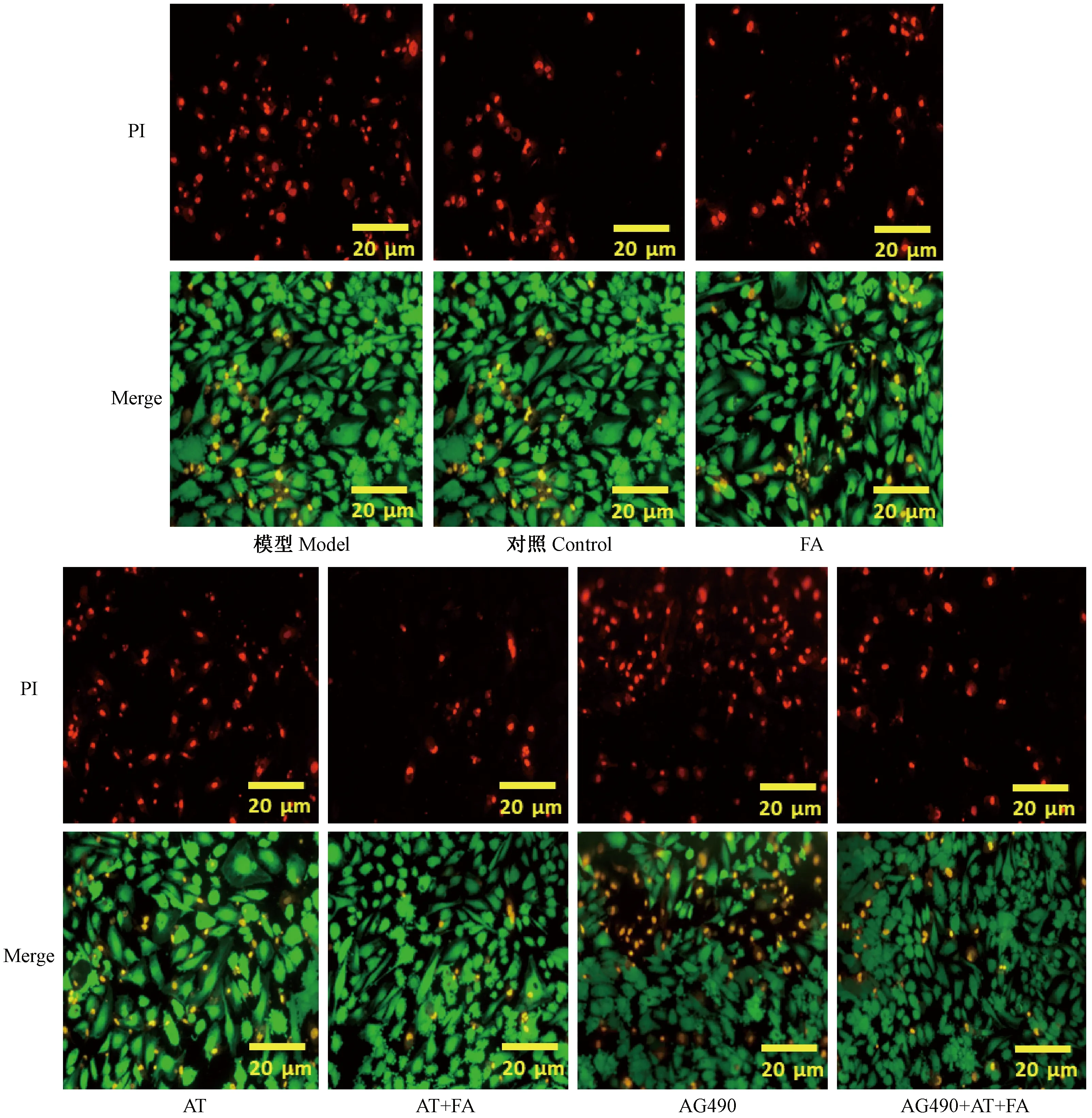
注:FA:阿魏酸;AT:黄芪甲苷。红色为死细胞;绿色为活细胞。图1 死活细胞染色结果(× 100)Note. FA: ferulic acid; AT: astragaloside IV. Red indicates dead cells; Green indicates living cells.Figure 1 Staining results of living and dead cells
2.2 阿魏酸与黄芪甲苷合用对缺氧损伤HUVECs形态的影响结果
由荧光染色结果显示(图2),氯化钴刺激后,对细胞造成损伤,细胞狭长,出现皱缩,骨架缩小等,有些细胞甚至未见明显的细胞骨架(见模型组)。对照组细胞贴壁良好。给予黄芪甲苷、阿魏酸之后,细胞形态有所改善,细胞扁平,成多角形,有伪足,纤维蛋白丝清晰可见。给予AG490后,细胞也出现皱缩现象,细胞数与对照组比较明显减少,给予黄芪甲苷及阿魏酸后,细胞形态和数量均有所改善。黄芪甲苷与阿魏酸具有促进细胞增殖,改善细胞形态的作用,联合使用,效果更佳。
2.3 阿魏酸与黄芪甲苷合用对缺氧损伤HUVECs迁移能力的作用结果
与自身划痕距离做对比进行计算迁移率,结果显示,对照组细胞迁移率为49.52%,模型组由于氯化钴造成缺氧损伤,细胞的迁移能力下降,细胞修复至中央划痕区的迁移率仅为12.98%。经黄芪甲苷及阿魏酸干预后,细胞的划痕修复距离有所增加,黄芪甲苷、阿魏酸、黄芪甲苷+阿魏酸合用组均为100%,划痕区域均长满细胞。给予AG490后,细胞迁移距离为13.45%,同时给予黄芪甲苷和阿魏酸,间隙缩小,迁移距离为52.12%。黄芪甲苷与阿魏可促进缺氧HUVECs的迁移运动(结果见表2,图3)。
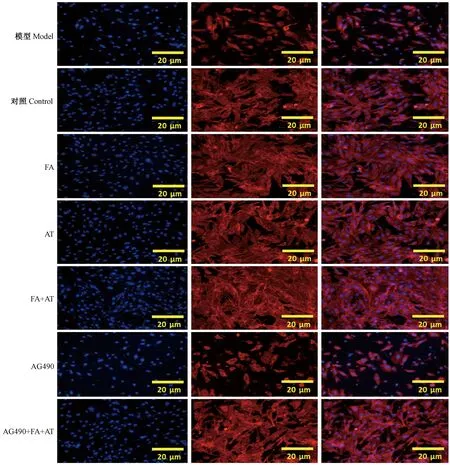
注:FA:阿魏酸;AT:黄芪甲苷。红色为纤维蛋白丝;蓝色为细胞核。图2 各给药组对HUVEC细胞形态的影响(× 100)Note. FA: ferulic acid; AT: astragaloside IV. Red indicates fibrin filament; Blue indicates nucleus.Figure 2 Protective effect of the drugs on endothelial cells in each group
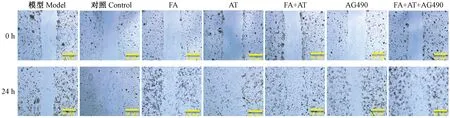
注:FA:阿魏酸;AT:黄芪甲苷。标尺=50 μm。图3 药物对HUVEC细胞迁移测定的影响(× 40)Note. FA: ferulic acid; AT: astragaloside IV.Bars=50 μm.Figure 3 Effects of the drugs on HUVEC migration
2.4 阿魏酸与黄芪甲苷合用体外成管作用的结果
如图4所示,所有组的HUVECs在24 h后形成了毛细血管状结构的网状结构。与对照组相比,黄芪甲苷、阿魏酸以及两药合用成管能力均有所增加,尤以两药合用效果较好,管的长度和节点均可见明显增加(表3)。给予AG490后成管能力与对照组比较明显降低,同时给予黄芪甲苷及阿魏酸后,成管能力增加。可见,两药合用,有利于体外血管生成。
2.5 p-JAK2和p-STAT3蛋白的表达结果
Western blot结果显示,模型组给予氯化钴后,由于造成缺氧损伤,激活JAK-STAT信号通路,p-JAK2和p-STAT3蛋白的表达有所增加,黄芪甲苷、阿魏酸处理后,p-JAK2和p-STAT3蛋白的表达进一步增加。AG490抑制JAK信号通路,因此给药后,p-JAK2和p-STAT3蛋白的表达降低,阿魏酸及黄芪甲苷,可明显拮抗AG490对p-JAK2和p-STAT3蛋白的表达的抑制情况,给药后p-JAK2和p-STAT3蛋白的表达明显增加(结果见图5,图6)。
表2 药物对HUVEC细胞迁移测定的影响Table 2 Effects of the drugs on HUVEC migration
注:与对照组比较,▲P< 0.05,▲▲P< 0.01;与模型组比较,*P< 0.05,**P< 0.01,***P< 0.001;与AG490组比较,#P< 0.05,##P< 0.01,###P< 0.001。
Note. Compared with the control group, ▲P< 0.05, ▲▲P< 0.01. Compared with the model group,*P< 0.05,**P< 0.01,***P< 0.001. Compared with the AG490 group,#P< 0.05,##P< 0.01,###P< 0.001.

注:FA:阿魏酸;AT:黄芪甲苷。图4 体外成管情况(× 40)Note. FA: ferulic acid; AT: astragaloside IV.Figure 4 Angiogenesis in vitro
表3 药物对HUVEC细胞体外成管作用结果Table 3 Effects of the drugs on HUVEC angiogenesis in vitro
注:与对照组比较,▲P< 0.05,▲▲P< 0.01;与模型组比较,*P< 0.05,**P< 0.01,***P< 0.001;与AG490组比较,#P< 0.05。
Note. Compared with the control group,▲P< 0.05,▲▲P< 0.01. Compared with the model group,*P< 0.05,**P< 0.01,***P< 0.001. Compared with the AG490 group,#P< 0.05.
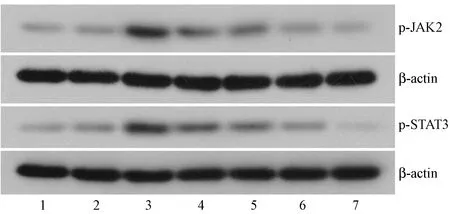
注:1:对照组;2:模型组;3:黄芪甲苷+阿魏酸组;4:阿魏酸组;5:黄芪甲苷组;6:黄芪甲苷+阿魏酸+ AG490组;7:AG490组。图5 阿魏酸与黄芪甲苷合用对缺氧损伤HUVEC细胞p-JAK2和p-STAT3蛋白表达的影响Note. 1: Control group; 2: Model group; 3: Astragaloside IV + ferulic acid group; 4: Ferulic acid group; 5: Astragaloside IV group; 6: Astragaloside IV + ferulic acid + AG490 group; 7: AG490 group.Figure 5 Effect of astragaloside IV combined with ferulic acid on the p-JAK2 and p-STAT3 protein expression in HUVECs
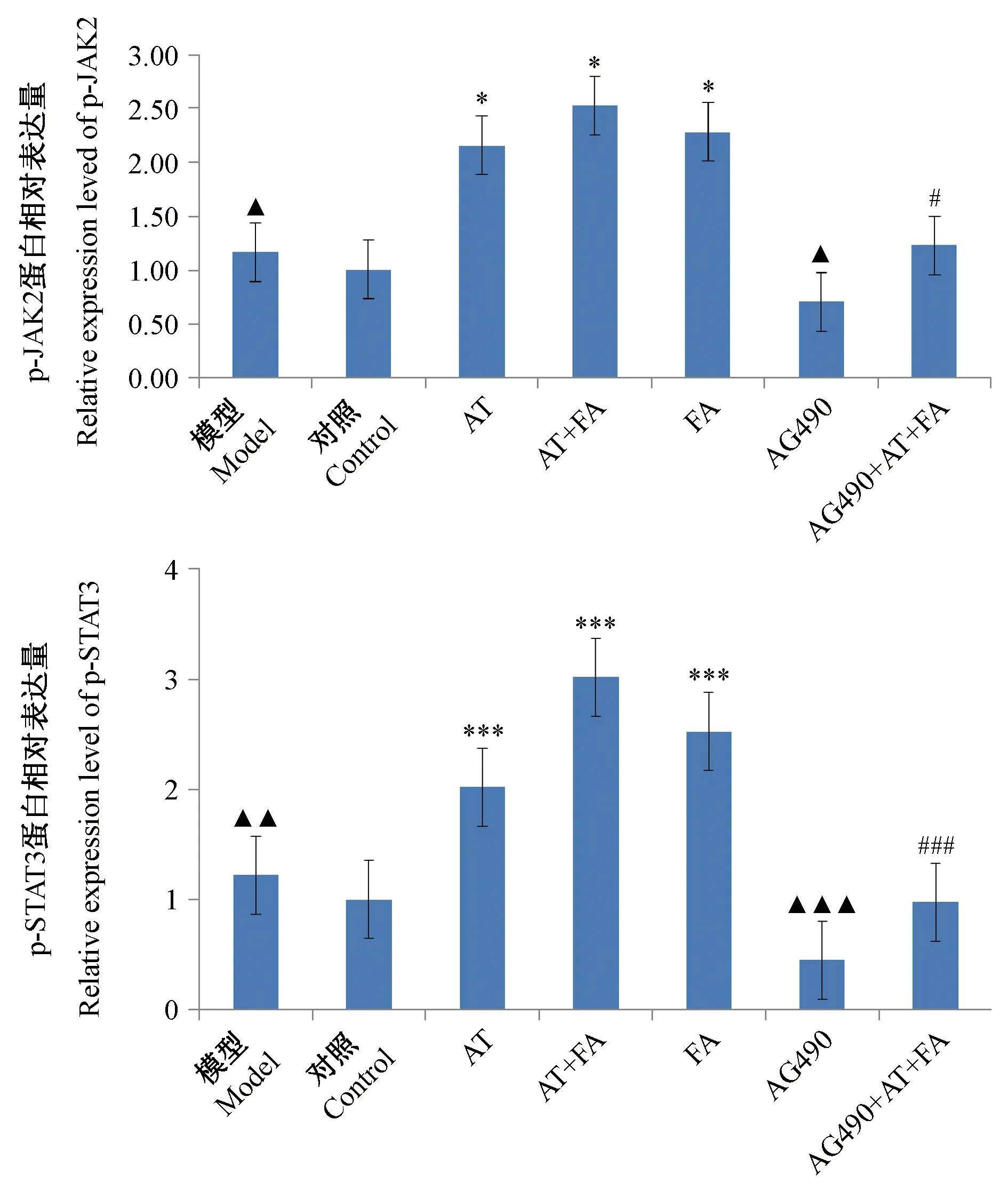
注:FA:阿魏酸;AT:黄芪甲苷。与对照组比较,▲ P< 0.05,▲▲ P< 0.01,▲▲▲ P< 0.001;与模型组比较,*P< 0.05,**P< 0.01,***P< 0.001;与AG490组比较,# P < 0.05,## P < 0.01,### P < 0.001。图6 阿魏酸与黄芪甲苷合用对缺氧损伤HUVEC细胞p-JAK2、p-STAT3蛋白灰度分析结果Note. FA: ferulic acid; AT: astragaloside IV. Compared with the control group, ▲ P< 0.05, ▲▲ P< 0.01, ▲▲▲ P< 0.001. Compared with the model group,*P< 0.05,**P< 0.01,***P< 0.001. Compared with the AG490 group,# P < 0.05,## P < 0.01,### P < 0.001.Figure 6 Effect of astragaloside IV combined with ferulic acid on p-JAK2 and p-STAT3 protein expression levels in the HUVECs
3 讨论
血管新生的概念早在《内经》中就有所记载,即:“生新祛瘀”。生新祛瘀是机体的正常生理功能,相当于血液系统的新陈代谢,也可理解为新的血管的再生,即在已有的血管床上,促进内皮细胞发芽长出新支,形成血管网。血管生成不仅与血管内皮细胞的增殖有关,还与血管内皮细胞的迁移和管腔的形成密切相关[6]。阿魏酸是中药当归的主要活性物质,广泛的存在于植物中的一种酚酸成分,现代药理作用研究表明其具有明显的抗血栓、抗氧化等功能[7-9]。无论在常氧或是缺氧状态下,阿魏酸均能促进人脐静脉内皮细胞的增殖、迁移和管腔形成,其对细胞的调节功能可能与ERK1/2信号通路调节VEGF、HIF-1α基因等的表达有关[10-11]。黄芪甲苷是黄芪的主要药效物质,具有显著的促受损心肌组织血管新生以及内皮细胞增殖的作用,其机制与PI3K/Akt信号通路有关[3-4, 12]。联合使用两药,可以作用于疾病网络中多个靶点,对各靶点的作用产生协同效应,达到最佳的治疗效果。为了探究两药合用,调控血管新生作用的协同机制,我们建立了氯化钴所致的内皮细胞缺氧模型,研究两药合用对内皮细胞血管形成的影响。本实验通过预实验筛选确定黄芪甲苷与阿魏酸的给药剂量,采用氯化钴致内皮细胞缺氧模型,考察黄芪甲苷与阿魏酸合用对缺氧损伤细胞的保护作用以及促进血管生成的作用,CCK-8检测与死活细胞染色结果表明,阿魏酸组、黄芪甲苷组以及合用组均能提高细胞存活率,两药均可保护受损细胞,使细胞形态保持完整,尤以黄芪甲苷与阿魏酸联合作用最强具有协同作用。体外成管及迁移实验中可看出,黄芪甲苷、阿魏酸均有明显的促进内皮细胞迁移以及成管的能力。
JAK-STAT信号通路是重要的信号转导途径之一,广泛调节多种疾病的生理过程以及病理过程,参与细胞的增殖、分化、凋亡等许多重要的生物学过程[13]。JAK2-STAT3信号通路与血管新生作用关系密切,参与了血管内皮功能的调节作用[14-15]。JAK2-STAT3激活后,STAT3磷酸化明显增加,明显上调HIF-1α和VEGF,促进内皮细胞的迂移和血管的形成,有利于血管新生[16-20]。本研究采用Western blot法,从蛋白水平上检测细胞内p-JAK2、p-STAT3的表达情况,结果显示给予JAK2抑制剂AG490后,p-JAK2、p-STAT3较正常血管内皮细胞表达明显减少,黄芪甲苷与阿魏酸联合给药能显著诱导JAK2磷酸化表达增加,STAT3磷酸化表达上调,明显削弱了AG490对JAK-STAT信号通路的抑制作用。可见,黄芪甲苷与阿魏酸联合应用具有促进缺氧内皮细胞增殖、迁移、成管的能力,对缺氧细胞的形态起到保护作用,有利于血管生成,两者促进血管新生的机制可能与JAK2-STAT3信号通路有关。

