阿司匹林对控制大鼠盐敏感性高血压的作用机制研究
刘 雪,杨宇辉,付 慧,刘 星,姜晓亮,杨志伟*
(1. 中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021;2. 北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021;3. 首都医科大学,北京 100069)
原发性高血压是一种慢性复杂疾病,我国目前高血压患者已有2亿多人,其中盐敏感性高血压患者约占总患者的60%[1],这些盐敏感性患者往往伴有动脉粥样硬化、脑卒中等严重的靶器官损伤[1-3]。有研究表明,高盐能够刺激血管内皮产生炎症因子,进而诱发血管炎症[4-5]。血小板活化能够通过诱导炎症反应参与内皮功能损伤、血管硬化和血管炎症等血管病变,促进盐敏感性高血压以及多种心脑血管疾病的发生发展[6-10]。临床研究发现,盐敏感性高血压患者体内血小板活性增强[11]。阿司匹林作为一种抗血小板药物,近年来在心血管领域的应用越来越广泛。2016年,美国已经将阿司匹林作为心血管疾病的一级预防用药[12],这再次引起了国内外对阿司匹林的关注。阿司匹林是否能抑制盐敏性高血压的发生发展,在国内外还没见报道。本研究旨在探讨阿司匹林是否能够抑制高盐诱导的高血压的发生发展及其相关机制,为高血压及其靶器官损伤的防治探索新的依据和参考。
1 材料和方法
1.1 实验动物
SPF级雄性血压盐敏感性Dahl SS大鼠及其对照血压盐耐受性SS-13BN大鼠从北京维通利华实验动物中心购买[SCXK (京) 2016-0006]。实验在中国医学科学院医学实验动物研究所屏障环境动物房开展[SYXK (京) 2015-0035]。动物实验方案获实验动物使用与管理委员会(IACUC)的批准[ILAS-YZW2016004]。实验动物饲养于屏障环境中,光照、温度、湿度设置严格参照我国实验动物环境标准。实验过程中严格遵循实验动物使用的3R原则,给予人道主义关怀。将2月龄Dahl SS大鼠(平均体重190±10 g)以及SS-13BN大鼠(平均体重 185.1±9 g),各自随机分为三组,即低盐组(0.12% NaCl,8只)、高盐组(8% NaCl, 10只)、高盐加阿司匹林灌胃组(8% NaCl+10 mg/(kg·d), 10只),6组大鼠体重差异无显著性(P>0.05),喂养至8周,期间在清醒状态下用尾袖法连续测量大鼠血压。8周后采用颈总动脉插管测量血压,2%戊巴比妥钠麻醉大鼠,取大鼠皮肤、肾、动脉血管,分别检测M2型巨噬细胞的数量、相关炎症因子和血管蛋白的表达。
1.2 主要试剂与仪器
阿司匹林(7293748372)和羧甲基纤维素(S14015-250 g)购自美国Sigma公司;Anti-Mannore Receptor (ab64693)、Anti-Von Willebrand Factor antibody (ab6994) 购自英国Abcom公司; eNOS(#32027)、IL-6单克隆抗体 (#12912) 购自美国Cell Signaling Technology公司;Goat anti rabbit IgG-HRP (sc-2004)、 TNF-α单克隆抗体 (sc-52746)、L-1β多克隆抗体购自美国Santa Cruz (sc-7884) 公司;BCA蛋白浓度测定试剂盒(增强型)(P0010)购自中国碧云天公司;Trizol 购自美国 Invitrogen 公司;DEPC 水购自美国 QIAGEN 公司;BP2000无创血压检测仪购自美国Visitech Systems公司;PCR 仪购自美国 Bio-Rad 公司;化学发光凝胶成像仪(Tanon-5500)购自上海天能公司;Multiskan Go全波长酶标仪购自美国Thermo公司; ABI stepone 荧光定量 PCR 仪购自美国Thermo公司。
1.3 实验方法
1.3.1 Real-time PCR检测肾组织炎症因子表达
取少量肾组织(100~200 mg)放于5 mL EP管中,加入1 mL的TRIzol,放入搅拌器中充分研磨。加入200 μL 氯仿,用带滤芯的枪头移至干净的1.5 mL EP管中混匀。冰上静止5 min,4℃,16 000 r/min,离心30 min,取上清。加入500 μL异丙醇混匀后,室温静置10 min,11 235 r/min离心10 min弃上清。加入500 μL DEPC水稀释的75%的乙醇,4℃,12 000 r/min,离心5 min,弃上清。超净台晾干,加入适量的DEPC水稀释得RNA。使用RNA反转录试剂盒将RNA逆转录为cDNA,并用One-stop PCR仪检测其IL-1β、IL-6、TNF-α的mRNA表达。
1.3.2 免疫荧光检测皮肤巨噬细胞浸润
大鼠皮肤用福尔马林固定后,修块、脱水、包埋、切片(厚度为4 μm),用Xylene、逐步降低的Ethanol浓度(分别100%、95%、75%)和PBS使组织切片脱蜡、再水化。皮肤组织用0.1% Triton X-100、10 mM sodium citrate (pH 6.0)、3% H2O2,处理,然后用含10% 血清的PBS在4℃过夜孵育。用MR(1∶100稀释)在室温孵育1 h后用Vector VIP substrate kit (Vector)试剂盒,逐步进行二抗孵育、DAPI封片后,最后显微镜下观察、拍片。
1.3.3 免疫印迹检测血管蛋白表达
提取大鼠胸主和腹主动脉血管全蛋白,用BCA法检测蛋白浓度。采用10%聚丙烯酰胺凝胶电泳,流转至硝酸纤维素膜,封闭液(0.1%缓血酸铵缓冲液配制5%脱脂奶粉)室温封闭2 h,加抗eNOS和vWF特异性抗体4℃孵育过夜,0.1%缓血酸铵缓冲液洗膜3次后加辣根过氧化物标记的IgG室温孵育1 h,洗膜3次后,化学发光凝胶成像仪自动曝光显影后使用Image J软件分析灰度,结果以目的蛋白/β-actin灰度值比值表示蛋白质的相对表达水平。
1.4 统计学方法
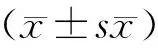
2 结果
2.1 阿司匹林可显著降低高盐诱导的Dahl SS大鼠的血压
大鼠动脉血压连续测量结果显示,实验开始前三周,正常盐组、高盐组、高盐同时给与阿司匹林灌胃组的Dahl大鼠血压无明显差异,从第四周开始,高盐组大鼠血压较正常盐组大鼠血压呈现大幅增长的现象,高盐加阿司匹林灌胃组大鼠较高盐组大鼠血压有明显较低的趋势(表1)。八周之后采用颈总动脉插管测量血压,结果显示与正常组相比高盐喂养导致Dahl SS大鼠平均动脉压血压由(146±7.3)mmHg升高至(201±11.2) mmHg(P<0.05),给予阿司匹林灌胃之后发现大鼠血压由(201±11.2)mmHg降低至(169±5.6)mmHg(P<0.05)。而高盐和阿司匹林对SS-13BN大鼠的血压并无影响(图1,表2)。这表明阿司匹林能够降低Dahl SS大鼠有由高盐诱导的血压增高。
2.2 阿司匹林减少了肾组织炎症因子的表达
炎症反应是高血压发生发展的一个重要病理机制。因此,我们检测了肾组织中的炎症因子。结果显示Dahl SS大鼠高盐喂养之后,随着血压的升高,其肾组织中IL-1β、IL-6、TNF-α的mRNA表达增加,阿司匹林能够抑制Dahl SS大鼠肾组织高盐诱导的炎症因子的增加(见图2)。
2.3 阿司匹林增加皮肤中M2型巨噬细胞的数量
为了进一步探讨阿司匹林是否能抑制机体炎症反应,我们检测了Dahl SS大鼠皮肤中M2型巨噬细胞的表达数量,结果表明,给予高盐处理之后Dahl大鼠皮肤中的M2型巨噬细胞数量较正常盐组相比显著减少,而给予阿司匹林灌胃干预之后,Dahl大鼠皮肤巨噬细胞的浸润数量显著增加,这表明阿司匹林能够有效缓解高盐诱导的M2型巨噬细胞数量的减少(见图3)。

表1 盐敏感性高血压大鼠血压情况Table 1 Blood pressure of Dahl salt sensitive rats
注:尾袖法连续八周检测清醒状态下盐敏性高血压大鼠动脉血压,即收缩压以及舒张压。
Note. The arterial blood pressure including systolic pressure and diastolic pressure of Dahl salt-sensitive rats (DSS) was measured by the tail cuff method in an awake state.

表2 盐耐受性高血压大鼠血压情况Table 2 Blood pressure of salt resistance rats
注:尾袖法连续八周检测盐耐受性大鼠清醒状态下动脉血压,包括收缩压以及舒张压.
Note. The arterial blood pressure including systolic pressure and diastolic pressure of Dahl salt-sensitive rats (13-BN) was measured by the tail cuff method in an awake state.

注:LS:低盐饮食组,0.12% NaCl;HS:高盐饮食组,8% NaCl;HS + ASA:高盐饮食(8% NaCl)加阿司匹林灌胃组(10 mg/(kg·d))。下图同。第56天采用颈总动脉插管测量大鼠动脉血压。与LS组、HS + ASA组相比,*P< 0.05(one-way ANOVA)。图1 阿司匹林对高盐诱导的Dahl SS大鼠高血压的影响Note: LS: low-salt diet, 0.12% NaCl; HS: high-salt diet, 8% NaCl; HS + ASA: high-salt diet (8% NaCl) plus aspirin gavage (10 mg/(kg·d)). The same in the following figures. Blood pressure was measured by the tail cuff method at day 56. Compared with LS group, HS + ASA group,*P< 0. 05 (one-way ANOVA).Figure 1 The effect of aspirin on blood pressure in Dahl SS rats with a high-salt diet

注: IL-1β:白介素-1β; IL-6:白介素-6;TNF-α:肿瘤坏死因子-α。第56天取材RT-PCR检测炎症因子。与LS组、HS + ASA组相比,*P< 0.05(one-way ANOVA)。图2 阿司匹林对高盐诱导的Dahl SS大鼠肾组织炎症因子表达的影响Note. IL-1β: interleukin-1β; IL-6: interleukin-6; TNF-α: tumor necrosis factor-α. Inflammatory factors were measured at day 56 by RT-PCR. Compared with the LS group, HS + ASA group,*P< 0. 05 (one-way ANOVA).Figure 2 The effect of aspirin on the mRNA expressions of renal inflammatory factors in Dahl SS rats with a high-salt diet

注:MR:M2型巨噬细胞表面特定的标志分子甘露糖受体。图3 阿司匹林对高盐诱导的Dahl SS大鼠皮肤M2型巨噬细胞数量的影响(× 200)Note. MR: mannose receptor, a specific maker of M2 macrophages.Figure 3 The effect of aspirin on the number of M2 macrophages in the skin of Dahl SS rats with a high-salt diet
2.4 阿司匹林能够改善血管内皮功能
为了探讨阿司匹林是否能通过改善血管功能降低血压,我们检测了Dahl-SS大鼠血管内皮表达的血管舒张促进蛋白一氧化氮合酶(eNOS)和血管损伤标志物血管性血友病因子(von Willebrand factor,vWF)的表达。结果显示,较低盐组相比,高盐喂养的Dahl大鼠血管一氧化氮合酶(eNOS)表达显著降低,血管性血友病因子(vWF)表达显著增高(P<0.05),表明阿司匹林能够抑制高盐诱导的Dahl-SS大鼠血管内皮eNOS表达的降低(见图4A)和vWF表达的增加(见图4B)。

注:eNOS:内皮一氧化氮合酶;vWF:血管性血友病因子。与LS组、HS + ASA组比较,*P< 0.05(one-way ANOVA)。图4 阿司匹林对高盐诱导的Dahl SS大鼠血管内皮功能的影响Note. eNOS: endothelial nitric oxide synthase; vWF: von Willebrand factor. Compared with LS group, HS + ASA group,*P < 0.05 (one-way ANOVA).Figure 4 The effect of aspirin on vascular endothelium function in Dahl SS rats with a high-salt diet
3 讨论
盐敏感性高血压是指相对高盐摄入引起的血压增高,其发病机理包括血管的收缩、机体的钠水潴留、血管炎症反应等[13]。巨噬细胞作为炎症反应的主要作用细胞,在不同条件下,有着明显的形态和功能差异。M1型巨噬细胞一般是通过干扰素-γ及细菌脂多糖LPS活化,M1主要分泌促炎因子;而M2型巨噬细胞通过Th2细胞因子进行活化,M2表达抑制炎症因子,起着抑制炎症反应以及组织修复的作用。高盐引起高血压的同时,也可诱导脑血管、心脏和肾等靶器官的损伤[8]。本研究发现,高盐饮食诱导Dahl SS大鼠血压升高的同时,增加了肾组织炎症因子IL-1β、IL-6、TNF-α及血管vWF因子的表达,减少了皮肤M2型巨噬细胞数量及血管eNOS的表达;阿司匹林能够明显降低Dahl SS大鼠高盐诱导的血压升高、炎症反应及血管功能的损伤。我们的研究表明阿司匹林能够通过抑制血小板活性,抑制血管的炎症反应,从而抑制高盐诱导的高血压的发生发展及其血管功能的损伤。
血小板是由骨髓造血组织中的巨核细胞产生的一种无核的细胞成分,越来越多的研究表明血小板在炎症反应中起着重要的作用[14],阿司匹林是最广泛使用的抗血小板药物,不可逆地抑制血小板内COX-1和COX-2的活性,阻断花生四烯酸产生TXA2,抑制血小板的聚集[15]。临床常用抗血小板药物阿司匹林预防和治疗冠状动脉疾病和其他血管疾病,主要是由于阿司匹林可抑制血小板COX-1活性,降低血小板活化率,减少血清P-selectin、TXA2的表达及炎症因子IL-6等的表达,降低炎症反应,参与稳定性冠状动脉疾病的治疗[16-18]。阿司匹林能够抑制氧化应激,降低原发性高血压和血管紧张素II诱导的高血压[19]。本研究发现,高盐能够刺激血管内皮并激活血小板从而引发血管炎症反应,而阿司匹林可以抑制该过程的发生发展,表明阿司匹林在抑制血小板聚集的同时,也具有抑制血小板活性的功能。该结果证实阿司匹林通过抑制血小板活性,能够缓解血管内皮炎症反应和内皮损伤。
血管功能老化是导致高血压的根本因素。本研究发现,高盐能够诱导活化的血小板与血管性血友病因子(VWF)结合并黏附到血管内皮细胞上[20],这种相互作用会引起的内皮表面白细胞的黏附并分泌TNF-α等炎症因子,促进炎症反应的发生发展,使得血管内皮受到损伤,导致内皮eNOS分泌减少,最终导致血管老化及功能受损而导致高血压。我们的研究发现,阿司匹林通过抑制高盐诱导的血小板活性,抑制炎症反应导致的血管功能损伤,从而抑制盐敏感性高血压的发生发展,为盐敏感性高血压的防治提供了新的防治思路。但是,高盐如何导致血小板活化,以及血小板活化后如何通过炎症反应导致高血压的发生发展的具体机制还需要进一步研究。

