耐碳青霉烯粘质沙雷菌耐药基因及分子流行病学研究
袁 园, 陈继中, 潘亚萍, 徐元宏, 王中新
粘质沙雷菌(Serratiamarcescens,SM)是兼性厌氧革兰阴性杆菌,属肠杆菌科沙雷菌属,是一种广泛分布于自然界和医院环境中的条件致病菌。该菌可在人体抵抗力下降、外科手术、输血、创伤、侵入性操作等条件下导致包括肺部感染、泌尿系感染、血流感染及创口感染等,并有可能导致院内感染的爆发流行。碳青霉烯类抗生素是一类对超广谱β-内酰胺酶和头孢菌素酶稳定的超广谱、抗菌活性极强的非典型β-内酰胺抗生素。因其具有高渗透性、低毒性、快速杀菌效果而被临床广泛使用。根据2015~2017年中国细菌耐药监测网(CHINET)细菌耐药性监测报告[1-3]可知,碳青霉烯类耐药粘质沙雷菌的临床分离率和耐药率都在逐步上升,产碳青霉烯酶是其主要的耐药机制[4]。该研究主要针对碳青霉烯耐药粘质沙雷菌的耐药表型和碳青霉烯酶基因的携带情况进行探究,同时分析耐药菌的同源性,为临床抗感染治疗和院内感染防控提供参考。
1 材料与方法
1.1菌株来源收集2014年1月~2017年12月安徽医科大学第一附属医院检验科微生物室分离的对碳青霉烯类抗生素耐药(亚胺培南、厄他培南、美罗培南中任一药物耐药)的粘质沙雷菌,剔除同一患者相同部位重复分离株后,共获得67株作为实验样本。质控菌株为肺炎克雷伯菌(ATCC BAA-1705、ATCC BAA-1706)和大肠埃希菌(ATCC 25922)。
1.2主要仪器与试剂
1.2.1主要仪器 Vitek-2 Compact全自动微生物鉴定分析仪、MALDI-TOF-MS基质辅助激光解吸电离飞行时间质谱仪、麦氏比浊仪(法国梅里埃生物公司);Biometra基因扩增仪(德国Biometra公司);电泳仪(上海天能科技公司);紫外线凝胶成像系统(美国Bio-Rad公司);高速低温离心机(德国Eppendorf公司);NanoDrop one微量紫外-可见分光光度计(美国赛默飞公司)。
1.2.2主要试剂 仪器配套GN鉴定卡和GN13药敏卡(法国梅里埃生物公司);Muller-Hinton琼脂、药敏纸片(英国Oxoid公司);血平板和MH平板(合肥天达诊断试剂公司);亚胺培南西司他丁钠(杭州默沙东制药公司);琼脂糖(法国BIOWEST公司);细菌蛋白抽提液(美国赛默飞公司);6×Loading buffer、Premix Taq(日本TaKaRa公司);酚红粉末、ZnSO4·7H2O、NaOH、HCl、50×TAE、引物、核酸染料、DNA Marker DL2000(上海生工生物公司)。
1.3细菌鉴定与药敏试验
1.3.1细菌鉴定 采用Vitek-2 Compact全自动微生物鉴定分析仪进行,使用MALDI-TOF-MS质谱仪进行细菌鉴定的复核,以确保入选菌株的准确性。
1.3.2药敏试验 采用2017年美国临床和实验室标准化协会(clinical and laboratory standards institute,CLSI)推荐的最低抑菌浓度(minimum inhibitory concentration,MIC)法或纸片扩散法(kirby-bauer,K-B法)进行并判读结果[5],MIC范围不能满足CLSI折点判断要求的药物,采用纸片扩散法测定。
1.4碳青霉烯酶表型筛选
1.4.1改良碳青霉烯类灭活试验(modified carbapenem inactivation method,mCIM) 按CLSI 2017推荐的方法进行,用1 μl接种环挑取血平板上培养过夜的菌落,加入2 ml/管的胰蛋白胨大豆肉汤(TSB)中,涡旋震荡混匀10~15 s。每管中加入1片10 μg美罗培南纸片后,放入(35±2) ℃的CO2培养箱中,孵育4 h±15 min。在完成TSB-美罗培南纸片菌悬液孵育前后,立即用生理盐水制备大肠埃希菌ATCC 25922的0.5麦氏浓度标准菌液。将菌液在15 min内完成MHA琼脂平板的涂布,干燥3~10 min。将美罗培南纸片用10 μl接种环取出,并注意贴壁挤压,挤去多余水分后贴在MHA平板上。倒置放入(35±2) ℃的CO2培养箱中,培养18~24 h,测量抑菌圈直径。结果判读:① 碳青霉烯酶阳性:抑菌圈6~15 mm或16~18 mm但圈内有散在菌落;② 碳青霉烯酶阴性:抑菌圈≥19 mm,不论圈内有无菌落;③ 中性结果:抑菌圈16~18 mm,需检查ATCC 25922纯度,检查美罗培南质控,重复mCIM,或检测碳青霉烯酶基因。阳性和阴性质控菌株,分别使用肺炎克雷伯ATCC BAA-1705/ATCC BAA-1706,同时加做空白对照。
1.4.2Carba NP试验 按CLSI 2015推荐的方法进行,配制A液:在50 ml容器中,分别加入16.6 ml实验室试剂用水、2 ml的0.5%酚红溶液、180 μl的10 mmol/L硫酸锌溶液,用0.1 mol/L的NaOH溶液或10%的HCl溶液调整pH值至7.8±0.1,4~8 ℃避光保存,2周内有效。配制B液:称取亚胺培南西司他丁钠药粉(以亚胺培南有效成分计),每毫升A液加入6 mg亚胺培南,4~8 ℃储存,3 d内有效。待测菌株、质控菌株、空白对照各取两只微量离心管分别标记为A、B,每管加入100 μl细菌蛋白抽提液。菌株在血平板上培养过夜,用1 μl接种环取1环加入各管中(空白对照不加),旋涡振荡器振摇混匀。A管中加入100 μl A液,B管中加入100 μl B液,再次震荡混匀,放入(35±2) ℃培养箱中,孵育2 h后观察结果。结果判读,碳青霉烯酶阳性:A管红色、B管黄色/橙色;碳青霉烯酶阴性:A管红色、B管红色;无效结果:A、B两管皆为黄色/橙色。质控菌株同1.4.1。
1.4.3改良Hodge试验(modified hodge test,MHT) 按CLSI 2012推荐的方法进行,美罗培南抑菌圈边缘与待测菌株或质控菌株划线交叉处,出现增强性(矢状)生长为产碳青霉烯酶阳性,反之为阴性。质控菌株同1.4.1。
1.5引物合成耐药基因引物和肠杆菌科细菌基因重复序列(Enterobacterialrepetitive intergenic consensus,ERIC)引物由生工生物工程(上海)有限公司合成,序列及参考文献见表1。

表1 PCR引物序列及扩增片段长度
1.6提取细菌DNA模板取血平板上培养过夜的菌落,用灭菌水调至成2.0麦氏浓度的菌悬液。取1 ml置于1.5 ml微量离心管中,100 ℃金属浴10 min,然后立即冰浴10 min。使用高速低温离心机12 000 r/min离心5 min,取上清液。使用NanoDrop one微量紫外-可见分光光度计检测模板浓度和纯度,确保A260/A280比值在1.8~2.0,-20 ℃冷冻保存。
1.7PCR扩增耐药基因与测序PCR反应体系总体积设置50 μl,其中包含:Premix Taq试剂25 μl,引物F(10 μmol/L)1 μl,引物R(10 μmol/L)1 μl,待测菌株DNA模板4 μl,双蒸水19 μl。PCR反应温度程序:95 ℃预变性5 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,共35个循环;72 ℃延伸8 min,4 ℃保存待电泳。不同的碳青霉烯酶基因,其PCR反应条件略有差异,主要是退火温度和延伸时间不同,通过预实验摸索确定。配制1.2%的琼脂糖凝胶,对PCR扩增产物进行电泳,紫外线凝胶成像系统观察结果并保存图片。委托生工生物工程(上海)有限公司进行PCR扩增产物测序,基因序列经NCBI网站BLAST程序进行比对,以确定是否为目的基因及其分型。
1.8ERIC-PCR同源性分析PCR反应体系设置和1.7相同,PCR扩增条件:95 ℃预变性5 min;95 ℃变性1 min、35 ℃退火1 min、72 ℃延伸3 min,进行20个循环;95 ℃变性1 min、42 ℃退火1 min、72 ℃延伸3 min,进行30个循环;72 ℃最终延伸10 min,并结合实际略做修改[10]。配制1.8%琼脂糖凝胶,将扩增产物在电压100 V的条件下电泳100 min,紫外线凝胶成像系统观察结果并保存图片。基因型判断依据:同一基因型,电泳条带应完全相同;同一基因的亚型,电泳条带相差1~2条;不同基因型,条带相差3条以上[8]。
1.9统计学处理采用WHONET 5.6软件对K-B法的抑菌圈直径,自动化仪器的MIC药敏结果和样本种类进行统计分析。
2 结果
2.1样本来源基本情况患者年龄14~100(60±20.95)岁,其中男50例(74.63%)、女17例(25.37%)。样本种类以痰液最多,共51份,占76.12%;尿液7份、分泌物3份、血液2份,胸腹水、脑脊液、导管、留置针各1份。分离自ICU 28株、干部二科ICU 12株、神经外科8株,此三科室占71.64%;其他科室也有分离,见表2。

表2 67株耐碳青霉烯粘质沙雷菌的病区分布
2.2药敏试验结果及分析此次分离的67株耐碳青霉烯粘质沙雷菌,呈多重耐药特征。其中对头孢噻肟、头孢曲松100%耐药;对亚胺培南、美罗培南、厄他培南、氨曲南耐药率分别为94.03%、95.52%、98.51%、97.01%;对环丙沙星、庆大霉素、妥布霉素、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、左氧氟沙星耐药率较高,均大于60%;对阿米卡星和复方新诺明耐药率分别为5.97%和7.46%,见表3。
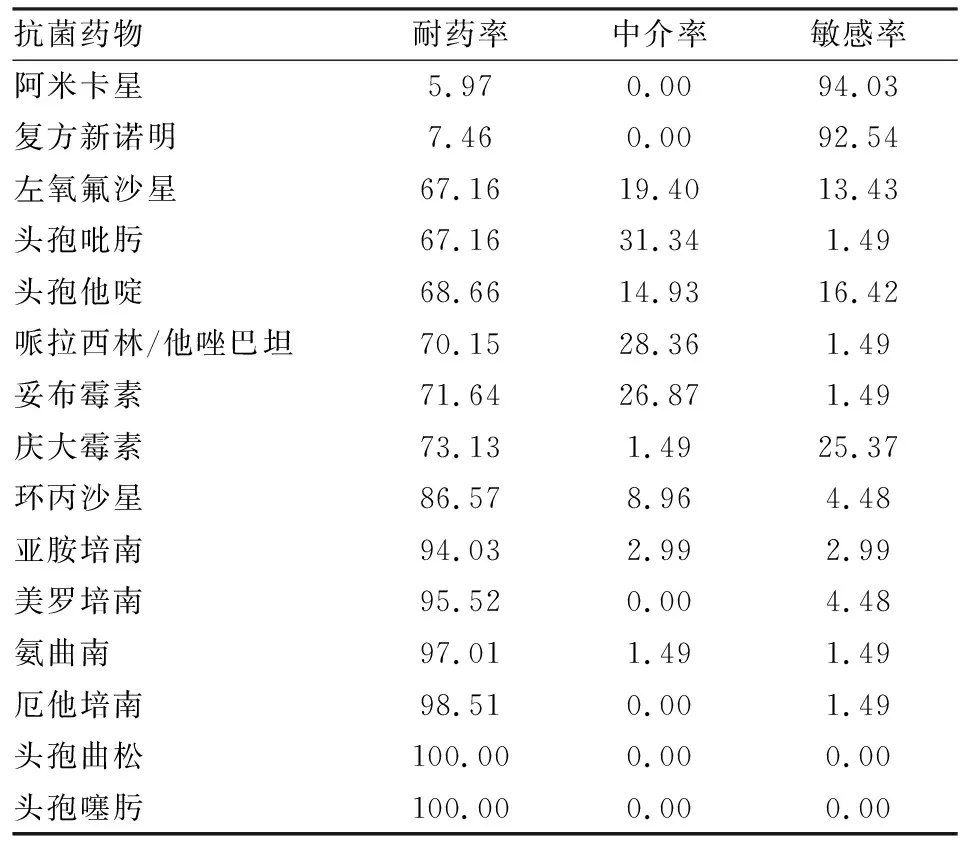
表3 67株耐碳青霉烯粘质沙雷菌对常见药物耐药情况(%)
2.3碳青霉烯酶表型检测结果
2.3.1mCIM mCIM结果显示67株待测菌株中,阳性62株,阴性5株(阴性样本号:15、16、17、24、56),阳性率92.54%,部分结果解析如图1所示。
2.3.2Carba NP试验 Carba NP试验结果显示67株待测菌株中,阳性60株,阴性7株(阴性样本号:15、16、17、21、24、27、56),阳性率89.55%,部分结果解析如图2所示。

图1 部分mCIM试验结果
阳性对照:肺炎克雷伯菌 ATCC BAA-1705;阴性对照:肺炎克雷伯菌 ATCC BAA-1706

图2 部分Carba NP试验结果
阳性对照:肺炎克雷伯菌 ATCC BAA-1705;阴性对照:肺炎克雷伯菌 ATCC BAA-1706
2.3.3MHT结果 67株待测菌株中,阳性61株,阴性6株(阴性样本号:15、16、17、24、27、56),阳性率91.04%,部分结果解析如图3所示。

图3 部分MHT试验结果
阳性对照:肺炎克雷伯菌 ATCC BAA-1705;阴性对照:肺炎克雷伯菌 ATCC BAA-1706
2.4耐药基因PCR扩增结果67株碳青霉烯耐药粘质沙雷菌中,41株检出碳青霉烯酶基因,检出率为61.19%,其中检出含blaKPC基因32株,含blaOXA-23组基因7株,含blaOXA-51组基因7株,含blaGES基因3株,含blaOXA-58组基因1株,其中有8株细菌同时含有多种耐药基因。耐药基因blaIMI、blaNMC、blaSME-IRS、blaNDM、blaVIM、blaIMP、blaOXA-48、blaOXA-24组均未检出。基因分布情况见表4,部分阳性基因扩增电泳见图4。

表4 67株耐碳青霉烯粘质沙雷菌的耐药基因分布(%)

图4 部分blaKPC阳性基因电泳图
M:DL2000 DNA Maker;1~8、13~15:阳性样本,在882 bp处出现条带;9~12:阴性样本;16:阴性对照;17:阳性对照
2.5ERIC-PCR基因分型67株耐碳青霉烯的粘质沙雷菌可分为8个型别(以A~H表示),其中A型50株为最多,B型5株,C型5株,D型3株,E型、F型、G型、H型各1株。见图5。

图5 部分菌株的ERIC-PCR基因分析图谱
M:Maker;1、2、3、4、5、7、8、9、10、11、13、14、15:A型;6:B型;12:E型;16:F型;17:G型
3 讨论
粘质沙雷菌占肠杆菌科沙雷菌属的90%,因其在自然界中的广泛分布且毒力较低,而一度被认为是无害的非致病菌。然而,近年来该菌在临床感染患者中的分离率逐步升高,随着临床对碳青霉烯类抗菌药物的广泛应用,耐碳青霉烯类的粘质沙雷菌检出率也在同步升高。根据2015、2016、2017年CHINET全国细菌耐药监测报告[1-3]可知,沙雷菌属的临床分离率分别为1.08%、1.16%、1.22%,对亚胺培南、美罗培南和厄他培南的耐药率分别由2016年的4.2%、4.1%和3.8%上升到2017年的5.5%、4.6%和5.3%,分离率和耐药率都呈现出稳步提高的趋势。2015年该院粘质沙雷菌对亚胺培南和美罗培南的耐药率分别为13.7%和17.6%[11],显著高于全国平均水平,耐药情况更加严重。
该研究中67株细菌标本类型以痰液为主,说明粘质沙雷菌在各种因素所导致的人体免疫力降低时,主要引起呼吸系统感染。分离科室以ICU为主,说明患者严重基础疾病、接受大手术、使用呼吸机、气管切开、侵入性检查以及大剂量、长时间的使用相关抗生素可能是引起粘质沙雷菌感染的高危因素,这与田磊 等[12]研究一致。
药敏结果显示,67株耐碳青霉烯粘质沙雷菌呈多重耐药特征,其中对头孢噻肟、头孢曲松100%耐药;对亚胺培南、美罗培南、厄他培南、氨曲南耐药率大于90%;对环丙沙星、庆大霉素、妥布霉素、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、左氧氟沙星耐药率较高,均大于60%;仅对阿米卡星和复方新诺明保持高度敏感,耐药率分别为5.97%和7.46%。提示在此类细菌感染严重,可选抗生素有限的情况下,阿米卡星或复方新诺明可以作为首选药物进行治疗。与全国数据相比[13],本研究67株细菌对哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、厄他培南、环丙沙星的耐药率显著高于全国平均水平,头孢噻肟、亚胺培南、美罗培南、庆大霉素药敏结果和全国数据相对一致,而阿米卡星和复方新诺明耐药率则显著低于全国水平。这可能与不同医院所收治患者的病情、病种、年龄、医院的诊疗水平以及临床医师的用药习惯不同有关。
粘质沙雷菌对碳青霉烯类抗菌药物的耐药机制复杂,最主要的是携带碳青霉烯酶基因,并产生能直接灭活碳青霉烯类药物的碳青霉烯酶[14]。按照Ambler分子结构不同,可将碳青霉烯酶分为A、B、D三类:A类在体外可以被克拉维酸和他唑巴坦抑制水解活性,主要包括KPC、SME、NmcA/IMI、GES、PER等;B类因为可以被EDTA等金属离子螯合剂抑制而又称为金属酶,主要包括NDM、VIM、IPM、SPM、GIM、SIM;D类又称OXA酶,不能被酶抑制剂和EDTA所抑制,对碳青霉烯类药物的水解活性较弱,主要包括OXA-23组、OXA-24组、OXA-51组、OXA-58组等;碳青霉烯酶基因可借助移动基因元件,如质粒、整合子、转座子等进行细菌间的传播。
该研究从67株碳青霉烯耐药粘质沙雷菌中,检出blaKPC、blaGES、blaOXA-23组、blaOXA-51组、blaOXA-58组基因,其中以blaKPC型(32株)最多,占47.76%。值得关注的是,有8株细菌同时携带多种基因,以blaOXA-23+blaOXA-51型最多(4株),blaKPC+blaOXA-23(2株)、blaGES+blaOXA-51(1株)次之,仍有1株同时包含blaKPC+blaOXA-51+blaOXA-58三种基因型,呈现出多基因联合共存现象,可见本院耐碳青霉烯粘质沙雷菌耐药情况相当严重。
MHT、Carba NP、mCIM分别是CLSI 2009、2015、2017年陆续推荐的用于检测对一种或几种碳青霉烯类抗生素不敏感肠杆菌科细菌的表型检测方法,分别有各自的优势和局限性[5]。本研究中MHT、Carba NP、mCIM三种表型试验对67株耐碳青霉烯粘质沙雷菌的阳性率分别为91.04%、89.55%、92.54%。本研究中所有blaKPC基因阳性菌株的MHT、Carba NP试验、mCIM试验都是阳性,说明三种表型试验对于KPC酶敏感性较高。3株blaGES基因阳性菌株中2株表型试验全阴,仅1株mCIM试验阳性,推测对于GES酶而言mCIM试验敏感性相对更高。7株blaOXA-23基因阳性菌株中4株表型试验全阳性,2株表型试验全阴,1株Carba NP试验阴性,MHT和mCIM试验阳性。在blaOXA-51基因阳性的7株细菌中,2株与表型试验完全符合,4株与表型试验完全不符,1株Carba NP试验阴性,MHT和mCIM试验阳性。仅有的1株blaOXA-58基因阳性菌株三种表型试验均为阴性。OXA类酶表型试验整体阳性率不高,符合该类酶对碳青霉烯类药物水解活性弱的特点。另外有26株细菌三种表型试验均为阳性,而基因检测全阴性,可能是产生了其他碳青霉烯酶,或者因为药物相关外膜孔蛋白缺失或下调,伴/不伴有β内酰胺酶(ESBLs、AmpC等)的表达[15],这将是未来进一步的研究方向。
ERIC是肠杆菌科细菌所特有的,针对该序列设计引物进行PCR扩增,可以得到一系列大小不同的DNA片段,电泳后形成条带数量、位置、亮度不同的DNA指纹图谱,从而可在分子水平对细菌进行鉴定和同源性分析。该研究中67株耐碳青霉烯的粘质沙雷菌经ERIC-PCR分析,可分为8个型别(以A~H表示),其中A型(50株)为主要流行株,提示该院可能存在A型克隆株的流行。因细菌耐药基因可借助质粒等可移动基因元件进行交叉传播,造成院内感染的暴发流行,所以必须引起重视,加强手卫生消毒,减少患者不必要的床位更换和科室间转诊。
综上所述,该院耐碳青霉烯类粘质沙雷菌检出率高,耐药情况严重,耐药机制复杂,耐药基因联合共存,同种克隆集中趋势明显,有引起院内感染大规模流行的可能,给临床治疗带来严峻挑战。应引起高度重视,加强细菌耐药性监测,科学合理使用抗菌药物,做好院内感染防控工作,以求最大限度减少此类耐药菌的出现和传播。

