慢性阻塞性肺疾病患者高刺激率ABR及TEOAE结果分析
潘庆春 李蓓 李春燕 王媛玲 张静 唐晓茗
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是指伴有阻塞性肺气肿的慢性支气管炎,其主要临床特征是低氧血症和高碳酸血症[1]。随着缺氧逐渐增加,二氧化碳潴留,慢性阻塞性肺病患者出现明显肺外效应,其中对炎症和缺氧最敏感的中枢神经系统最易受累[2]。单纯的耳声发射对缺氧性听力损失的检测主要反映耳蜗的功能,扩展高频纯音测听等可以反映整个听觉通路,测试过程需要病人配合。本研究通过高刺激率听性脑干反应(ABR)联合筛查型耳声发射(TEOAE),观察COPD患者缺氧对耳蜗及脑干中枢听觉系统的损伤情况,为早期发现COPD患者的听觉系统受损情况提供检测依据。
1 资料与方法
1.1 研究对象
随机选取2017年1月~2018年6月川北医学院附属医院呼吸内科确诊的稳定期COPD患者30例(共60耳),包括男性18人(36耳)和女性12人(24耳),年龄55~70岁,0.5~8 kHz纯音平均听阈<25 dB nHL,226 Hz的鼓室图是A型。稳定期COPD组纳入标准[2],(1)符合COPD指南的分级诊断标准(2015年修订),吸入支气管扩张剂后,FEV1/FVC值均小于70%。(2)在过去的2个月中,患者没有出现呼吸困难、痰量增加和咳嗽等急性发作;(3)病程超过1年,患者未接受长期氧疗;(4)患者均无耳部疾病史,如传导性聋、突发性聋、药物性聋、噪声性聋、听神经瘤、耳聋家族史。对照组选择30名健康成人(60耳),包括男性16人(32耳)和女性14人(28耳)。对照组的纳入标准:(1)年龄55~70岁;(2)500~8000 Hz纯音听阈<25 dB HL;(3)226 Hz的鼓室图是A型。对照组排除标准:神经系统、心脑血管系统疾病;耳部疾病史,如传导性聋、突发性聋、药物性聋、噪声性聋、听神经瘤;耳聋家族史。 两组研究对象年龄、性别、纯音听阈差异无统计学意义(P>0.05)。
1.2 试验方法
所有受试者均须接受电子耳镜检查外耳道,清除分泌物。使用纯音听力计进行纯音听力阈值检测,记录0.5,1,2,4和8 kHz的双耳气骨阈值。Capella耳声发射分析仪检测双耳耳声发射,并且记录0.5、1、2、4和8 kHz是否通过。在电磁屏蔽室内使用Biologic听觉诱发电位系统进行检测,95%酒精备皮。记录电极放在发际中间的前额[3],参考电极放置在双侧乳突上,接地电极置于眉根,极间阻抗≤2 kΩ,本底噪声小于25 dB(A)。测试参数[4]:放大器带通滤波器为100~3000 Hz,增益为100 k,叠加次数为2000次,插入式耳机给声,刺激声为短声,刺激强度为80 dB nHL。每个受试者以11.1次/s和51.1次/s进行测试。记录每个刺激率波形Ⅰ、Ⅲ、Ⅴ潜伏期及Ⅰ-Ⅲ、Ⅲ—Ⅴ、Ⅰ-Ⅴ波间期,检测重复3次,计算并比较刺激率为11.1次/s和51.1次/s波潜伏期及波间期的差异,测试环境符合GB/T16403(1996)[4]。比较COPD组及正常对照组高(51.1次/s)、低(11.1次/s)刺激率下Ⅰ、Ⅲ、Ⅴ波潜伏期值、波间期及Ⅰ-Ⅲ、Ⅲ-Ⅴ、Ⅰ-Ⅴ间期差值ΔIPL,分析高刺激率ABR对COPD缺氧性损伤早期诊断的价值;对比分析两组耳声发射(TEOAE)的通过情况,了解COPD患者早期缺氧对耳蜗的损伤。
1.3 统计学方法 采用SPSS 19.0软件进行统计学分析。两组独立样本t检验用于组间比较。P<0.05为有统计学意义,P<0.01为有显著性差异。
2 结果
表1显示,11.1次/s刺激率下两组Ⅰ、Ⅲ、Ⅴ波潜伏期值及波间期比较,COPD组双耳的波I潜伏期(1.59±0.14 ms)较对照组(1.52±0.19 ms)延长(P<0.05);COPD组双耳的Ⅰ-Ⅲ波间期(2.15±0.18)较对照组(2.30±0.27)缩短(P<0.01);其余组间比较差异无统计学意义。
表2显示,在51.1次/s刺激率下两组Ⅰ、Ⅲ、Ⅴ波潜伏期值及波间期比较,COPD组Ⅰ波潜伏期(1.73±0.16)、Ⅲ波潜伏期(4.01±0.29)、Ⅴ波潜伏期(6.03±0.34)均极显著高于正常对照组Ⅰ波潜伏期(1.55±0.17)、Ⅲ波潜伏期(3.82±0.22)、Ⅴ波潜伏期(5.65±0.37)(P<0.01);COPD组Ⅲ-Ⅴ波间期(2.02±0.34)、Ⅰ-Ⅴ波间期(4.30±0.31)极显著高于对照组Ⅲ-Ⅴ波间期(1.83±0.30)、Ⅰ-Ⅴ波间期(4.10±0.40)(P<0.01),其余组间比较差异无统计学意义。
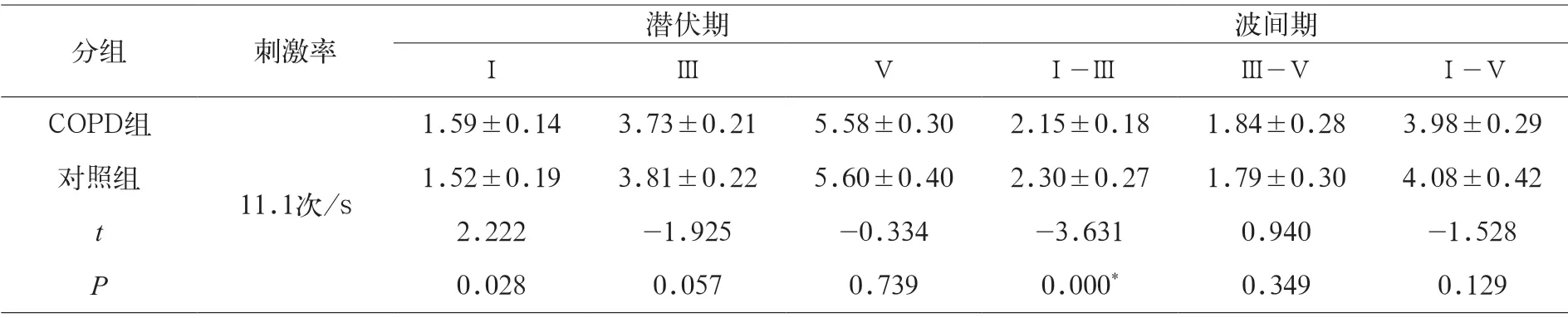
表1 11.1 次/s 刺激率下,两组Ⅰ、Ⅲ、Ⅴ波潜伏期值及波间期比较(ms)
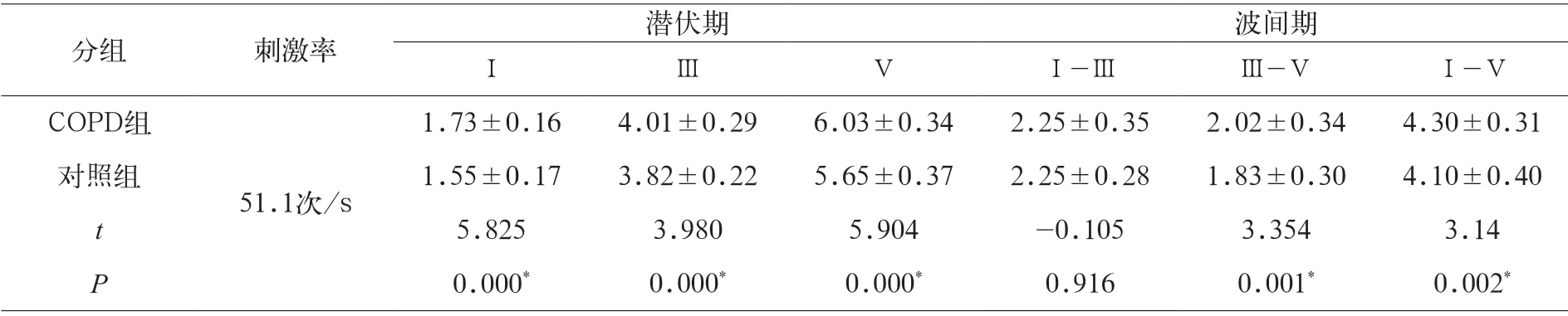
表2 51.1 次/s 刺激率下,两组Ⅰ、Ⅲ、Ⅴ波间期值及波间期比较(ms)
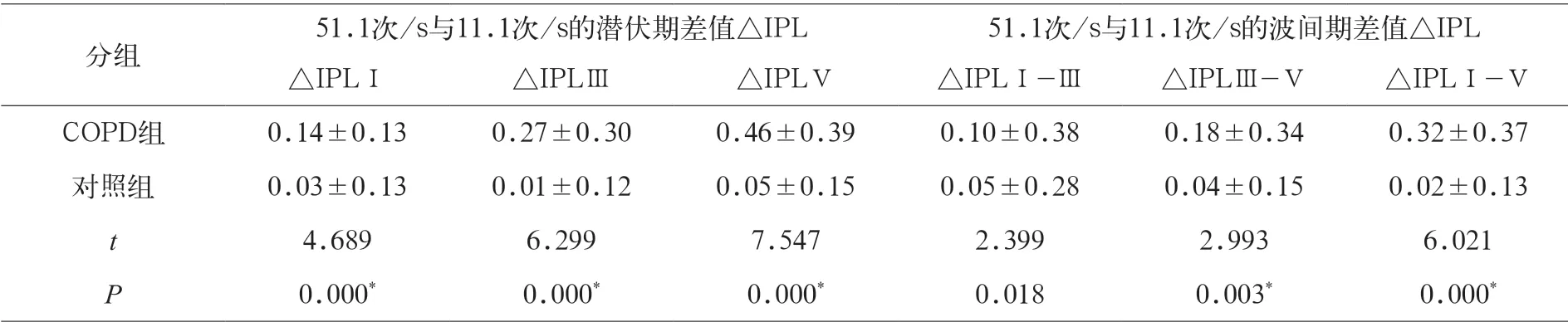
表3 两组在不同刺激率时ABR波Ⅰ、Ⅲ、Ⅴ潜伏期以及Ⅰ-Ⅲ、Ⅲ-Ⅴ、Ⅰ-Ⅴ间期差值ΔIPL比较(ms)
表3显示,在11.1次/s与51.1次/s的刺激率下,COPD组Ⅰ潜伏期差值△Ⅰ(0.14±0.13)、Ⅲ潜伏期差值△Ⅲ(0.27±0.30)、Ⅴ潜伏期差值△Ⅴ(0.46±0.39)均极显著高于正常对照组Ⅰ潜伏期差值△Ⅰ(0.03±0.13)、Ⅲ潜伏期差值△Ⅲ(0.01±0.12)、Ⅴ潜伏期差值△Ⅴ(0.05±0.15)(P<0.01);在11.1次/s与51.1次/s的刺激率下,COPD组Ⅰ-Ⅲ波间期差值△Ⅰ-Ⅲ(0.10±0.38)、Ⅲ-Ⅴ波间期差值△Ⅲ-Ⅴ(2.02±0.34)、Ⅰ-Ⅴ波间期差值△Ⅰ-Ⅴ(0.32±0.37)均显著高于正常对照组Ⅰ-Ⅲ波间期差值△Ⅰ-Ⅲ(0.05±0.28)、Ⅲ-Ⅴ波间期差值△Ⅲ-Ⅴ(0.04±0.15)、Ⅰ-Ⅴ波间期差值△Ⅰ-Ⅴ(0.02±0.13)(P<0.05)。
表4显示两组耳声发射(TEOAE)异常率组间差异具有统计学意义,COPD组的异常率极显著高于对照组(P<0.01)。
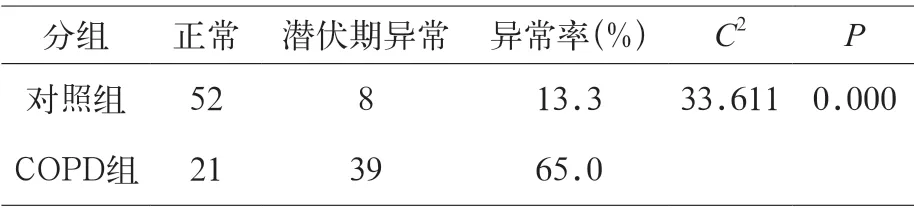
表4 病例组和对照组耳声发射异常率(n=60)
3 讨论
ABR的Ⅰ波来源于耳蜗/蜗神经近蜗端,Ⅱ波来源于耳蜗核/蜗神经近脑端,Ⅲ波来源于上橄榄核/耳蜗核,Ⅳ波来源于外侧丘系/上橄榄核,Ⅴ波来源于下丘/斜方体[5]。耳蜗核、前庭神经核等脑干结构血液灌注不足时出现神经元代谢受损、听觉通路缺血和水肿,这些病理改变可导致部分神经纤维发生脱髓鞘改变及传导阻滞,前者使有髓纤维动作电位跳跃式传导变为电泳传导,降低神经冲动传导速度[5]。ABR为突触电位,当神经传导速度降低时,可出现相应部位的Ⅰ、Ⅲ、Ⅴ潜伏期及I~V、III~V波间期延长。
本研究发现11.1次/s的刺激速率下,COPD患者组仅出现I波潜伏期的延长,其余未见明显异常。表明耳蜗/蜗神经近蜗端较其他部位对缺血缺氧性疾病敏感,常规刺激率ABR即可表现为I波潜伏期延长。本实验中COPD组耳声发射异常率亦明显增加,说明COPD的慢性缺氧在出现听力下降之前已经出现耳蜗毛细胞损伤。因此笔者认为耳声发射及常规ABR I波潜伏期的延长可作为COPD患者早期耳蜗功能异常的筛查指标。
高刺激率ABR是检测突触功能异常的敏感方式[6],而突触功能异常主要由缺血缺氧性疾病引起,目前临床应用高刺激率ABR能敏感准确地发现早期内耳以及脑干的缺血缺氧性病变。本实验中,在51.1次/s的高刺激速率下COPD组Ⅰ、Ⅲ、Ⅴ波潜伏期值延长及I-V、I-Ⅲ、III-V波间期亦较正常组延长。可能原因为COPD稳定期患者由于长期缺氧,除耳蜗毛细胞受损外,蜗神经、蜗核等脑干结构均受损。
研究表明高刺激速率ABR的I-V波间期与低刺激速率ABR的I-V波间期相减的差值最为可靠,大于0.28 ms提示后循环缺血[7]。本实验中,COPD患者高低刺激率ABR的I~V波间期差值△Ⅰ-Ⅴ为0.32±0.37,明显高于对照组(0.02±0.13)。笔者认为稳定期的COPD患者由于长期缺氧,出现后循环缺血缺氧性改变。后循环系统血液供应内耳迷路和脑干,后循环的缺血导致 ABR Ⅰ、Ⅲ、Ⅴ波的代表区的神经细胞受损[8],进而表现为高刺激率ABR各波潜伏期以及波间期的延长。笔者后继将进一步研究高刺激率ABR及TEOAE与血氧饱和度的相关关系。
4 结论
慢性阻塞性肺病患者具有明显肺外效应,其中对炎症和缺氧最敏感的中枢神经系统最易受累[2]。本研究结果表明,对于无听力损失的稳定期COPD患者可以行耳声发射及高刺激率ABR检查,在听损出现前早期发现耳蜗及脑干功能损伤。李欣等[4]对OSAHS患者的研究表明,不同刺激率下,ABR潜伏期与血氧浓度无相关性;本实验中,不同刺激率下COPD患者ABR各波潜伏期以及波间期有是否与血氧浓度有关还需要进一步研究。随着病程的推移及病情的加重,COPD患者耳蜗及脑干缺血缺氧程度加重是否会出现迟发性听力损失,也需要后期进一步研究。

