黄壤伯克氏溶磷细菌的筛选鉴定及溶磷特性
乔志伟,腾飞龙,邵晓贵
(1.安顺学院 资源环境与工程学院,贵州 安顺 561000;2.安顺学院 农学院,贵州 安顺 561000)
磷是作物生长最重要的元素之一[1]。化学磷肥中能被作物直接吸收的有效磷易与土壤中的Ca2+、Fe3+、Al3+等离子结合,转化为植物不可利用的难溶性磷酸盐,造成化学磷肥利用率很低,目前我国农田磷肥利用率仅为30%左右[2]。因此,在农业生产中,为了保证作物生长过程中有充足的磷素供应,操作人员会施入过量的化学磷肥,进而消耗大量的磷矿石,导致磷矿石面临着被耗尽的危机[3];过量的化学磷肥还会造成磷素在土壤中的累积,对农业环境和水体富营养化都有直接或间接的影响[4,5]。因此,将土壤中难溶磷酸盐转化成植物吸收的有效磷成为当前研究的热点,利用溶磷细菌将土壤中难溶态磷酸盐转化为有效磷,同时分泌促进作物生长的物质,对土壤磷素的有效化过程起到积极作用。对于提高化学磷肥的利用率,增加土壤中有效磷含量,减少磷素累积,增加作物产量等方面都具积极的作用[6~8]。
黄壤作为我国西南地区典型的地带性土壤,集中分布在贵州、四川、重庆等地。其中,以贵州分布最为广泛,全国25.3%的黄壤集中分布在贵州,其面积分别占贵州国土面积和土壤面积的41.9%和46.4%,是贵州主要的农业土壤类型,在贵州农业生产中发挥着重要的作用,该区域化学磷肥利用率较低[9],且目前关于贵州黄壤区土壤溶磷细菌的研究资料且可利用的菌株资源都不足,本试验通过PVK平板培养法从贵州省安顺市各县区的黄壤中分离筛选溶磷细菌,并进一步研究其溶磷特性,为该区域溶磷细菌的研究提供菌株资源,为溶磷细菌的应用提供理论基础。
1 材料与方法
1.1 供试材料
1.1.1 土样采集:
土样采自于贵州省安顺市各县区农田作物根际,采样地种植作物为玉米,蔬菜等,采集表层土壤,土壤质地为黄壤,将采集的土样除去杂草、植物根系等,24 h内用于溶磷细菌的分离和筛选。
1.1.2 培养基:
(1)PVK培养基(用于溶磷细菌的分离筛选): 葡萄糖10 g, Ca2(PO4)35 g, (NH4)2SO40.5 g, NaCl 0.2 g, KCl 0.2 g, MgSO40.1 g, FeSO4·7H2O 0.002 g, MnSO4·4H2O 0.002 g, 0.4%溴酚蓝(pH6.7)10 mL, 酵母浸膏0.5 g,蒸馏水1 000 mL,固体培养基加18~20 g琼脂,pH自然;(2) NBRIP培养基:葡萄糖10 g, Ca2(PO4)35 g, MgCl25 g, (NH4)2SO40.1 g, KCl 0.2 g, MgSO40.25 g, 蒸馏水1 000 mL,固体培养基20 g琼脂,pH自然;(3)溶磷细菌保存与活化培养基:牛肉膏5.0 g, 蛋白胨10.0 g, NaCl 5.0 g,蒸馏水1 000 mL,固体培养基加18~20 g琼脂,pH调至7.0。
1.2 试验方法
1.2.1 溶磷细菌的分离筛选:
称取10 g采集的新鲜土样放在盛有90 mL无菌水的250 mL三角瓶中,放入几颗灭菌的小玻璃珠,在150 r·min-1摇床上振荡30 min,用10倍逐级稀释法稀释至10-7,均匀涂布在PVK培养基平板上,倒置于培养箱中,28 ℃培养3~5 d,待菌落长出后观察菌落周围是否产生黄色的晕圈对菌株进行初步的筛选;在NBRIP固体平板培养基上多次划线纯化后,挑选出平板上仍产生透明圈层的菌株,将其保存置于4 ℃冰箱。
1.2.2 溶磷细菌溶磷能力的测定:
将溶磷细菌活化后将菌液按照1%的接种量接种于灭过菌的NBRIP液体培养基中,28 ℃、150 r·min-1条件下振荡培养,将培养第7 d的培养液于4 ℃,6 000 r·min-1的条件下离心5~8 min,取上清液1 mL用钼锑抗比色法测定有效磷含量,每株菌株重复3次,同时设置未接菌的空白对照,菌株溶磷能力即为接菌培养液有效磷含量与空白对照的差值。
1.2.3 溶磷细菌菌体生长量(OD600)的测定:
用移液管取培养好的液体发酵液5 mL于离心管中,在1 500 r·min-1的条件下离心3 min,在比色管中吸取上清液3 mL,并加入等量的1 mol·L-1的HCl, 以没有接菌的空白培养液作为参比,在600 nm处比色测定菌液的光密度值,测定值即为OD600。
1.2.4 溶磷细菌16sRNA序列的测定:
采用引物7f (5’-CAGAGTTTGATCCTGGCT-3’),1 540 r (5’-AGGAGGTGATCCAGC CGCA-3’) 建立扩增反应体系并测序,将获得的DNA序列输入GenBank,用Blast 程序与数据库中的所有序列进行比较分析,利用MEGA4.1的Neighbor-Joining 软件进行系统发育树的构建。
1.2.5 培养基不同葡萄糖浓度对菌株溶磷能力的影响:
在NBRIP液体培养基中,葡萄糖的加入量分别是1、5、10、15、20 g·L-1,其它成分不变,接菌培养测定菌株溶磷能力。
1.2.6 培养基不同硫酸铵含量对菌株溶磷能力的影响:
在NBRIP液体培养基中,硫酸铵的加入量分别是0.05、0.067、0.1、0.2、1.0 g·L-1,其它成分不变,接菌培养测定菌株溶磷能力。
1.2.7 不同碳源氮源对菌株溶磷能力的影响:
在NBRIP液体培养基中,分别以蔗糖、甘露醇、麦芽糖、淀粉等质量代替葡萄糖为碳源,其它成分不变,接菌培养测定菌株溶磷能力,确定最佳碳源;确定最佳碳源后,以氯化铵、硝酸铵、硝酸钾、硝酸钠为氮源替换硫酸铵(氮摩尔质量相同),接菌培养测定菌株在不同氮源条件下的溶磷能力。
1.2.8 外加磷源对菌株溶磷能力的影响:
在NBRIP液体培养基中, 通过外加磷酸二氢钾调节培养基中有效磷的浓度,使其有效磷浓度分别为0、20、40、60、80、100 mg·L-1,接种菌液,研究外加磷源不同浓度对菌株溶磷能力的影响。
1.3 数据处理
本文数据采用方差分析的数学统计方法,分析软件为Excel2003和SASV8.1。
2 结果与分析
2.1 溶磷细菌的筛选及溶磷能力
经过初筛和多次划线纯化,最终得到14株溶磷能力大于395 mg·L-1的菌株,14株溶磷细菌溶磷圈及溶磷能力大小如表1所示,由表1可知14株菌株溶磷圈直径大小在1.43~2.60 cm之间,菌株溶磷圈直径(D)与菌落直径(d)比值介于1.73~3.00;14株菌株溶磷能力在395.30~564.07 mg·L-1,菌株W4的溶磷能力最强,为564.07 mg·L-1,显著高于其它菌株(P<0.05)。14株菌株溶磷能力大小与对应菌株溶磷圈直径(D)、溶磷圈直径和菌落直径比值(D/d)之间的线性相关系数R2分别为0.1728、0.0028,相关性不显著,因此菌落溶磷圈有无及大小仅做为初步筛选溶磷细菌的方法,不能作为衡量其溶磷能力大小的标志。
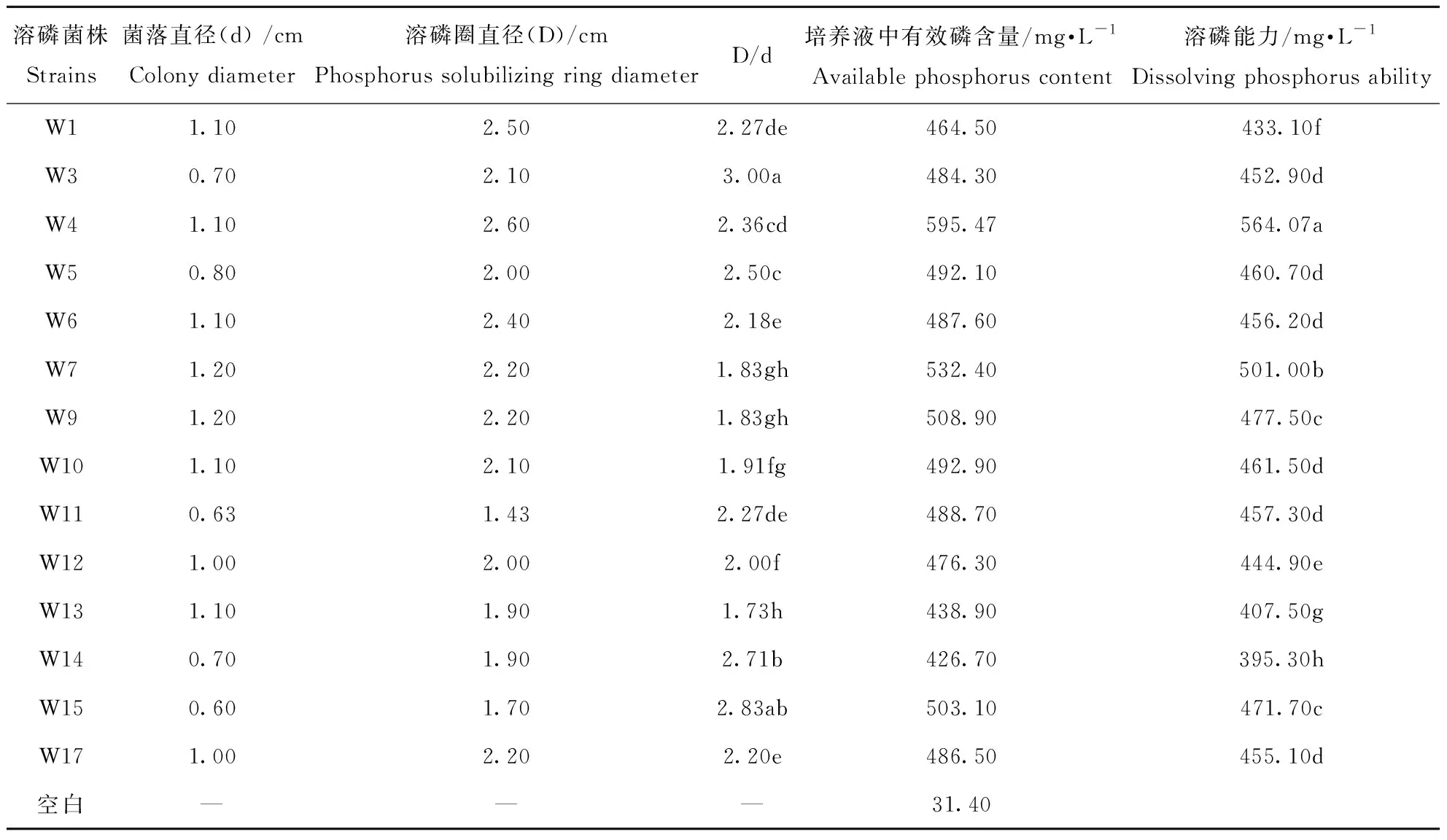
表1 14株溶磷细菌溶磷圈及溶磷能力Table 1 Phosphorus circle and the ability dissolved phosphorus of phosphorus bacteria in tricalcium medium
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note:Different small letters show significant difference at the 0.05 level in the same row. The same below.
2.2 溶磷细菌W4的16sRNA序列测定
以W4的总DNA为模板,利用细菌16S rRNA引物进行PCR扩增,得到扩增产物,将W4测序结果采用BLAST 软件与Genbank 中的序列比较,W4菌株与Burkholderiasp.(HQ704712.1)及Burkholderiasp.(KX161744.1)的序列同源性均大于99%,鉴定其属于伯克氏菌属(Burkholderiasp.),其系统发育树见图1。

图1 溶磷细菌W4的系统发育树Fig.1 Phylogenetic tree of phosphate solubilizing bacteria W4
2.3 菌株W4溶磷特性的研究
2.3.1 培养基不同葡萄糖浓度对W4溶磷能力的影响
培养液中不同葡萄糖浓度下W4的菌体生长量(OD600)及溶磷能力见表2。由表2可知,培养液中葡萄糖浓度分别为1、5、10、15、20 g·L-1时,W4的溶磷能力分别为107.61、419.38、564.07、570.20、580.06 mg·L-1。葡萄糖浓度为1 g·L-1时,菌株溶磷能力最小,培养液中碳源含量不足时对溶磷细菌溶磷能力影响较大,当培养液中葡萄糖浓度从1 g·L-1增加到10 g·L-1时,W4溶磷能力从107.61 mg·L-1显著增加到564.07 mg·L-1,增加了456.46 mg·L-1,可见当培养液中葡萄糖浓度小于10 g·L-1时,随着葡萄糖浓度的增加,W4溶磷能力呈显著增加的趋势;当培养液中葡萄糖浓度从10 g·L-1增加到20 g·L-1时,W4溶磷能力从564.07 mg·L-1增加到580.06 mg·L-1,增加量仅为15.93 mg·L-1,培养液中葡萄糖浓度大于10 g·L-1时,随着葡萄糖浓度的增加,W4溶磷能力增加不显著;当培养液中葡萄糖浓度大于15 g·L-1时,菌体活动产生的葡萄糖酸增加进而抑制菌株的生长受到抑制。
2.3.2 培养基不同硫酸铵浓度对W4溶磷能力的影响
培养液中不同硫酸铵浓度下W4的菌体生长量(OD600)及溶磷能力见表3。由表3可知,培养液中硫酸铵浓度分别为0.05、0.067、0.10、0.20、1.00 g·L-1时,W4的菌体生长量(OD600)分别为0.23、0.31、0.42、0.55、0.69,溶磷能力分别为604.18、589.81、564.07、532.24、491.33 mg·L-1。当培养液中硫酸铵浓度从0.05 g·L-1增加到1.00 g·L-1时,菌株W4 菌体生长量(OD600)从0.23增加到0.69,增加了0.46,呈显著增加的趋势,溶磷能力从604.18 mg·L-1降低到到491.33 mg·L-1,减少了112.85 mg·L-1,与表2培养液葡萄糖浓度对菌株生长量和溶磷能力的影响比较,碳源含量对菌株溶磷能力影响较大,氮源含量对菌体生长量影响较大。
表2不同葡萄糖浓度下菌株W4的OD600与溶磷能力
Table2 OD600and phosphate solubilizing capacity of W4 under different glucose concentrations

不同葡萄糖浓度/g·L-1Different glucose concentrationOD600溶磷能力/mg·L-1Dissolving phosphorus ability10.36±0.01b107.61±7.21c50.40±0.01a419.38±4.10b100.36±0.02b564.07±10.31a150.35±0.01b570.20±7.68a200.29±0.02c580.06±7.21a
表3不同硫酸铵浓度下菌株W4 OD600和溶磷能力
Table3 OD600and phosphate solubilizing capacity of W4 under different ammonium sulphate concentrations
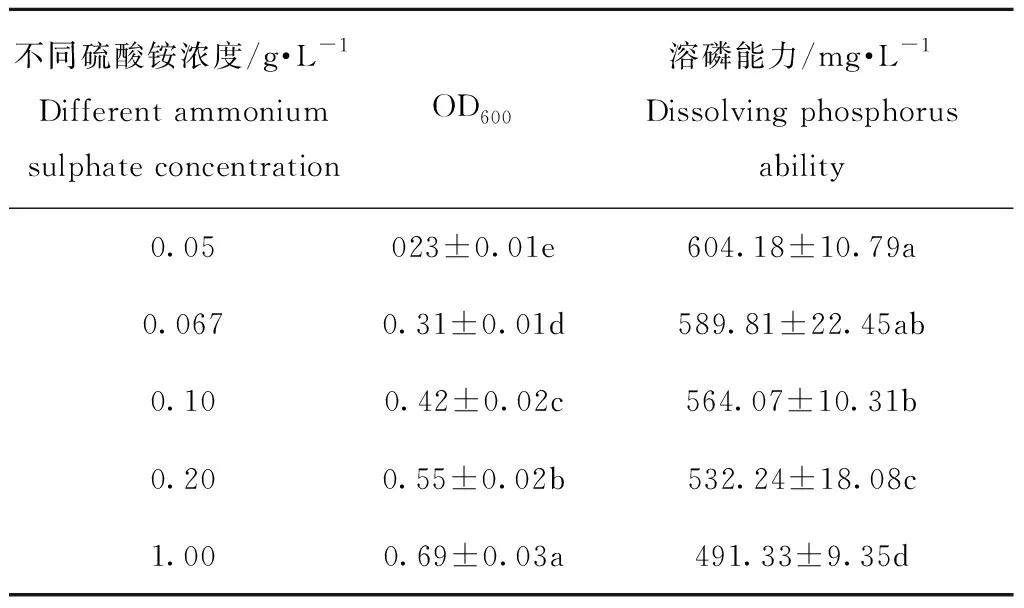
不同硫酸铵浓度/g·L-1Different ammonium sulphate concentrationOD600溶磷能力/mg·L-1Dissolving phosphorus ability0.05023±0.01e604.18±10.79a0.0670.31±0.01d589.81±22.45ab0.100.42±0.02c564.07±10.31b0.200.55±0.02b532.24±18.08c1.000.69±0.03a491.33±9.35d
2.3.3 不同碳氮源对W4溶磷能力的影响
培养液中不同碳氮源对W4溶磷能力的影响见表4。由表4可知,W4对不同碳源的利用能力为葡萄糖>甘露醇>蔗糖>麦芽糖>淀粉,以葡萄糖为碳源,溶磷能力最强,为564.07 mg·L-1,显著高于其它碳源,以淀粉为碳源,溶磷能力最低,为59.41 mg·L-1,W4对单糖利用效果最好,多糖最差;
以葡萄糖为碳源,选择硫酸铵、氯化铵、硝酸铵、硝酸钠、硝酸钾作为不同氮源,W4在以硫酸铵、氯化铵、硝酸铵、硝酸钠、硝酸钾为氮源的条件下,溶磷能力分别为564.07、579.33、605.97、611.96、640.10 mg·L-1;W4以硝态氮为氮源溶磷能力显著高于铵态氮。

表4 不同碳氮源菌株W4 的溶磷能力Table 4 Phosphate solubilizing capacity of strain W4 with different carbon and nitrogen sources
2.3.4 外加磷源浓度对W4溶磷能力的影响
外加磷源浓度对W4溶磷能力的影响见表5。由表5可知,随着培养液中外加磷源浓度的增加,W4的溶磷能力呈现逐渐下降的趋势,外加磷源浓度从0 mg·L-1增加到100 mg·L-1,W4的溶磷能力从564.07 mg·L-1下降到493.43 mg·L-1,培养环境中有效磷浓度对菌株溶磷能力也有一定的限制作用。
表5外加磷源浓度菌株W4溶磷能力
Table5 Phosphate solubilizing capacity of strain W4 with different added phosphorus concentration

不同磷源浓度/mg·L-1Different added phosphorus concentration溶磷能力/mg·L-1Dissolving phosphorus ability0564.07±10.31a20558.68±15.27ab40547.90±5.49b60523.06±21.46bc80510.19±7.74c100493.43±11.25c
3 讨论与结论
溶磷微生物最明显的标志是可以在PVK固体培养基平板上产生溶磷圈,这也是目前筛选溶磷微生物最常用的方法之一,但是在试验筛选过程中,由于在平板上长出的菌落较多且相互之间的竞争关系,大多数菌株的溶磷能力受到抑制,并不是所有的菌株都会出现溶磷圈,且溶磷圈大小与溶磷能力之间是否存在相关性还有待研究,Nautial[10]、冯哲叶[11]、马骢毓[12]等研究表明,溶磷圈的大小不能代表其溶磷能力的大小,本试验中14株菌株溶磷能力与溶磷圈大小之间的关系并不显著,因此溶磷圈仅是作为识别溶磷微生物的标志之一,在筛选溶磷能力强的微生物时,必须对其溶磷能力进行培养测定。
培养液中葡萄糖浓度或者硫酸铵浓度不同时,培养基中的碳氮比不同,对菌株生长量及溶磷能力影响不同。试验研究表明W4培养液中氮源增加,菌体大量生长,氮源对菌体的生长有决定作用;培养液中碳源缺乏时,溶磷能力急剧下降,碳源对菌株溶磷能力起决定性作用,但是培养液中碳源浓度过高时,溶磷能力增加不明显,菌体却大量减少,对菌体生长起到限制作用,这是因为溶磷微生物可以分解碳源产酸溶解难溶态磷酸盐,碳源浓度过多导致产酸增加,对菌株生长不利[13]。培养基中碳源和氮源的种类和含量通过影响产生有机酸的种类和浓度进而影响其溶磷能力[14],不同菌株对碳源和氮源的利用率不尽相同,胡山等[15]研究溶磷细菌Y3-35以葡萄糖为碳源,蛋白胨为氮源,溶磷能力最强。卫星等[16]发现一株巨大芽孢杆菌以葡萄糖和硫酸铵为最佳碳氮源,本试验中W4以葡萄糖和硝酸钾为碳氮源,溶磷能力最强。因此,培养环境中碳源、氮源的种类和浓度对于菌株的生长和溶磷能力的发挥具有重要的作用,是溶磷微生物应用中要重点考虑和研究的方面。
本试验中W4经鉴定属于伯克氏菌属(Burkholderiasp),该菌属在产脂肪酶[17]、促进作物生长[18]、生物防治及土壤修复[19]等方面都有报道,通过本试验的研究,以期为黄壤溶磷微生物的研究提供菌株资源和其应用提供理论基础。

