IRF3抑制LPS诱导肝星状细胞LX-2的炎症因子的分泌
刘云洁,程 玮,李 丽,顾 萌,徐 涛
肝纤维化是指病理因素所致肝脏内弥漫性细胞外基质(extracellular matrix,ECM)过度沉积的一个慢性肝损伤的病理过程[1-2]。若缺乏有效的干预手段,可最终发展为肝硬化,甚至肝癌[3]。肝纤维化的标志是肝星状细胞活化的过程,LX-2细胞是一种稳定的来源于人的肝星状细胞,曾被广泛地用作研究肝纤维化的细胞模型[4]。通常肝星状细胞的活化过程中伴随炎症因子的升高,而炎症反应又是引起纤维化的重要病理因素,因此探究炎症因子分泌的调节机制具有潜在的临床意义[5]。干扰素调节因子3(interferon regulatory factor 3,IRF3)是干扰素调节因子家族的重要成员,是合成I型干扰素的关键分子,在免疫防御系统中起着举足轻重的作用[6]。近年来,IRF3在肝脏疾病中屡见报道[7-8],表明IRF3是一个调控肝脏疾病的关键分子,该研究旨在探究IRF3在星状肝细胞中对炎症因子分泌的影响。
1 材料与方法
1.1细胞系LX-2细胞系受赠于Dr. Scott Friedman(美国纽约西奈山医学院)。 LX-2细胞在采用含10%胎牛血清的DMEM培养液(105 U/L青霉素和100 g/L)培养,在含5% CO2饱和湿度恒温培养箱条件(37 ℃)下孵育。LX-2细胞贴壁生长,胰酶消化后取对数生长期细胞用于实验。
1.2药品和试剂肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)(美国R&D Systems公司); TRIzol(日本TaKaRa公司);BCA法蛋白浓度定量试剂盒(武汉生物科技有限公司);丙烯酰胺、甲叉双丙烯酰胺、脂多糖(LPS)、DMSO(美国Sigma公司);PVDF 膜(北京Solarbio 公司);胎牛血清、DMEM高糖培养基、胰蛋白酶(美国GBICO公司);磷酸盐缓冲液(PBS)、RIPA细胞强裂解液、蛋白酶抑制剂(PMSF)(上海碧云天生物技术有限公司);TRIzol (美国Invitrogen公司);qRT-PCR引物的合成(上海生工生物工程技术服务有限公司);逆转录试剂盒(美国MBI Fermentas公司);质粒pcDNA3-IRF3空载体pcDNA3(美国Addgene公司);TNF-α单克隆抗体(美国Abcam公司);核因子抑制蛋白(kappa B inhibitor protein,IκB)、p-IκB、白介素6(interleukin-6, IL-6)单克隆抗体(南京巴傲德公司);p-p65、IRF3(美国Cell Signaling Technology公司);p65、β-actin单克隆抗体(美国Santa Cruz公司);辣根过氧化酶标记抗兔和抗鼠IgG(北京中杉金桥公司);ECL化学发光试剂盒(美国Pierce公司)。
1.3主要仪器NAPCO-6100型细胞恒温培养箱购自美国SHELLAB公司;SWCJ-1F型单人双面超净工作台购自江苏苏州安泰空气技术有限公司;MLS—3020型自动高压灭菌锅购自日本Sanyo公司;3-16K型高速冷冻离心机购自美国Sigma公司提供;PCR梯度扩增仪购自德国Eppendoff公司;十二烷基硫酸钠一聚丙烯酰胺凝胶电泳(SDS-PAGE) 仪购自美国BioRad公司;Real-time PCR system购自美国热电公司。
1.4Westernblot法检测LX-2细胞用冷RIPA细胞裂解液加蛋白酶抑制剂PMSF冰上裂解,30 min后收集细胞裂解浑浊液,再于高速离心机4 ℃、12 000 r/min离心30 min,吸取上清液,用BCA法蛋白浓度定量试剂盒测定蛋白浓度。取50 μg蛋白样品,在10%聚丙烯酰胺凝胶电泳2 h,再电转移到活化的PVDF膜上,室温下在5%脱脂奶粉中在摇床上封闭3 h,洗净封闭液后加入一抗,于4 ℃冰箱中过夜。次日用TBST缓冲液洗净一抗,再用含辣根过氧化物酶标记的二抗孵育1 h,TBST缓冲液洗净二抗,最后用ECL发光剂进行检测,曝光、显影。以β-actin作为内参,分别以目的蛋白与β-actin光密度比值作为该目的蛋白的相对表达量。
1.5qRT-PCR法检测按TRIzol试剂说明书提取得到LX-2细胞总RNA,再立即用紫外分光光度计测定总RNA浓度,测定A260/A280比值, 重复3次, 测得该比值稳定于1.8~2.0。总的RNA逆转录得到cDNA,于10 μl体系上qRT-PCR system检测目的基因,β-actin用作内参。实验重复3次。qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.6瞬时转染过表达质粒pcDNA3-IRF3LX-2细胞在无血清的培养基DMEM中饥饿12 h,然后取约2×105~3×105个/ml细胞接种在6孔板中,正常培养,次日按照LipofectamineTM2000说明书方法转入质粒pcDNA3-IRF3和空载体pcDNA3,6 h后弃去Optim-MEM, 换为正常培养基培养细胞用于实验。用Western blot和qRT-PCR法检测转染效率。

2 结果
2.1IRF3在LPS诱导的LX-2细胞中表达受到抑制用2 μg/ml LPS刺激LX-2细胞不同时间后,如图1和图2所示,Western blot和qRT-PCR结果表明IRF3在LPS刺激后12 h,与正常组比较,蛋白和基因水平上明显受到抑制(F=18.845,P<0.01;F=
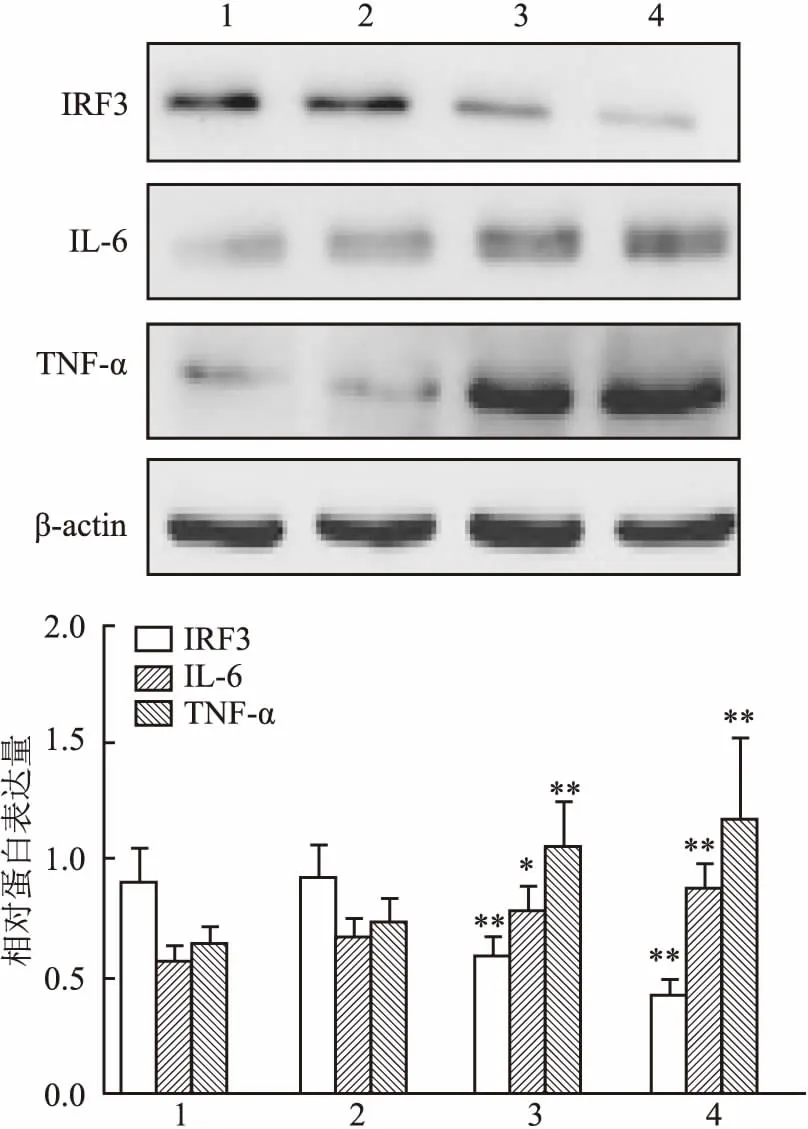
图1 IRF3在LPS诱导的LX-2细胞中的蛋白表达
1:正常组;2:LPS刺激6 h组;3:LPS刺激12 h组;4:LPS刺激24 h组;与正常组比较:*P<0.05,**P<0.01

图2 IRF3在LPS诱导的LX-2细胞中的mRNA表达
1:正常组;2:LPS刺激6 h组;3:LPS刺激12 h组;4:LPS刺激24 h组;与正常组比较:**P<0.01
27.922,P<0.01),差异有统计学意义。炎症因子TNF-α在LPS刺激12 h后,蛋白和基因表达量则明显上调(F=176.32,P<0.01;F=184.21,P<0.01);IL-6在LPS刺激12 h后,蛋白和基因表达量也明显上升,差异有统计学意义(F=69.998,P<0.01;F=177.01,P<0.01)。
2.2IRF3抑制炎症因子的释放根据上述结果,选择用2 μg/ml LPS刺激LX-2细胞12 h用于实验。如图3、4、5所示,Western blot、qRT-PCR及ELISA结果显示,与正常组比较,IRF3在LPS刺激下12 h后表达显著下调;而转染pcDNA3-IRF3后,与pcDNA3空载体对照组和正常组相比,IRF3蛋白和基因表达量都显著增加(F=21.303,P<0.01;F=18.358,P<0.01),说明转染效果较好。而炎症因子TNF-α的蛋白和基因表达量与pcDNA3空载体对照组比较,则明显受到抑制(F=24.255,P<0.01;F=188.028,P<0.01),另一炎症指标因子IL-6在蛋白和基因水平上也表现出相同的趋势(F=54.689,P<0.01;F=107.817,P<0.01),差异具有统计学意义。这表明在LPS诱导的LX-2细胞中IRF3抑制炎症因子的释放。

图3 过表达IRF3后IL-6及TNF-α的蛋白表达
1:正常组;2:LPS刺激组;3:LPS刺激组+转染空质粒pcDNA3对照组;4:LPS刺激组+转染质粒pcDNA3-IRF3组;与正常组比较:**P<0.01;与pcDNA3空载体对照组比较:##P<0.01

图4 过表达IRF3后IL-6及TNF-α的mRNA表达
1:正常组; 2:LPS刺激组;3:LPS刺激组+转染空质粒pcDNA3对照组; 4:LPS刺激组+转染质粒pcDNA3-IRF3组;与正常组比较:*P<0.05,**P<0.01;与pcDNA3空载体对照组比较:##P<0.01

图5 ELISA检测过表达IRF3后细胞分泌的IL-6及TNF-α蛋白表达
1:正常组;2:LPS刺激组;3:LPS刺激组+转染空质粒pcDNA3对照组;4:LPS刺激组+转染质粒pcDNA3-IRF3组;与正常组比较:**P<0.01;与pcDNA3空载体对照组比较:##P<0.01
2.3IRF3对NF-κB信号通路的影响Western blot方法表明,LX-2细胞在LPS刺激后12 h后,与正常组比较,p-p65及p-IκBα表达量明显升高,提示NF-κB信号通路激活。而与pcDNA3空载体对照组比较,过表达IRF3后,p-IκBα及p-p65蛋白表达量显著下调(F=131.045,P<0.01;F=122.267,P<0.01),而非磷酸化的IκBα和p65蛋白水平未见显著改变(F=1.317,P>0.05;F=0.043,P>0.05),表明IRF3抑制NF-κB信号通路的激活。见图6。

图6 IRF3对NF-κB信号通路的影响
1:正常组;2:LPS刺激组;3:LPS刺激组+转染空质粒pcDNA3对照组;4:LPS刺激组+转染质粒pcDNA3-IRF3对照组;与正常组比较:**P<0.01;与pcDNA3空载体对照组比较:##P<0.01
3 讨论
在哺乳动物中,目前已知的干扰素转录因子家族共包含9个成员,分别命名为IRF1~9,其中IRF3广泛表达于个体各种组织及细胞中,在合成I型干扰素及其诱导基因的生化过程中起着关键作用[6]。IRF3除了在免疫系统中起着重要的调节作用外,近年来研究[9]报道,IRF3在脂质代谢、急性肝损伤、肿瘤等也起着显著的调节作用。本实验中重点研究了IRF3在星状细胞中对炎症因子分泌的影响。
脂多糖LPS是革兰阴性细菌的细胞壁组成成分,是革兰阴性菌致病的主要因素,可以引起机体一系列的炎症反应[10],在本实验中用浓度为2 μg/ml 的LPS诱导激活LX-2细胞。
研究[11]表明,NF-κB是细胞内重要的核转录因子,其参与多种基因的表达和调控,介导调节炎症反应。当细胞处于静息状态时,NF-κB二聚体通过非共价键的形式与其抑制蛋白IκB结合而分散在细胞质内,包括内质网应激在内的许多因素可激活NF-κB,激活后的NF-κB进入细胞核,与DNA模块上的特异蛋白结合,诱导特异mRNA的产生,最后转录、产生和释放各种细胞因子。本实验用LPS诱导激活细胞,再通过瞬时转染质粒pcDNA3-IRF3过量表达IRF3,观测其对NF-κB信号通路的影响,结果显示NF-κB信号通路中的关键蛋白p-p65及P-IκBα表达量与pcDNA3空载体对照组相比明显减少,而p65和p-IκB表达量未见改变,提示IRF3可能是通过抑制NF-κB从而减少炎症因子的释放。IRF3在LPS诱导的星状细胞中能够抑制炎症因子的分泌,说明IRF3可能参与了肝脏炎症和纤维化的病理过程,但由于肝纤维化发生发展的病理因素复杂,IRF3在纤维化中扮演的角色需要进一步的探究。

