转录因子GRHL3促进皮肤鳞癌细胞迁移和侵袭
邓庆梅,周利利,郭思佳,陈津津,郭立钰,曾凡军,周海胜,3
果蝇头状因子(grainyhead-like,GRHL)基因家族高度保守,所编码的转录因子在胚胎发育过程中发挥关键的调控作用。果蝇头状因子3(grainyhead like-3,GRHL3)是 Grainyhead基因家族成员之一,参与哺乳动物表皮的发育和修复[1-5]。基因组测序发现在非综合性腭裂的家族发生GRHL3基因突变并影响血管内皮细胞的迁移过程[6-8]。
研究[9]证实,在早期乳腺癌中GRHL3表达量升高;乳腺癌及肺癌细胞GRHL3可以通过正调控上皮细胞钙黏蛋白(E-cadherin)的表达,抑制间质细胞上皮细胞转分化的发生和肿瘤细胞转移[10-11]。但GRHL3也可以结合E-cadherin基因启动子抑制其表达,促进肿瘤细胞的迁移和侵袭[12]。因此GRHL3调控靶基因的种类及其调控方式存在较大差异性。该研究以皮肤鳞癌细胞A431作为研究对象,建立过量表达GRHL3的细胞株,以搜寻GRHL3调控皮肤鳞癌细胞迁移和侵袭相关的靶基因。
1 材料与方法
1.1组织标本、细胞系与载体人正常皮肤组织标本(3例)由安徽医科大学附属省立医院病理科提供。皮肤癌组织芯片标本购自西安艾丽娜生物科技有限公司(SK804)。其中SCC组织标本17例,包括4例T1M0N0、9例T2M0N0、4例T3M0N0;SCC癌旁组织标本10例。人SCC细胞系A431由本实验室保存。pCMV-2B-FLAG-vector载体购自美国Promega公司。携带人GRHL3 cDNA的重组表达载体pCMV-2B-FLAG-GRHL3由本实验室构建。
1.2试剂高糖DMEM培养基和青霉素/链霉素双抗试剂购自美国Hyclone公司;胎牛血清(FBS)购自美国Corning公司;TRIzol试剂盒和转染试剂Lipofectamine 3000购自美国Invitrogen公司;鼠源抗GAPDH的抗体购自美国Abcam公司;兔源抗GRHL3的抗体购自美国Novus公司(NBP1-8035);兔源抗FLAG的抗体购自美国Sigma公司(F1804-200UG);用于免疫组化的二抗、DAB显色试剂盒自北京中杉金桥生物技术公司;G418购自美国Santa cruz公司;逆转录试剂盒购自大连宝生生物公司;ChIP试剂盒购自美国Cell Signaling Technologies公司(#9002);基质胶和Boyden小室购自美国BD Biosciences公司。
1.3方法
1.3.1细胞培养 人SCC细胞系A431细胞用含10%热失活的胎牛血清(FBS)和1%青、链霉素的高糖DMEM培养基,放置于37 ℃、5% CO2的培养箱中培养。
1.3.2细胞系构建 将状态良好的A431细胞传代后接种至6孔板中,并用含血清不含双抗的培养基培养。第2天用Lipofectamine 3000将过表达载体pCMV-2B-FLAG-GRHL3及对照组载体pCMV-2B-FLAG-vector转染A431细胞。2 d后加入400 μg/ml G418筛选3~4周,构建稳定过量表达GRHL3的细胞系。
1.3.3表达谱芯片检测和分析 利用TRIzol试剂盒提取A431细胞和过量表达GRHL3的A431细胞总RNA,按照逆转录试剂盒说明书进行逆转录制备cDNA。由上海康成生物有限公司进行RNA表达谱检测,差异表达基因筛选利用NimbleScan RMA(Version 2.5)软件进行分析。差异表达基因的筛选标准为:与对照组比较,基因表达水平相差2倍以上(Fold change≥2.0)为候选基因。聚类分析利用在线分析网站http://pantherdb.org/。
1.3.4染色质免疫共沉淀-测序分析(chromatin immunoprecipitation-sequcing, ChIP-seq) 利用抗Flag抗体,根据ChIP试剂盒按照说明书操作,捕获GRHL3结合的DNA,送上海康成生物有限公司进行DNA测序。GRHL3结合峰分析使用Model-based Analysis of ChIP-seq(MACS version 1.4)软件进行分析。GRHL3调控候选基因聚类分析利用在线分析软件http://pantherdb.org/。
1.3.5Western blot 去除细胞培养基,用PBS洗2次,加入细胞裂解液,收集细胞冰上裂解30 min。裂解液用恒温金属浴100 ℃、10 min,使蛋白变性。加样后进行聚丙烯酰胺凝胶(10%)电泳。再以恒流170 mA转膜约1.5 h。PVDF膜用5%脱脂牛奶的封闭液封闭约40 min。分别加入对应的一抗包括GAPDH(1 ∶5 000)、GRHL3(1 ∶1 000)和FLAG抗体(1 ∶2 000),4 ℃孵育过夜。次日用1×TBST缓冲液漂洗3次,加入二抗(1 ∶5 000)孵育6 h,增强化学发光法X胶片曝光显影。
1.3.6Transwell侵袭实验和迁移实验 侵袭实验:基质胶用培养基稀释8倍,将胶加入小室,每个小室加50 μl,静置过夜。细胞调整为2.0×105/ml,取200 μl加至上室,下室加600 μl的5% FBS培养基,37 ℃、5% CO2的培养箱中培养36 h。取出小室,甲醇固定20 min,苏木精染色10 min,洗涤,伊红染色2 min,冲洗后擦去上层细胞,制片,计数。迁移实验:小室不用基质胶处理,其他方法与侵袭实验相同。
1.3.7免疫组织化学分析 根据参考文献[13]方法, 组织标本用5%多聚甲醛固定15 d,脱水包埋,切片(4 μm)脱蜡入水微波加热进行抗原修复,3%过氧化氢去除内源性过氧化氢酶,滴加一抗(1 ∶200)4 ℃过夜,先后滴加试剂1和试剂2,37 ℃孵育15 min,DAB显色,自来水冲洗、复染、脱水、透明、封片。

2 结果
2.1SCC组织GRHL3表达利用免疫组织化学方法检测收集的SCC组织标本的GRHL3的表达。结果显示:正常皮肤组织中GRHL3的表达水平较低,仅仅局限于皮肤基底层的角质形成细胞表达;而皮肤癌旁组织GRHL3表达较正常皮肤组织明显增加,而对于皮肤癌组织中GRHL3表达水平较癌旁组织显著增加。见图1。对癌旁组织和不同病例分期的皮肤癌组织分析显示,10例癌旁组织中GRHL3均有表达;而TNM分期的病例组织中,4例T3N0M0的GRHL3表达均为阳性, T2N0M0的癌组织GRHL3阳性率为88.9%, T1N0M0的癌组织GRHL3阳性率为75.0%。见表1。提示GRHL3的表达可能与皮肤鳞癌的分期有关,并且可能参与皮肤鳞癌发生发展过程。

表1 皮肤鳞癌病理分期与GRHL3表达[%(n)]
2.2过表达GRHL3促进A431细胞的侵袭和迁移将带有FLAG标签用于过量表达GRHL3的表达载体pCMV-2B-FLAG-GRHL3转染到A431细胞,构建稳定过量表达GRHL3的细胞系A431/GRHL3;同时将对应的空载pCMV-2B-FLAG-vector转染A431作为对照组细胞(A431/Vec)。Western blot结果显示:转染GRHL3的A431细胞中可以明显检测到FLAG标签和GRHL3的过量表达,见图2A,提示成功构建过量表达GRHL3细胞系。将A431/Vec和A431/GRHL3的细胞进行Transwell侵袭和迁移实验。过量表达GRHL3的A431细胞的侵袭能力和迁移能力较对照组细胞明显增加。见图2B。计算单个视野内穿孔的细胞数,结果显示过量表达GRHL3的侵袭细胞数为14.8,对照组穿孔细胞数为6.7,差异有统计学意义(F=15.40,P<0.001);过量表达GRHL3的迁移细胞数为43.7,而对照组迁移的穿孔细胞数13.8,差异有统计学意义(F=301.19,P<0.001)。见图2C。
2.3表达谱芯片分析提取过量表达GRHL3的A431细胞和对照组细胞的总RNA进行逆转录获得cDNA,进行基因表达谱分析。结果显示:与对照组细胞比较,过量表达GRHL3导致表达水平变化2倍以上的基因总数为5 207个。见表2。在这些差异表达的基因中,细胞运动相关分子57个,细胞黏附相关分子72个。经过比较表明CDH3分子具有调控细胞运动和细胞黏附的功能。因此与细胞侵袭和迁移密切相关的分子为128个。
2.4ChIP-seq检测GRHL3的调控基因利用建立的稳定过量表达Flag-GRHL3的A431细胞,以Anti-Flag 抗体通过染色质免疫共沉淀技术捕获DNA进行DNA测序。GRHL3在基因组上结合峰是以结构基因转录起始点为中心,分别分析结构基因启动子区结合峰(±2.0 kb)、上游结合结合峰(-2.0~-20.0 kb)、基因间区结合峰、内含子结合峰、外显子结合峰。见图3A。GRHL3在基因组中特异性结合的DNA分布。见图3B。其中,GRHL3结合的主要位置是在基因间区(55.65%),只有2.49%位于结构基因的启动子区域。通过测序证实受GRHL3调控的靶基因的数量达到5 702个,与细胞侵袭和迁移密切相关的基因为149个。见图3C。其中,细胞运动相关分子65个,细胞黏附相关分子84个。GRHL3过量表达A431细胞的基因表达谱分析发现128个差异表达基因与细胞侵袭和迁移密切相关,其中有26个基因与ChIP-seq提示的GRHL3调控细胞侵袭和迁移相关候选靶基因具有一致性。
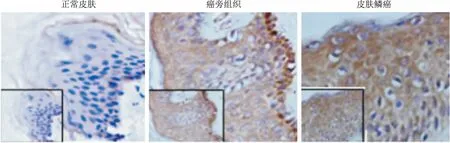
图1 免疫组织化学检测GRHL3表达

图2 过量表达GRHL3促进A431细胞侵袭和迁移
A:Western blot检测GRHL3过量表达;B:Transwell细胞侵袭和迁移×100;C:A431过量表达GRHL3对细胞侵袭和迁移的影响;与对照组A431/Vec比较:***P<0.001

表2 A431/GRHL3细胞的差异表达基因及GRHL3调控基因的聚类分析
*GO:Gene Ontology(基因本体数据库)

图3 ChIP-seq分析GRHL3在基因组上结合位点及其调控的候选基因
A:ChIP-seq分析GRHL3在基因组DNA的结合位置;B:GRHL3在基因组DNA结合区域分布;C:A431/GRHL3细胞侵袭和迁移相关差异表达基因与ChIP-seq提示GRHL3调控细胞侵袭和迁移的候选基因比较;TSS:transcription start site(转录起始位点)
3 讨论
GRHL3作为核内转录因子,在果蝇和小鼠体内主要参与调控多种表皮屏障形成及终末分化有关。研究[1-4]表明GRHL3主要在外胚层细胞尤其是上皮细胞的分化和迁移过程中发挥作用,例如,GRHL3-/-小鼠天生眼脸闭合不全,而且有神经管闭合障碍。因此,GRHL3可以促进外胚层上皮迁移,从而修复早期上皮闭合过程中的上皮缺陷。由此提示GRHL3可能与肿瘤细胞的迁移或侵袭具有相似性。GRHL3在上皮来源肿瘤发生发展中作用存在争议。如敲除小鼠角质形成层细胞中的GRHL3,可诱发SCC的发生[13],其原因可能是GRHL3敲除的角质形成细胞分化与增殖平衡受到破坏,导致对化学诱导肿瘤的敏感性升高。而在非三阴性乳腺癌及晚期小细胞肺癌和肺腺癌的组织中,GRHL3表达量升高[10-11]。同时,有研究[14]证实GRHL3可以结合miR-21基因启动子抑制肿瘤发生。可见GRHL3可能是一种原癌基因。组织免疫化学的方法检测显示正常皮肤组织中GRHL3主要表达在皮肤角质形成细胞,可能参与正常皮肤的角质形成细胞向表皮层迁移;而癌旁组织和癌组织中GRHL3表达明显高于正常皮肤组织,提示GRHL3表达与SCC的迁移和侵袭有关。为证实GRHL3对SCC细胞的迁移和侵袭能力的影响,选择低迁移和低侵袭能力的皮肤鳞癌细胞系A431作为研究的细胞模型,并建立了过量表达GRHL3的细胞株。与对照组比较,过量表达GRHL3的细胞株迁移能力和侵袭能力显著增加。
研究[11]显示GRHL3在正常小鼠的乳腺导管上皮细胞、乳腺癌细胞及肺癌细胞通过正调控E-cadherin的表达,促进间质细胞-上皮细胞转分化的发生。然而,前期研究[12]证实GRHL3可以结合E-cadherin的启动子,抑制E-cadherin表达,进而促进肿瘤细胞的迁移和侵袭。因此GRHL3作为转录因子,在不同类型的肿瘤及肿瘤的不同阶段,调控肿瘤细胞的侵袭和迁移相关的靶基因及其调控机制目前仍不清楚。为了研究GRHL3上调SCC迁徙和侵袭的分子机制,通过基因表达谱分析显示:GRHL3过量表达导致A431细胞有128个基因表达变化与细胞侵袭和迁移密切相关。进一步通过ChIP-seq分析显示GRHL3在调控靶基因表达时,其结合部位主要分布于结构基因的基因间区,仅有少数靶基因是依赖于调控启动子活性而影响其表达。其原因可能是在基因间区或内含子区域存在靶基因的增强子或沉默子[15],GRHL3可能与调控这些顺式作用元件的活性有关。GRHL3调控参与细胞侵袭和迁移的基因数为149个。其中有26个基因与基因表达谱差异表达基因一致。提示这26个与肿瘤细胞的迁移和侵袭相关的基因可能是GRHL3调控的候选靶基因。
利用表达谱芯片分析和ChIP-seq分析技术筛选获得GRHL3调控的候选靶基因,有助于后续进一步验证这些候选靶基因对SCC细胞的迁移和侵袭的作用,并有利于揭示GRHL3调控SCC的迁移和侵袭的作用机制。

