映山红花总黄酮对大鼠心肌细胞收缩性的影响及其机制
孙晓青, 陈志武
尾加压素Ⅱ(urotensinⅡ, UⅡ)最初是从硬骨鱼垂体腺中分离出来的一种环形结构调节肽,人尾加压素Ⅱ(human UII, hU Ⅱ)含有11个氨基酸, 主要表达在心血管系统, 越来越多的研究[1-2]表明由hU Ⅱ及其受体(UT受体)组成的urotensin系统对机体心血管生理功能起着重要的调节作用。映山红花,系杜鹃科植物,在我国具有广泛的分布,是一种重要的中药资源。映山红花总黄酮(total flavones of rhododendra, TFR)系从映山红花中提取的黄酮类有效部位,其主要成分为槲皮素、金丝桃苷及芦丁等化合物[3]。课题组前期研究表明TFR能够抗大鼠心肌缺血性损伤[4],并抑制心肌梗死后心室重构[5],但不清楚TFR是否通过直接影响心肌细胞的收缩性来发挥抗心肌缺血性损伤作用。该研究观察了TFR对体外培养的新生大鼠心肌细胞收缩性的影响,并探讨其作用机制。
1 材料与方法
1.1实验动物1 d 龄SPF级新生SD大鼠,雌雄各半,共64只,体质量5.5~6.5 g,由安徽医科大学实验动物中心提供。动物饲养于安静、通风良好和有空气过滤系统的环境中,12 h日光灯昼夜循环,保持实验室内温度(22±2)℃,相对湿度(50±5)%。
1.2主要试剂TFR购自合肥合源医药科技有限公司,黄色粉末,总黄酮质量分数达85%以上,实验前用生理盐水配成所需浓度;hU Ⅱ、Ⅱ型胶原酶、TRIton X-100、钙荧光探针Fluo-8 AM购自美国Sigma公司;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国BI公司;胰酶购自维森特生物技术(南京)有限公司;FITC标记的山羊抗鼠荧光二抗购于美国Proteintech公司;α-横纹肌肌动蛋白(α-Sarcomeric actin,α-SCA)单克隆抗体购自武汉博士德生物有限公司;DAPI染色液购自上海碧云天生物技术研究所;其余试剂为国产分析纯。
1.3新生大鼠心肌细胞的培养与鉴定新生大鼠(每次10只)固定于超净工作台上,用75%酒精消毒其皮肤,打开胸腔取出心脏,在盛有PBS缓冲液的平皿中清洗之后,剪掉心房,把心室放在另一平皿中,用PBS缓冲液反复清洗3次;将一定数目的心室放进青霉素小瓶中,将心脏剪成1 mm×1 mm×1 mm的碎块;将心肌组织的碎块,加入0.25%胰酶和0.1% Ⅱ型胶原酶(1 ∶1)的混合消化液,反复吹打3 min后盖紧, 放入温箱中孵育5 min,取出后再反复吹打3 min,待自然沉降后弃去上清液;剩余沉淀再加入2 ml消化液,反复吹打3 min后放入37 ℃温箱中消化8 min,静置后用吸管将上清液移入10 ml离心管中,剩余沉淀用同样条件及方法继续消化;每次消化产物以1 000 r/min离心8 min,轻轻用吸管弃去上清液后,将细胞重悬于含15%胎牛血清的DMEM培养液,细胞悬液用200目铜网过滤后接种在培养皿;37 ℃、5% CO2培养箱中孵育1 h后,轻轻将细胞悬液吸出,以4×105个/ml的密度接种在24孔培养板上,置培养箱中培养。第2天更换培养液,并用含10 μmol/L 5-溴脱氧尿嘧啶的培养液维持48 h,以抑制非心肌细胞的增殖。以后每2 d换液1次。① 形态学观察:倒置显微镜下观察心肌细胞的大小、形态、搏动情况、生长特性及排列方式等;② 取无菌的小盖玻片放入24孔板内,取培养的心肌细胞加入到24孔板,进行培养,制成细胞爬片。等细胞培养到第3天弃去培养液,用预冷的PBS缓冲液清洗爬片2次,用含0.3% TRIton X-100(PBS缓冲液稀释)的多聚甲醛室温下固定30 min,弃去多聚甲醛,用PBS洗3次,室温下加山羊血清封闭液30 min;弃去封闭液,加入1 ∶50 稀释的小鼠抗大鼠α-SCA单克隆抗体于4 ℃过夜(阴性对照用PBS代替),PBS 洗3次;1 ∶100稀释的FITC标记山羊抗鼠二抗室温孵育2 h,PBS洗3次;DAPI染色液孵育10 min,PBS洗3次;抗荧光淬灭液封片后立即置于倒置荧光显微镜下观察,统计阳性细胞数。
1.4心肌细胞收缩频率和收缩幅度的测定将上述培养的原代新生大鼠心肌细胞移入6孔培养板中,分别加入PBS、各浓度的TFR(3.7、11.1、33.3、100、300 mg/L)或hU Ⅱ(10、100 nmol/L),置37 ℃、5% CO2培养箱中培养,然后于1 000 r/min离心5 min,弃去培养液,用PBS快速冲洗2次,细胞调成1×106个/ml的密度,再次移入6孔培养板中,倒置显微镜下观察单个心肌细胞搏动情况,计数其搏动频率,并用Image-Pro Plus 6.0专业图像分析软件测量细胞面积(m2),以一个心动周期内细胞的最大面积和最小面积之间的差值占最大面积的百分比作为细胞的收缩幅度(%)。每个培养孔中观察10个细胞,以其平均搏动频率和平均收缩幅度为观察指标,实验独立重复6次。另取一批细胞,先用100 nmol/L hU Ⅱ预处理48 h后,再加入各浓度的TFR后,同样方法测定细胞的平均搏动频率和平均收缩幅度。
1.5心肌细胞内Ca2+含量的测定加药处理后,细胞爬片用台式缓冲液(pH 7.4)(5 mmol/L KCl,130 mmol/L NaCl,1 mmol/L MgSO4,2 mmol/L CaCl2,8 mmol/L NaOH,20 mmol/L HEPES)清洗3次,以终浓度0.2%的Fluo-8 AM 2 μl加入2 ml台氏液中,37 ℃孵育30 min,之后用PBS清洗3次,通过氩激光器进行激光图像采集,激发波长为488 nm,发射波长为520 nm,采集频率被设置为每10 s一个图像。徕卡DMLFSA显微镜下使用Metafluor成像系统中集成CCD(电荷耦合器件)相机记录单视野内细胞内钙荧光成像并通过图像分析软件分析图像中兴趣区域内荧光强度的变化,间接反映细胞内游离的Ca2+浓度。

2 结果
2.1新生大鼠心肌细胞的原代培养与鉴定光学显微镜下观察,刚分离的心肌细胞呈圆形,然后变为梭形;24 h后细胞基本贴壁,单个细胞出现自发性搏动,搏动频率和节律有所不同;48 h后伸出伪足,细胞相互接触,交织成网,细胞搏动趋于同步化。见图1。用免疫荧光法检测原代心肌细胞中特异性α-SCA蛋白,在原代心肌细胞中α-SCA抗原表达呈阳性,且位于胞质中,DAPI染色的细胞核呈蓝色荧光。高倍镜下取数个视野,计算其平均值,结果显示阳性细胞率为98%。见图2。

图1 光镜下原代培养的新生大鼠心肌细胞 ×200
2.2hUⅡ对心肌细胞收缩频率的影响在给予hU Ⅱ前,各组心肌细胞收缩频率并无差异;与对照组比较,hU Ⅱ 10、100 nmol/L作用48 h能够加快心肌细胞的收缩频率(F=78.16,P<0.05)。见表1。
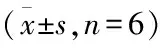
表1 hUⅡ对心肌细胞收缩频率的影响
与对照组比较:*P<0.05,**P<0.01
2.3hUⅡ对心肌细胞收缩幅度的影响在给予hU Ⅱ前,各组心肌细胞收缩幅度并无差异;与对照组比较,hU Ⅱ 10 nmol/L处理48 h能够增强心肌细胞收缩幅度(t=2.56,P<0.05),而hU Ⅱ 100 nmol/L处理48 h能够降低心肌细胞收缩幅度(t=5.41,P<0.01)。见表2。
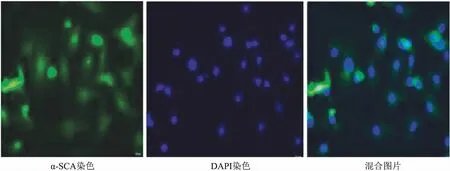
图2 心肌细胞中α-SCA抗原表达 免疫荧光染色×400

表2 hUⅡ对心肌细胞收缩幅度的影响
与对照组比较:*P<0.05,**P<0.01
2.4TFR对心肌细胞收缩频率的影响药物作用时间为30 min,与对照组比较,TFR 3.7~100 mg/L浓度对心肌细胞收缩频率几乎无影响,而TFR 300 mg/L能够减慢心肌细胞收缩频率(F=2.932,P<0.05)。见表3。
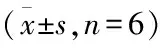
表3 TFR对心肌细胞收缩频率的影响
与对照组比较:*P<0.05
2.5TFR对心肌细胞收缩幅度的影响药物作用30 min后,与对照组比较,TFR 3.7~100 mg/L对心肌细胞收缩幅度几乎无影响,而TFR 300 mg/L能够增强心肌细胞收缩幅度(F=3.48,P<0.05)。见图3。

图3 TFR对心肌细胞收缩幅度的影响
1:对照组;2:TFR 3.7 mg/L组;3:TFR 11.1 mg/L组;4:TFR 33.3 mg/L组;5:TFR 100 mg/L组;6:TFR 300 mg/L组;与对照组比较:*P<0.05
2.6TFR对hUⅡ预处理心肌细胞收缩频率的影响与给予hU Ⅱ前比较,给予hU Ⅱ处理48 h后,心肌细胞收缩频率增加(t=6.92、6.91、7.79、9.28、6.88、8.82,P<0.05);与对照组比较,TFR 33.3~300 mg/L能够浓度依赖性地减弱hU Ⅱ引起的心肌细胞收缩频率的增加(F=17.53,P<0.05)。见表4。
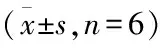
表4 TFR对hUⅡ预处理心肌细胞收缩频率的影响
与对照组比较:*P<0.05,**P<0.01;与给予hUⅡ前比较:#P<0.05
2.7TFR对hUⅡ预处理心肌细胞收缩幅度的影响心肌细胞以100 nmol/L hUⅡ预处理48 h,然后再给予不同浓度的TFR处理30 min。与对照组比较,给予hUⅡ 100 nmol/L 处理48 h后,心肌细胞收缩幅度下降(t=2.504,P<0.01),与单独给予hUⅡ 100 nmol/L组比较,TFR 33.3~300 mg/L能够改善hUⅡ引起的心肌细胞收缩幅度的下降(F=16.76,P<0.05 )。见图4。
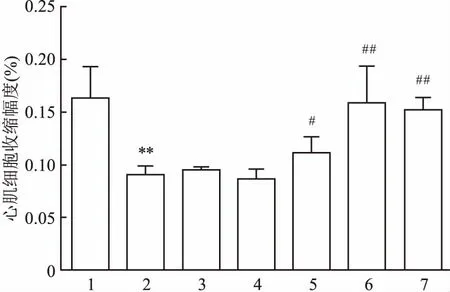
图4 TFR对hUⅡ预处理心肌细胞收缩幅度的影响
1:对照组;2:hUⅡ 100 nmol/L组;3:hUⅡ 100 nmol/L联合TFR 3.7 mg/L 组;4:hUⅡ 100 nmol/L联合TFR 11.1 mg/L组;5:hUⅡ 100 nmol/L联合TFR 33.3 mg/L组;6:hUⅡ 100 nmol/L联合TFR 100 mg/L组;7:hUⅡ 100 nmol/L联合TFR 300 mg/L组;与对照组比较:**P<0.01;与hUⅡ 100 nmol/L组比较:#P<0.05,##P<0.01
2.8TFR对hUⅡ诱导的心肌细胞内游离的Ca2+含量增加的影响与对照组比较,加入10 nmol/L hU Ⅱ处理48 h,可显著地增加心肌细胞在488 nm波长光激发下,在520 nm处产生的荧光强度,100 nmol/L hU Ⅱ进一步增加心肌细胞的荧光强度(F=669.67,P<0.01);但TFR 100 mg/L可明显地抑制100 nmol/L hU Ⅱ诱导该荧光强度的增加(t=13.32,P<0.01),结果表明TFR可显著地抑制hU Ⅱ诱导的心肌细胞内游离的Ca2+含量增加。见图5。
3 讨论
心肌细胞收缩频率的降低可减少心肌耗氧量,而收缩幅度的增强可增加心肌耗氧量。本研究应用原代培养的新生大鼠心肌细胞,显示TFR能够减慢心肌细胞收缩频率,但增加心肌细胞的收缩幅度。因此,TFR减慢心肌细胞收缩频率可能抵消其增加心肌细胞收缩幅度引起的心肌耗氧量的增加,提示TFR有可能在不增加心肌耗氧量的情况下加强心肌收缩性,这对改善心肌缺血性损伤导致的心功能下降是有利的。
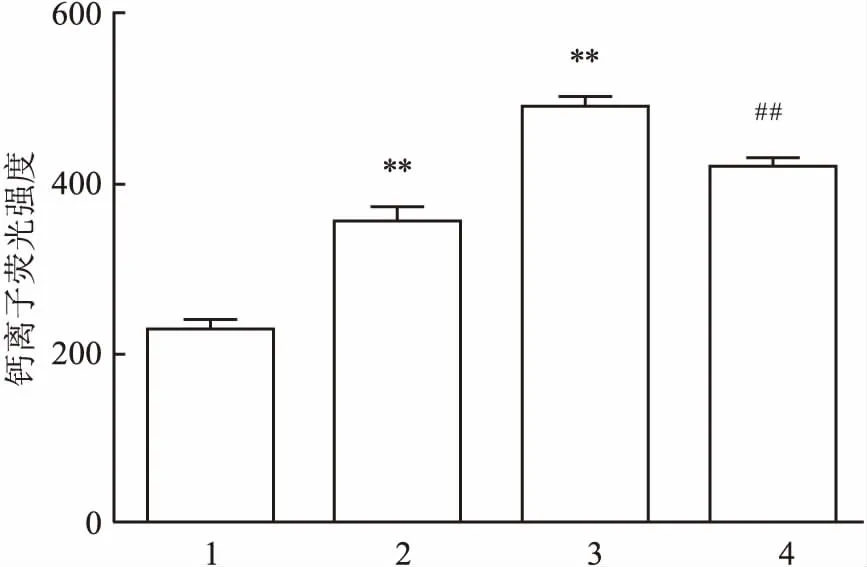
图5 hUⅡ及TFR对心肌细胞内Ca2+荧光强度的影响
1:对照组;2:hUⅡ 10 nmol/L组;3:hUⅡ 100 nmol/L组;4:hUⅡ 100 nmol/L联合TFR 100 mg/L组;与对照组比较:**P<0.01;与hUⅡ 100 nmol/L组比较:##P<0.01
大量研究[6-7]表明hU Ⅱ与UT受体结合能够产生多种生物学效应,并在多种心血管疾病的病理生理过程中发挥重要作用,是很有前景的治疗新靶点。本研究显示hU Ⅱ在10 nmol/L能够增加心肌细胞收缩幅度,而在100 nmol/L反而降低心肌细胞收缩幅度,表明高低不同浓度的hU Ⅱ对心肌细胞收缩性的影响是不同的,这与Dong et al[8]的研究结果较相似,结果显示UⅡ对血管作用呈双相性,即浓度小于10-9mol /L可产生内皮依赖性舒张作用,而超过10-9mol /L可直接收缩血管平滑肌。但是本研究表明,无论是10 nmol/L hU Ⅱ,还是100 nmol/L hU Ⅱ均可明显地增加心肌细胞收缩频率。
文献[9]报道hU Ⅱ可通过UT受体增加细胞内Ca2+含量。本实验也显示hU Ⅱ在10和100 nmol/L浓度时能够增加心肌细胞内Ca2+浓度。心肌细胞的肌浆网不如骨骼肌发达,贮Ca2+量少,其收缩有赖于细胞外Ca2+的内流。10 nmol/L hU Ⅱ引起细胞内的Ca2+增加,对于心肌细胞的收缩力是一种正性促进作用,这与Al et al[10]的报道,hU Ⅱ在20 pmol/L~20 nmol/L能够浓度依赖性地增加右心室收缩力的结论相一致。文献[11]报道过度增加Ca2+内流将诱导细胞肥大[12],并且导致其收缩功能受损。这就可以解释为什么100 nmol/L hU Ⅱ在进一步增加心肌细胞的钙浓度时,反而降低心肌细胞收缩幅度。心肌细胞内Ca2+内流的增加可导致其自律性的增加,收缩频率是衡量自律性的一个指标,故而10和100 nmol/L hU Ⅱ均能够增加心肌细胞收缩频率。
本研究显示TFR在33.3~300 mg/L范围内,可浓度依赖性地抑制100 nmol/L hU Ⅱ引起的心肌细胞收缩幅度的下降和收缩频率的增加,改善心肌细胞收缩性。进一步研究还表明TFR可减少100 nmol/L hU Ⅱ导致的心肌细胞Ca2+含量的增加。研究[13]表明TFR能与UT受体竞争性结合从而拮抗hU Ⅱ的作用,结合本实验,可以推测TFR通过抑制hU Ⅱ与UT受体的结合,减少细胞内的Ca2+浓度, 从而改善心肌细胞的收缩性。

