黑米蛋白的功能与结构性质
高柳,向琴,李佳釔,刘娟,陈婵,车振明,刘平
(西华大学 食品与生物工程学院,四川 成都,610039)
黑米又称紫米,是一种食用大米,在我国大约有两千年的种植历史。黑米属于糯米的一种,由于其表皮是黑色的,所以称作黑米[1]。我国很多地方都有种植,具有代表性的有陕西黑米、贵州黑糯米、湖南黑米等。与普通大米相比,黑米含有特殊成分为VC、叶绿素、花青素、胡萝卜素及强心甙,熬制的米粥清香油亮,软糯适口,营养丰富,具有很好的滋补作用,因此被称为“补血米”、“长寿米”等。由于其富含营养成分,因此,深受消费者喜爱。
目前,国内外黑米的研究大多数是对其花色苷、黄酮等生物活性等方面[2-3],据报道,黑米中,蛋白质、脂肪、碳水化合物,以及钙、钾等含量较高,与普通大米相比,黑米中蛋白质含量大约在11.3%~15.2%[4]。关于黑米蛋白的研究鲜有报道,仅姜珊珊等[5]通过传统“碱提酸沉”法提取出黑米的蛋白质,经优化得出最佳的传统提取条件,但黑米蛋白的功能性质及结构表征却未见报道。本研究以黑米为原料,采用“碱提酸沉”法提取黑米蛋白,同时以大豆分离蛋白作为对照,对黑米蛋白的功能与结构性质进行研究,为黑米蛋白的综合利用提供理论基础。
1 材料与方法
1.1 试验材料
黑米,购于成都世纪百盛超市;大豆分离蛋白,山东禹王实业有限公司;大豆油,中粮福临门食品营销有限公司;蛋白标品,Takara公司。
三(羟甲基)胺基甲烷、十二烷基硫酸钠(SDS)、丙烯酰胺、过硫酸氨、N,N,N′,N′-四甲基乙二氨,北京索莱宝生物科技有限公司;NaOH、H2SO4、KBr、K2SO4、CuSO4、石油醚、考马斯亮蓝R-250,成都市科隆化学品有限公司。
1.2 试验仪器
LyoLab 3000冻干机,Heto公司;SpectraMaxi3x多功能酶标仪,美谷分子仪器(上海)有限公司;SOX406自动粗脂肪测定仪、K1100自动凯氏定氮仪,济南海能仪器有限公司;PA6-GF 30均质乳化机,上海恒川机械设备有限公司;Zetasizer Nano ZS 90马尔文激光粒度仪,英国马尔文仪器公司;MOS-450/AF-CD圆二色谱仪,法国Biologic公司;Nicolet 6700傅立叶变换红外光谱仪,赛默飞世尔科技公司;DTG-60差热热重同步分析仪,岛津仪器有限公司;DYY-8C电泳仪,北京市六一仪器厂。
1.3 试验方法
1.3.1 黑米蛋白提取工艺
黑米蛋白提取工艺:

1.3.2 黑米蛋白含量的基本成分
蛋白含量的测定:GB 5009.5—2016《食品中蛋白质的测定》;水含量的测定:GB 5009.3—2016 《食品中水分的测定》;灰分含量的测定:GB 5009.4—2016《食品中灰分的测定》;脂肪含量的测定:GB 5009.6—2016《食品中脂肪的测定》。
1.3.3 溶解性的测定
将等量样品溶于等量蒸馏水中,1 mol/L HCl溶液或1 mol/L NaOH溶液调节pH为 2.0~7.0 之后磁力搅拌30 min,静置离心,并在280 nm下测上清液蛋白质含量[6]。溶解度公式如式(1):

(1)
1.3.4 乳化性和乳化稳定性的测定
取4 mL大豆油和12 mL蛋白质溶液在10 000 r/min下高速均质1 min。从均质样品底部取20 μL溶液加入5 mL 1 g/L的SDS溶液混匀,在500 nm处测吸光值。30 min后继续取样进行测定,计算乳化稳定性[7]。由以下公式计算乳化性(EAI)和乳化稳定性(ESI),分别为公式(2)和(3):

(2)
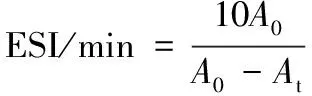
(3)
式中:A0,0 min时测得稀释后的乳化液吸光度;At,tmin时测得稀释后的乳化液吸光度;N=100,稀释因子;C,原始蛋白质质量浓度,g/mL;θ=0.25,形成乳液的油的体积分数;L=1 cm,光程。
1.3.5 粒径测定
配制1 mg/mL蛋白溶液,采用马尔文纳米粒度仪对溶液的平均粒径进行测定。在室温条件下重复测定12次。
1.3.6 持水性和持油性的测定
将0.5 g样品分散在20 mL蒸馏水中,并在不同温度下以300 r/min搅拌1 h。之后,将分散体4 000 r/min离心15 min。称重沉淀物,计算重量的差异。结果表示为每克样品吸收的水的克数[8]。
将0.5 g样品加入到10 mL大豆油中并在旋涡混合器中混合30 s,并在不同温度下以300 r/min搅拌1 h。之后,将分散体4 000 r/min离心15 min。称重沉淀物,计算重量的差异。结果表示为每克样品吸收的水的克数。
1.3.7 起泡性和起泡稳定性的测定
取20 mL质量分数1%的蛋白溶液,以10 000 r/min的速度均质2 min。将均质后的样品迅速转移到一个刻度量筒中。在均质化之后0和30 min读取总体积[9]。由公式(4)和公式(5)计算起泡性和起泡稳定性。

(4)

(5)
式中:V0,原始体积,mL;V1,泡沫体积,mL;V2,液体体积,mL;V3,30 min后泡沫体积,mL。
1.3.8 圆二色光谱的测定
在25 ℃条件下,采用圆二色光谱仪在180~260 nm 扫描。比色池为0.1 cm,光谱带宽为1 nm,分辨率为0.2 nm,响应时间为0.25 s,扫描速率为10 nm/min。
1.3.9 红外光谱的测定
取少量样品与KBr晶体按质量比约1∶100进行研磨,用傅里叶红外光谱仪进行红外光谱测定,测定波段为4 000~400 cm-1,扫描次数为32次。
1.3.10 热稳定性的测定
称取3.0 mg待测样品至铝盒中,加入10 μL蒸馏水,封闭铝盒充平衡5 min。应用DTG差热热重同步分析仪测样品,测试全过程在氮气条件下进行,扫描速率为10 ℃/min,扫描区间为20~150 ℃[10]。
1.3.11 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS-PAGE根据LAEMMLI[11]的方法制备的不连续缓冲液体系,本试验采用12%的分离胶和5%的浓缩胶。电泳结束后凝胶用0.1%考马斯亮蓝R-250染色2 h,用脱色液脱色至背景清晰。
1.3.12 统计分析
所有试验均重复3次,数据为3次重复的平均值,并用Origin 9.1 作图。
2 结果与分析
2.1 黑米蛋白的基本组成成分
由表1可得,黑米蛋白的蛋白质含量为(89.41±0.23)%,大豆分离蛋白质含量为(91.93±0.46)%,参照大豆分离蛋白粉GB/T 22493—2008,各项指标均在规定范围内。

表1 黑米蛋白和大豆分离蛋白基本组成成分 单位:%(质量分数)Table 1 Proximate chemical composition of black rice protein isolate and soy protein isolate
黑米蛋白呈黑紫色,粉状,无结块,无异味。
2.2 溶解性分析
溶解性能准确评价出蛋白质的内部结构发生变性和聚集程度,同时是蛋白质的最重要的物理、化学和功能性质之一[12]。因此本试验比较了大豆分离蛋白和黑米蛋白2种蛋白质的溶解能力,结果如图1所示。

图1 大豆分离蛋白与黑米蛋白溶解性Fig.1 The solubility diagram of soy protein isolate and black rice protein isolate
由图1可以看出,在不同pH下的大豆分离蛋白与黑米蛋白溶解趋势比较一致,先下降后上升。大豆分离蛋白与黑米蛋白的溶解度在pH 4.0时均达到最低,等电点即为蛋白质溶解度最小的pH值,因此黑米蛋白等电点为pH 4.0,这与大多数植物蛋白相似,如黑木耳蛋白[13]、柠条蛋白[14]等。当pH ≥ 4.0时,远离蛋白质等电点时,蛋白分子表面可能会增加一部分电荷,导致在静电斥力作用下与蛋白离子水合作用增强,因此溶解度上升[15]。
2.3 乳化性和乳化稳定性分析
蛋白质是表面活性物质,也是两性物质,可通过改变pH改变表面带电情况,也可通过降低溶液界面表面张力使水和油发生乳化。图2和图3分别表示大豆分离蛋白和黑米蛋白的乳化性和乳化稳定性在不同pH下的趋势。
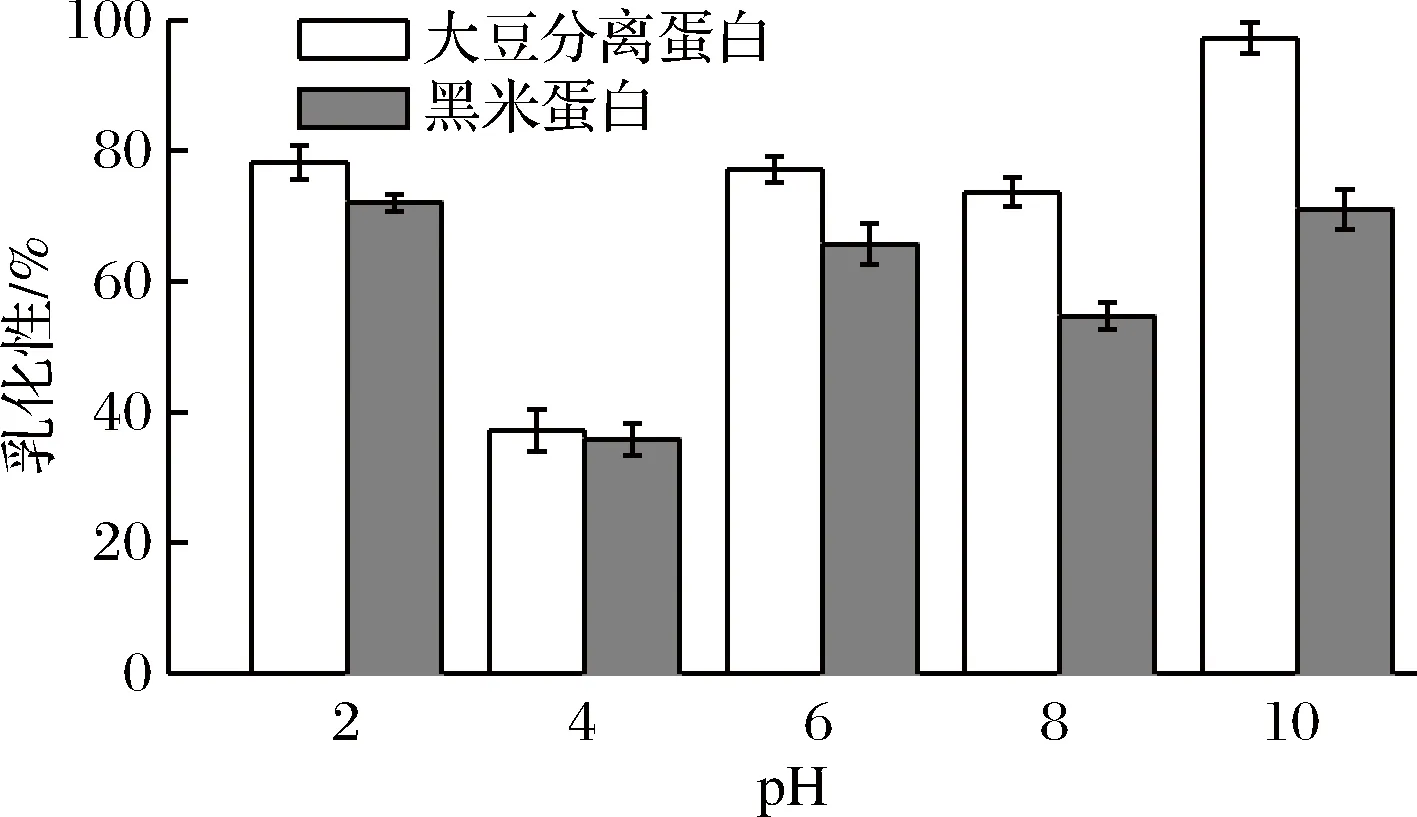
图2 大豆分离蛋白与黑米蛋白乳化性Fig.2 Emulsifying property of soy protein isolate and black rice protein isolate
由图2和图3可以看出,在pH 4接近等电点时,大豆分离蛋白与黑米蛋白均表现出乳化性最弱,分别是37.18 m2/g和35.85 m2/g,但出现乳化稳定性最高,这种现象与熊家艳等[16]对黔江肾豆蛋白质研究结果相似,这可能是pH接近蛋白质的等电点时,蛋白质分子表面正负电荷的含量基本相等,相互抵消为0,分子作用力降到最低,乳化粒子相互碰撞发生絮凝和聚集,出现乳化能力最弱的现象[17]。乳化稳定性变高可能某些类型的多糖可以通过增加系统的黏度来帮助稳定乳液[18]。

图3 大豆分离蛋白与黑米蛋白乳化稳定性Fig.3 Emulsifying stability of soy protein isolate and black rice protein isolate
2.4 持水性和持油性分析
不同温度对分离蛋白持水性的影响如图4所示。

图4 大豆分离蛋白与黑米蛋白的持水性Fig.4 Water holding capacity of soy protein isolate and black rice protein isolate
根据纳米粒度仪测试结果得,黑米蛋白的平均粒径为289.4 nm,大豆分离蛋白的平均粒径为472.2 nm。在20~60 ℃,黑米蛋白和大豆分离蛋白的持水率随温度变化,出现持水性先升高后降低,这与李露敏等[19]对樟树籽仁蛋白持水性研究结果相似,这可能是从低温到高温的过程中,蛋白内部结构遭到一定程度的改变或者破坏导致其伸展性增大,加强了水分子与蛋白分子相互作用,因此出现蛋白质吸水性增大的现象。但随着温度继续升高,蛋白表面吸水性下降,可能是由于高温下加剧水解程度,减弱了蛋白分子的氢键和离子基团的水合作用,形成聚集作用[20]。由图4可以看出,在30 ℃时,大豆分离蛋白与黑米蛋白持水率均达到最大,分别为541.32%和163.63%,由此表明,黑米蛋白的持水性低于大豆分离蛋白,可能是大豆分离蛋白的平均粒径大于黑米蛋白,持水性更强。
图5显示,在20~60 ℃,大豆分离蛋白与黑米蛋白的持油性先升高后降低,在30 ℃时持油性达到最大,分别为105.52%和143.51%,原因可能是在低温下,油脂流动性较低,容易被蛋白质分子截留,持油性增大。在30 ℃以后,随着温度升高,蛋白质内部构象结构发生改变,暴露更多的极性键,结合油脂的能力降低,油脂结合能力也达到饱和,持油性下降。在整个温度范围内,黑米蛋白持油性显著高于大豆分离蛋白,可能与蛋白质含量、蛋白质类型和蛋白质的氨基酸组成有关,特别是与脂肪分子中与烃链相互作用的疏水性残基[21]。

图5 大豆分离蛋白与黑米蛋白的持油性Fig.5 Oil holding capacity of soy protein isolate and black rice protein isolate
2.5 起泡性与起泡稳定性分析
起泡性及起泡稳定性是蛋白质的功能性质之一。蛋白质结构的两亲性是具有良好表面性质(包括乳化和起泡)的蛋白质的先决条件。
大豆分离蛋白与黑米蛋白在不同pH值下的起泡性如图6所示,在pH 2~10,大豆分离蛋白与黑米蛋白的起泡性均有最大值与最小值。
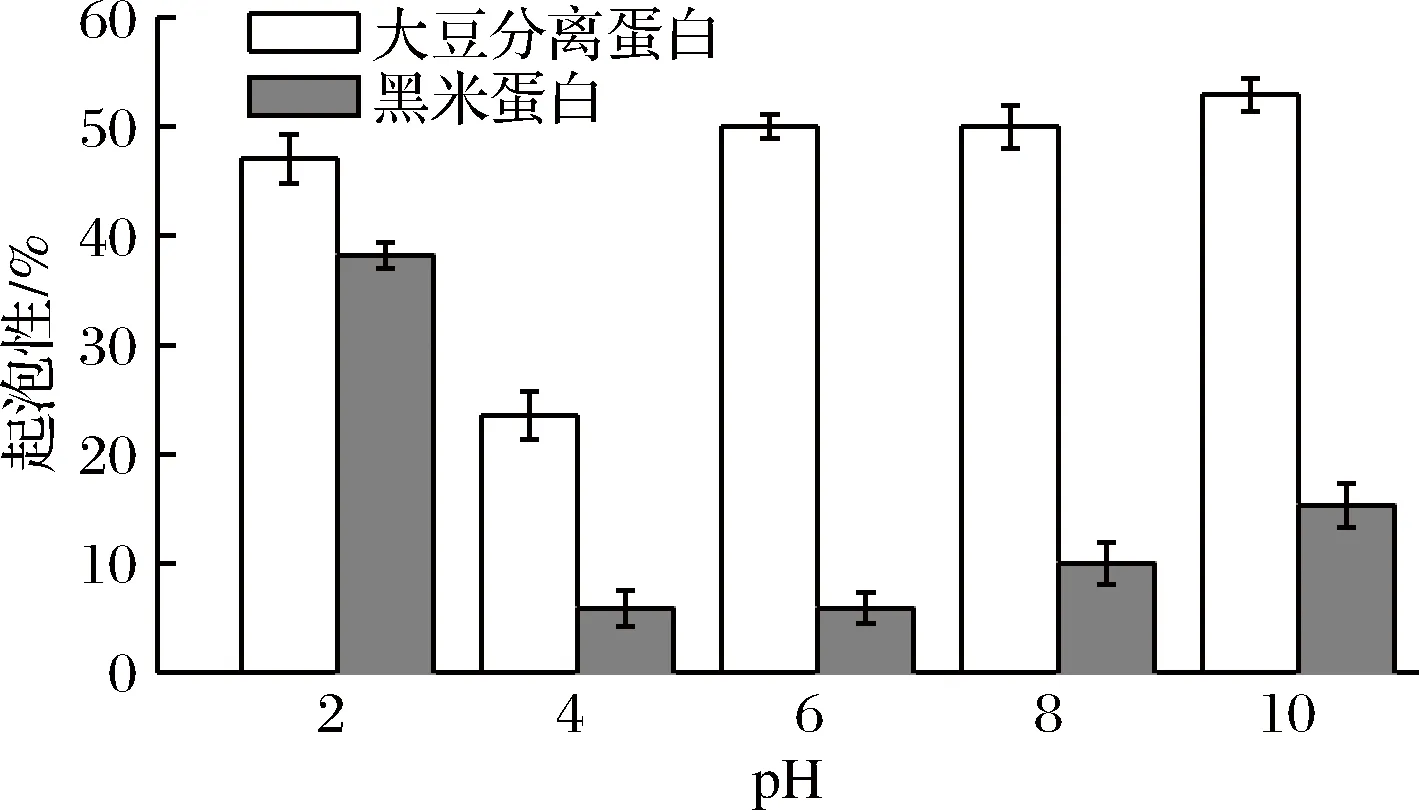
图6 大豆分离蛋白与黑米蛋白起泡性Fig.6 Foaming property of soy protein isolate and black rice protein isolate
在pH 4等电点时,2种蛋白质的起泡性均达到最低,分别为23.53%和5.88%。黑米蛋白质的起泡性在pH 2时达到最高,而大豆分离蛋白在pH 10时达到最大,分别为38.24%和52.94%。蛋白质的起泡性差异可能是由于它们不同的构象特征[22]。
此外,蛋白质起泡后30 min得到其起泡稳定性。由图7可以看出,黑米蛋白起泡稳定性先降低后升高,而大豆分离蛋白是先升高后降低。但在整个pH 4~10,大豆分离蛋白的起泡稳定性均显著高于黑米蛋白,且比较稳定。这可能是由于蛋白质-蛋白质相互作用,在接近等电点的pH 4时也有起泡能力,这与蛋白质最小溶解度有较好的相关性。随着pH升高,黑米蛋白起泡稳定性逐渐增大,可能是蛋白质分子间作用增强,提高黏度性,因而出现良好的起泡稳定性[23]。

图7 大豆分离蛋白与黑米蛋白起泡稳定性Fig.7 Foaming stability of soy protein isolate and black rice protein isolate
2.6 二级结构分析
蛋白质的二级结构是多肽链骨架中局部肽段的构象,圆二色光谱(CD)以广泛应用于研究蛋白质分子构象。由图8可以看出,黑米蛋白在191 nm处有一正峰,在207 nm出有一负峰。通过CD-Pro软件计算结果可知,黑米蛋白中α-螺旋含量为5.15%,β-折叠含量为40.65%,β-转角含量为21.70%,无规则卷曲含量为32.40%。其中β-折叠含量最高,α-螺旋含量最低。

图8 黑米蛋白的CD图谱Fig.8 Far-UV CD spectrum of the black rice protein isolate
2.7 特征性官能团分析
黑米蛋白的红外光谱图谱如图9所示,蛋白质在4 000~400 cm-1有多处吸收峰。其中,波数在3 291.95 cm-1处出现的宽峰是H—O键伸缩振动引起的典型吸收峰,1 645.01 cm-1处的吸收峰是蛋白质伯酰胺中R—CO—NH2中—C=O—伸缩振动产生的,1 517.73 cm-1处吸收峰是蛋白质伯胺基团中的—NH面内弯曲振动产生的,1 390.44 cm-1处较弱的吸收峰蛋白质中游离的COO—对称伸缩振动产生的[24]。

图9 黑米蛋白红外光谱Fig.9 Infrared spectrum of the black rice protein isolate
2.8 热稳定性分析
差示扫描量热法(DSC)是一种热分析法,它能够提供蛋白热变性有关的信号,如蛋白质空间构发生相变。本试验研究黑米蛋白对热的稳定性,得出其变性温度。
黑米蛋白DCS曲线如图10所示,在80~100 ℃由于黑米蛋白产生热变性,出现了明显的吸热峰,吸热峰产生温度的变性温度为87.35 ℃,变性温度与大豆分离蛋白[25]接近。出现变性的原因是黑米蛋白加热,其高级结构发生改变,吸收能量。

图10 黑米蛋白的热稳定性Fig.10 Heating stability of black rice protein isolate
2.9 SDS-PAGE分析
图11为黑米蛋白的染色图,由图11可以看出,黑米蛋白的组成较复杂,主要含有5个条带,分别是11、19、33、51和115 kDa。表明黑米蛋白的组成中,小分子含量较多。另外,由图11也可以看出有部分蛋白质分子质量在200 kDa以上,这与姜珊珊[5]对黑米蛋白分子质量研究结果基本一致,但在分子质量115 kDa时有较大差别,可能是黑米原产地的不同。

图11 黑米蛋白的SDS-PAGEFig.11 SDS-PAGE of black rice protein isolate
3 结论


