硒化牡蛎多糖制备及其抗氧化和抗肿瘤活性研究
丁佳玉,曲 敏,佟长青,李 伟
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
牡蛎别名蛎黄,是一种双壳类软体动物。牡蛎主要生长在温带和热带等沿海水域[1]。在我国牡蛎的分布也很广泛,其养殖范围由北至南,且生长在咸淡水交界处的牡蛎尤为肥美。牡蛎具有良好的营养价值,牡蛎中含有丰富的微量元素、糖原,具有保肝护肝[2]、降血糖、降尿糖[3]等生理活性。
硒是人体生命活动中必需的微量元素之一,经研究表明适当补硒能够延缓衰老、抗氧化、抑制或协同抗肿瘤等[4-5]。根据研究显示,有机硒与无机硒相比能降低其毒性,提供更好的抗氧化、抗肿瘤能力[6-7]。
目前,对于硒化多糖的抗肿瘤活性研究并不多。商龙臣等人[8]用南瓜硒多糖作用于乳腺癌细胞MDA-MB-231,给药48 h后效果最好,抑制率可达到50.3%,较好地抑制了癌细胞的生长。Weili Zhu等人[9]研究何首乌酸性多糖,结果表明何首乌酸性多糖具有很好的抗肿瘤、抗氧化能力,是一种潜在的抗氧化剂、抗肿瘤药物。Fei Liu等人[10]研究硒化后的蛹虫草多糖抑制肝癌细胞,分离后的硒化蛹虫草多糖对肝癌细胞具有一定的抑制作用。Hui-Li Chu等人[11]发现马尾松(Pinus massoniana)花粉硫酸化多糖(SPPM60) 在HepG2细胞G2/M期对其具有抑制作用,并且抑制率与药物浓度呈依赖性。Guowei Ya[12]发现纯化的香菇多糖通过线粒体通路可有效诱导HeLa细胞凋亡。
硒与牡蛎多糖经过化学反应,使所得多糖中含有Se=C键或Se-O,从而形成有机硒化合物——牡蛎硒多糖,实现牡蛎多糖硒化。研究硒化牡蛎多糖清除DPPH·,ABTS+,·OH清除率及铁还原力等体外抗氧化活性,以及对人宫颈癌和肝癌细胞的抑制作用,通过流式细胞术检测并探讨抑制肿瘤细胞的机制,为牡蛎深加工及产业化提供一定的参考。
1 材料与方法
1.1 材料与试剂
牡蛎多糖干粉(实验室自制);氯仿、正丁醇、亚硒酸钠、乙醇、高氯酸、浓盐酸、浓硝酸、硒标准、邻苯二胺、柠檬酸、氢氧化钠、磷酸氢二钠、DPPH·、抗坏血酸、ABTS+、K2S2O8、无水乙醇、FeSO4、水杨酸、30%H2O2溶液等,均为分析纯;甲醇色谱纯;DMSO(细胞级)、1640培养基、MEM培养基、胰蛋白酶、四甲基偶氮唑盐(MTT)、青链霉素混合液、PI染液和RNase A,北京索莱宝科技有限公司提供;胎牛血清,杭州四季青生物工程有限公司提供;人宫颈癌细胞株(Hela)、人肝癌细胞株(HepG2),中科院上海细胞所提供。
1.2 仪器与设备
立式冷冻离心机,盐城市安信实验仪器有限公司产品;PB-10型Sartorius精密pH计,上海精密科学仪器有限公司产品;真空冷冻干燥机,北京博医康实验仪器有限公司产品;高效液相色谱仪,大连依利特分析仪器有限公司产品;UV-2550型紫外分光光度计,日本岛津公司产品;370DTGS型红外光谱仪,Thermo公司产品;721型可见光分光光度计,上海光谱仪器有限公司产品;HH-4型数显恒温水浴锅,国华电器有限公司产品;MCO-18AIC型CO2培养箱,日本三洋设备有限公司产品;CKX41型倒置显微镜,日本奥林巴斯有限公司产品;Fax2100型酶联免疫检测仪,美国Awareness公司产品;流式细胞仪,Beckman公司产品。
1.3 试验方法
1.3.1 硒化牡蛎多糖的制备
精确量取1.0 g采用Sevage法除蛋白后的牡蛎多糖放入三颈瓶中,加入0.5%硝酸溶液和一定质量的亚硒酸钠并在70℃水浴锅中搅拌反应8 h;待反应后溶液降到室温,调pH值至中性;取4倍体积95%的乙醇进行醇沉,过夜后离心(9 000 r/min,10 min),取沉淀透析3 d;冷冻干燥得硒化牡蛎多糖。
1.3.2 硒化牡蛎多糖的分离纯化
将处理好的DEAE-52装柱,柱床规格为2.5 cm×40 cm。硒多糖上样量为10 mg/mL,流速为3 min 2 mL,采用浓度为0~0.5 mol/L NaCl洗脱。苯酚硫酸法检测多糖含量并收集各主峰,透析3 d,冷冻干燥得纯化的硒化牡蛎多糖。
1.3.3 硒含量测定
参考葛明明等人蒲公英硒化多糖工艺,采用HPLC法,以色谱峰面积为纵坐标Y、硒标准溶液质量浓度为横坐标X,绘制硒溶液的标准曲线并测定硒化牡蛎多糖中的硒含量。
了解大学生的阅读需求,阅读推广工作才能有的放矢。随着技术的发展,通过大数据分析,为挖掘大学生的潜在需求提供了技术支持。新媒体时代下大学生的阅读具有碎片化、娱乐化、功利性的特点,这就需要高校图书馆在推广阅读服务时提供高效、快捷的服务,在阅读推广中应注重新媒体的趣味性与专业性相结合,深度挖掘大学生的信息,提供智能化、个性化的服务,提高大学生读者对图书馆的粘合性[6]。
1.3.4 体外抗氧化活性试验
(1) DPPH·清除能力测定。取2 mL不同质量浓度牡蛎硒多糖溶液与0.1 mmol/L DPPH·溶液2 mL混合,避光30 min,于波长517 nm处测定吸光度,记为A1。以无水乙醇代替DPPH·,记为A0。蒸馏水代替样品记为A2。

(2) ABTS+清除率测定。取 0.4 mL不同浓度牡蛎硒多糖溶液与1.6 mL ABTS+工作液混合,避光静置6 min于波长517 nm处用分光光度计测定样液吸光度,记为A1。PBS(pH值7.4,磷酸缓冲溶液)代替样品,记为A0;PBS代替ABTS+记为A2.
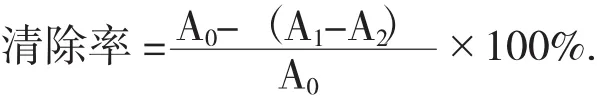
(3)·OH清除率测定。取2 mL不同浓度牡蛎硒多糖溶液与9 mmol/L FeSO4溶液1 mL,9 mmol/L水杨酸-乙醇1 mL,8.8 mmol/L过氧化氢1 mL,于37℃下反应30 min,于波长510 nm处测定吸光度Ax;蒸馏水代替样液吸光度A0;蒸馏水代替过氧化氢记为Ax0。
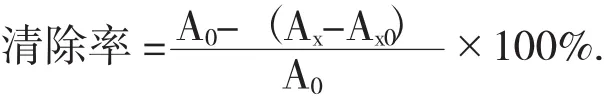
(4)铁还原能力测定。取1 mL牡蛎硒多糖溶液与0.2 mol/L pH值6.6磷酸盐缓冲液2.5 mL,1%铁氰化钾1 mL,于50℃下反应20 min,加入10%三氯乙酸5 mL静置10 min,取上清液2.5 mL,加入2.5 mL蒸馏水,0.1%三氯化铁0.5 mL,静置10 min。
于波长700 nm处测定吸光度A1。用去离子水代替0.1%三氯化铁记为A2。
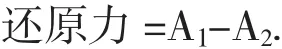
1.3.5 体外肿瘤生长抑制
采用MTT法对HepG2及Hela细胞存活生长率进行测定。取对数期的肿瘤细胞经0.25%胰蛋白酶消化后,用培养液调整细胞浓度至2×104个/mL接种于96孔培养板中,每孔90 μL,培养24 h使细胞贴壁。加入终质量浓度分别为25,50,100,200 μg/mL的硒化牡蛎多糖,每组设4个复孔,另外设阴性对照组和空白对照组,于37℃,5%条件下的CO2培养箱中培养48 h,每孔加入0.5%的MTT溶液10 μL,继续培养4 h。弃去培养液,每孔加入100 μL DMSO(细胞级),振荡10 min,使结晶物充分溶解。用酶联免疫检测仪于波长570 nm处测定各孔的吸光度计算细胞增殖抑制率:
1.3.6 流式细胞术检测肿瘤细胞周期
取对数生长期细胞1×105浓度接种于6孔板,每组设2个复孔,待细胞贴壁,加入终质量浓度为200 μg/mL的硒化牡蛎多糖继续培养48 h。用EP管收集培养液,胰酶消化剩余贴壁细胞,将培养液加入原孔中终止消化以转速1 000 r/min离心5 min收集细胞。用PBS清洗3次,每次清洗后均用离心,弃上清液。将细胞固定于预冷的70%乙醇中过夜。次日离心除去固定剂,PBS清洗2次后,重新将细胞悬于含有PI及无DNA酶污染的RNase的染液中,于37℃,5%条件下CO2的培养箱中避光孵育30 min,用流式细胞仪进行检测。
2 结果与分析
2.1 硒化牡蛎多糖DE-52分离纯化
硒化牡蛎多糖DEAE-52的洗脱曲线见图1。
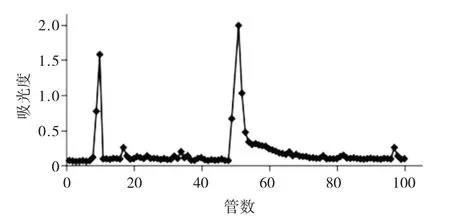
图1 硒化牡蛎多糖DEAE-52的洗脱曲线
由图1可知,硒化牡蛎多糖经DEAE-52层析分离获得2个组分SeOPS-I和SeOPS-II。
2.2 硒化牡蛎多糖硒含量的测定及红外光谱分析
采用HPLC法测得硒含量为42.36 mg/g,硒化牡蛎多糖平均收率为26.03%。
牡蛎多糖红外光谱见图2,硒化牡蛎多糖红外光谱图见图3。

图2 牡蛎多糖红外光谱
由图2和图3可知,硒化后的牡蛎多糖红外光谱在762 cm-1处和1 030 cm-1处出现峰,在762 cm-1处和1 030 cm-1处附近有亚硒酸酯特征吸收峰,表明硒化牡蛎多糖分子中存在亚硒酸基团,可推断硒化反应后的牡蛎多糖中含有Se=O键,即硒化反应后生成牡蛎硒多糖。
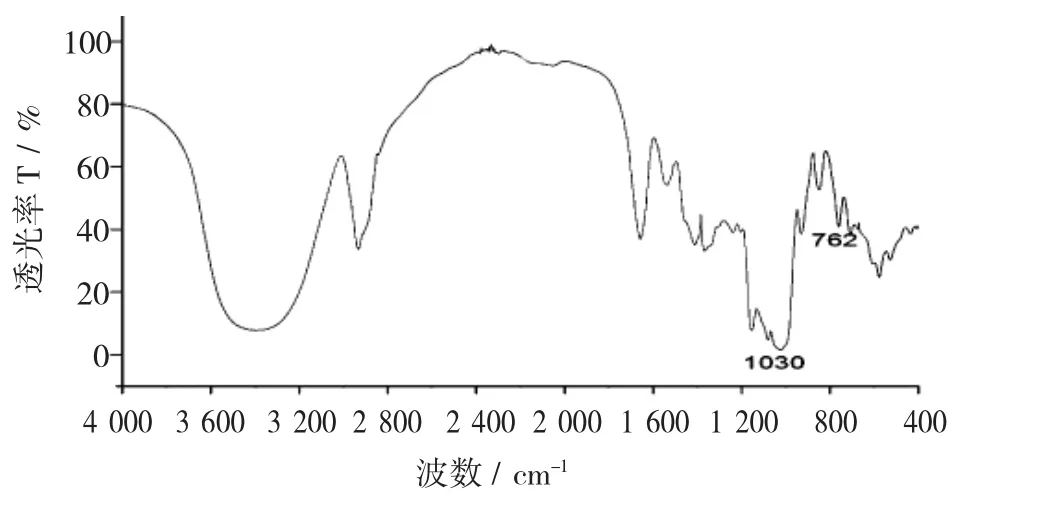
图3 硒化牡蛎多糖红外光谱图
2.3 硒化牡蛎多糖的体外抗氧化活性
硒化牡蛎多糖对DPPH·清除作用见图4,硒化牡蛎多糖对ABTS+清除作用见图5。
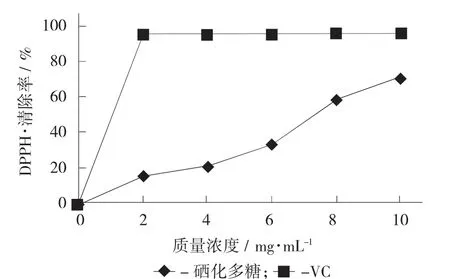
图4 硒化牡蛎多糖对DPPH·清除作用
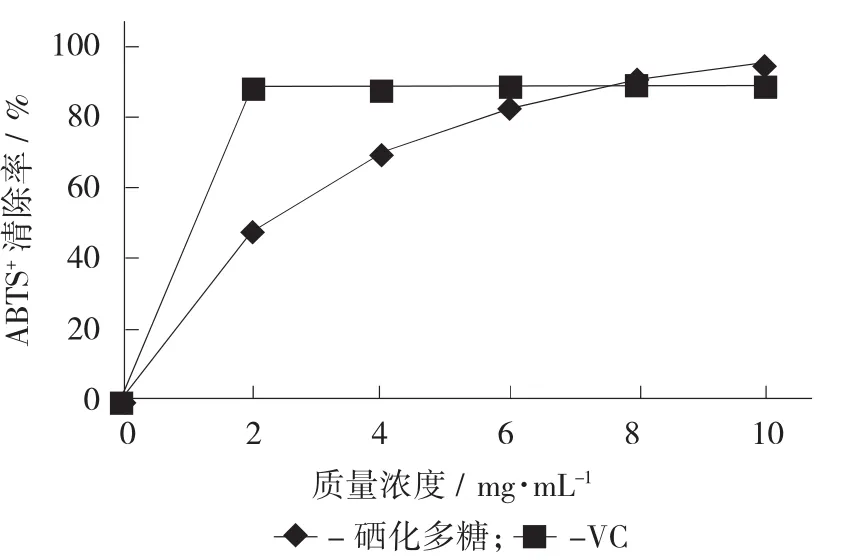
图5 硒化牡蛎多糖对ABTS+清除作用
由图4和图5可知,硒化牡蛎多糖对DPPH·和ABTS+都有很好的清除作用。清除效果与多糖浓度在一定范围内呈正相关。以VC作为参照,硒化牡蛎多糖对DPPH·的清除率IC50值为7.102 mg/mL。当质量浓度为10 mg/mL时清除能力达到70.9%。而对ABTS+的IC50值可达到2.243 mg/mL。当质量浓度为8 mg/mL时,硒化牡蛎多糖清除率为90.4%。这说明硒化后牡蛎多糖对ABTS+有很好的清除作用。
硒化多糖对·OH的清除作用见图6。
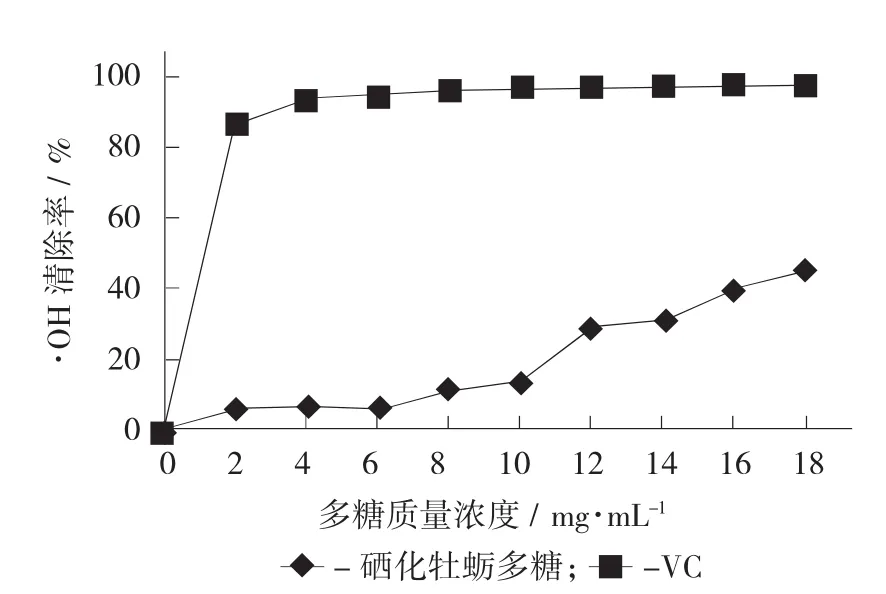
图6 硒化多糖对·OH的清除作用
硒化牡蛎多糖对·OH的清除率也随质量浓度的增长呈上升趋势,但当质量浓度增加到20 mg/mL时,其清除率仅为44.9%。参考郝苗等人对硒化枸杞多糖的报道,当质量浓度为2.0 mg/mL时,硒化枸杞多糖对·OH的清除率就达到56.16%。结果对比说明硒化牡蛎多糖对·OH清除效果并不理想。
硒化多糖对铁还原力见图7。
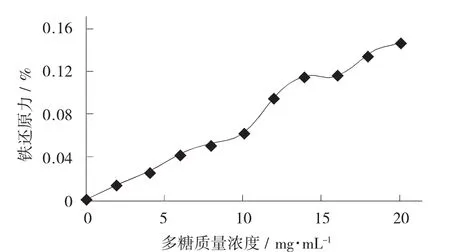
图7 硒化多糖对铁还原力
硒化后的牡蛎多糖具有一定的铁还原力,还原力也是潜在抗氧化的重要表现。根据研究比较质量浓度为2 mg/mL的硒化牡蛎多糖其还原力与牡蛎多糖相近,二者还原力无明显差别。
2.4 硒化牡蛎多糖对肿瘤细胞的生长抑制
牡蛎多糖和硒化牡蛎多糖对Hela生长抑制作用(n=4) 见表 1。
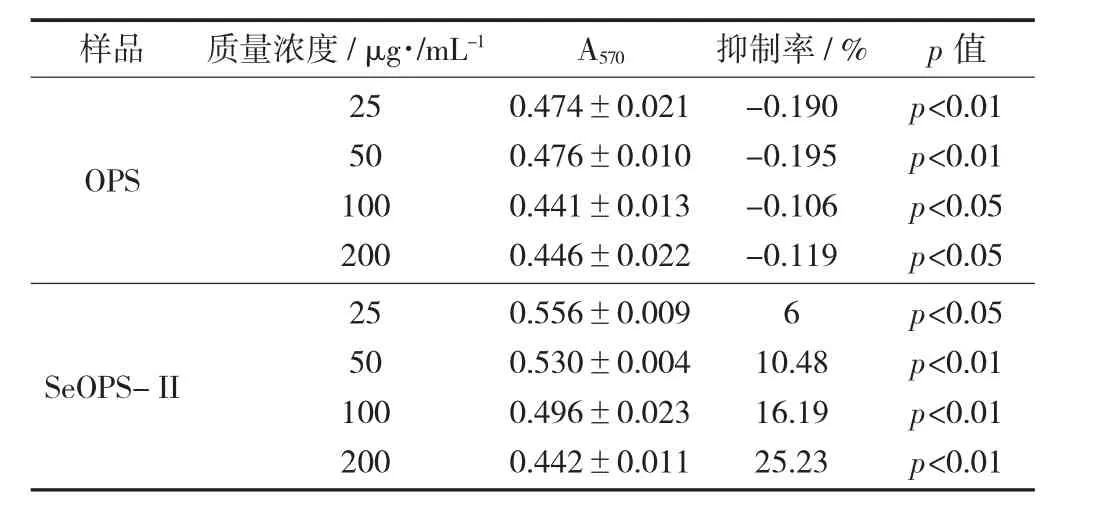
表1 牡蛎多糖和硒化牡蛎多糖对Hela生长抑制作用(n=4)
由表1可知,质量浓度25~200 μg/mL牡蛎多糖(OPS)对宫颈癌细胞并没有抑制作用。而硒化后的牡蛎多糖(SeOPS-II)作用于宫颈癌细胞具有一定的抑制作用,且抑制作用与SeOPS-II质量浓度呈正相关。SeOPS-II质量浓度达到200 μg/mL时,对肝癌细胞抑制率为25.23%,抑制作用显著提高。
牡蛎多糖和硒化牡蛎多糖对HepG2生长抑制作用 (n=4) 见表2。
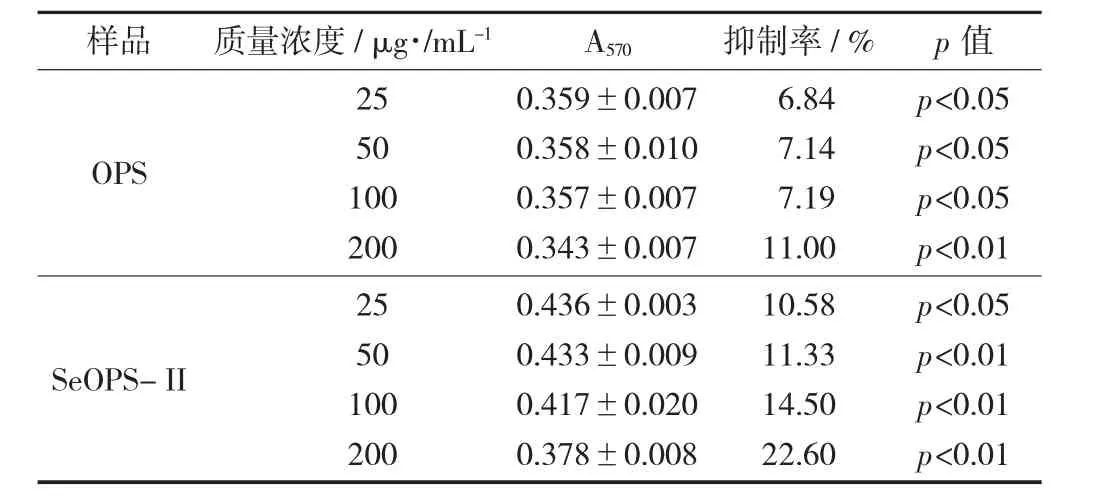
表2 牡蛎多糖和硒化牡蛎多糖对HepG2生长抑制作用(n=4)
由表2可知,OPS对HepG2细胞增殖具有抑制效果,但效果并不显著。而修饰后的SeOPS-II对HepG2细胞在一定质量浓度范围内生长抑制作用较为显著,并且抑制作用与质量浓度成正比,当质量浓度达到200 μg/mL时,抑制作用可达到22.6%,具有显著差异性p<0.01。
2.5 流式细胞术检测细胞周期结果
Hela细胞周期分布图见图8,硒多糖作用Hela细胞周期分布图见图9,Hela细胞周期分布见图10。
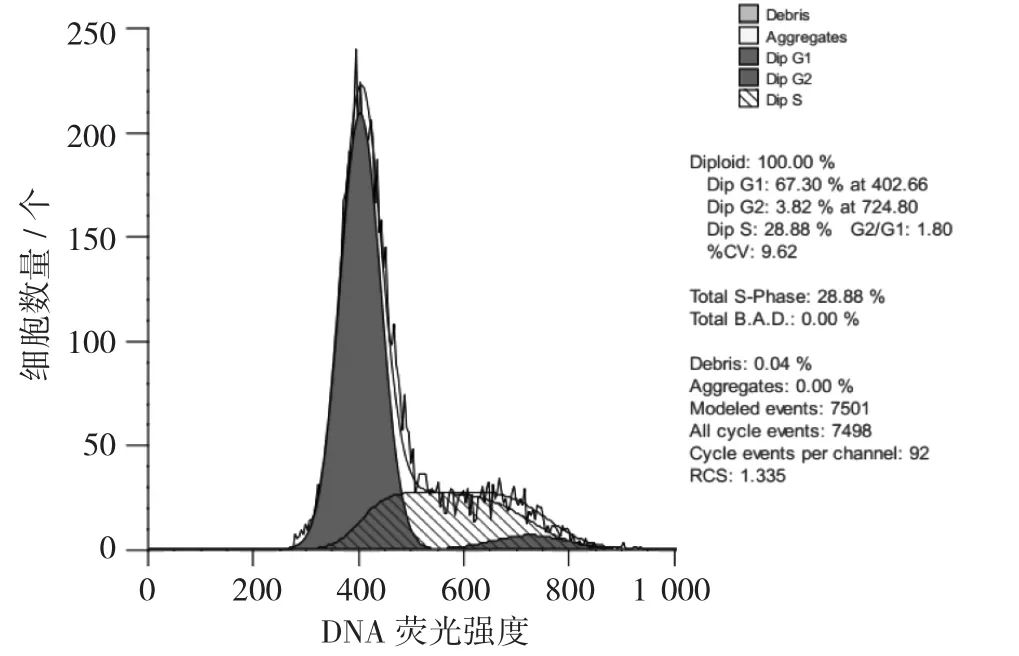
图8 Hela细胞周期分布图

图9 硒多糖作用Hela细胞周期分布图
通过PI单染色法对Hela细胞加药前后细胞周期进行比较。由图10可知,细胞在G1期、S期和G2/M期均有分布,每个时期的细胞数量分别为67.3%±0.01%,28.88%±0.02%和3.82%±0.01%。
加入硒化牡蛎多糖作用48 h后(见图9),Hela细胞主要集中在G1期。与对照组相比,G1期的细胞数量相对増多,已经达到72.12%±0.01%;S期和G2/M期的细胞分布减少,S期的细胞量减少到25.28%±0.01%,G2/M期的细胞减少到2.59%±0.01%。经比较分析,加入硒多糖后Hela细胞主要停滞在G1期,促使损害后的碱基无法复制,从而使进入S期及G2/M期的细胞数减少,阻碍了细胞周期发展,从而达到抑制细胞增殖的目的。
HepG2细胞周期分布图见图11,硒多糖作用HepG2细胞周期分布图见图12,HepG2细胞周期分布图见图13。
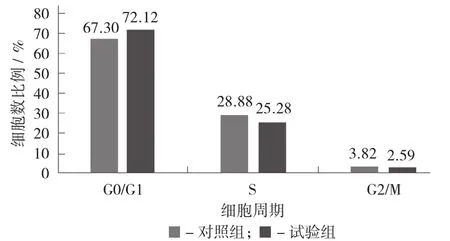
图10 Hela细胞周期分布
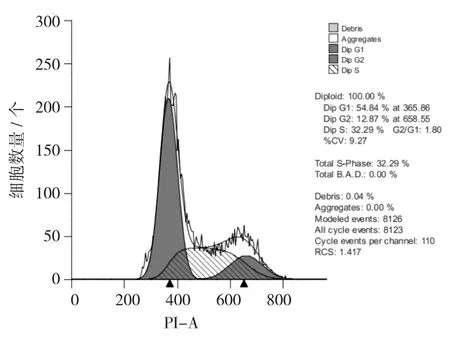
图11 HepG2细胞周期分布图

图12 硒多糖作用HepG2细胞周期分布图

图13 HepG2细胞周期分布图
通过PI单染色法对HepG2细胞加药前后细胞周期进行比较。由图13可知,相对于空白组,硒化牡蛎多糖组G0/G1期细胞少量增加,S期细胞由原来32.29%±0.02%增加到35.11%±0.02%,M期细胞由原来的12.87%±0.02%变为9.64%±0.02%,细胞数明显减少。说明硒化牡蛎多糖主要作用于HepG2细胞S期来抑制细胞增殖,同时对G0/G1期也具有一定作用。
3 结论
通过化学方法将有机硒与牡蛎多糖结合,并通过HPLC法及红外对硒含量及硒多糖结构进行分析验证牡蛎多糖硒化。在抗氧化方面,硒化牡蛎多糖对部分指标具有很好的抗氧化活性。经研究表明,部分硒多糖具有强大的抗氧化特性,含硒多糖可考虑作为膳食补充剂中的新型硒源。在抗肿瘤方面,硒化牡蛎多糖在一定范围内对Hela细胞和HepG2细胞增殖具有抑制作用且呈现质量浓度依赖性。细胞周期结果显示硒化牡蛎多糖可通过阻碍细胞G0/G1期及S期的发育从而抑制肿瘤细胞增殖。合理范围内摄入硒多糖可以提高人体免疫力。

