基于细胞膜损伤的蔗糖月桂酸酯对金黄色葡萄球菌的作用机制
宁亚维,杨 坤,何建卓,张 岩,李 强,王志新,贾英民*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北省食品检验研究院,河北 石家庄 050000;3.北京工商大学食品学院,北京 100048)
金黄色葡萄球菌是造成人类食物中毒的常见致病菌之一。因其广泛存在于自然环境及人和动物体表,极易造成食品污染。金黄色葡萄球菌污染食品并大量繁殖后能够产生致病性肠毒素,从而引起消费者发生食物中毒[1]。据美国疾控中心报道,每年世界上因金黄色葡萄球菌引起的食物中毒约有24万 人次[2]。因此,攻克食源性致病菌——金黄色葡萄球菌污染已成为食品安全领域的重要任务。
糖酯是一种非离子型表面活性剂,具有无毒、易生物降解等特性,在食品和医药领域均有广泛的应用[3-7]。据报道,2015年糖酯在全球市场消费量达到5.57亿 美元,预计到2020年将达到7.46亿 美元[8]。近年来,糖酯除了作为乳化剂被报道外,多项研究表明其对食源性致病菌与腐败菌具有抑制作用,如乳糖油酸酯可以抑制多种细菌(包括出血性大肠杆菌、单细胞增生李斯特菌等)[9]。糖酯尤其对于革兰氏阳性菌具有广泛抑制作用[3]:如乳糖月桂酸酯对单细胞增生李斯特菌具有抑制作用[10];麦芽糖月桂酸酯可以有效抑制变异链球菌[11];果糖月桂酸酯对变异链球菌、凝结芽孢杆菌等具有抑菌活性[12];蔗糖酯对金黄色葡萄球菌等具有抑制作用[13]。糖酯兼具乳化和抑菌双重功能,符合现代人对添加剂多功能性营养化的需求,具有较高的工业化应用潜力。然而,目前关于糖酯抑菌作用机制的研究较少,且最近报道的蔗糖酯机理主要从胞内大分子物质泄漏与DNA结合两个方面考察[13-14]。由于糖酯具有亲水、亲油的双亲特性,推测细胞膜的损伤可能是糖酯抑菌的一个主要作用靶位[15]。细胞膜是细胞结构的重要组成部分之一,具有维持细胞完整性与外界屏障功能、物质运输、受体和信息传递等作用,一旦细胞膜受到破坏,菌体细胞的正常代谢、生理功能就会受到影响。因此,在抑菌机理研究中细胞膜通常作为最主要的抑菌作用靶位来研究。鉴于上述因素,本研究以食源性致病菌金黄色葡萄球菌为指示菌,从细胞膜损伤(包括膜渗透性与完整性、跨膜电势、菌体超微结构等方面)角度考察了蔗糖月桂酸酯对金黄色葡萄球菌的作用机制,以期为多功能糖酯抑菌产品的开发提供科学依据。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌ATCC 25923由河北科技大学食品生物技术与安全实验室保藏;蔗糖月桂酸酯 卡博森斯化学科技(苏州)有限公司;DiSC3(5)、PBFI、PI美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
F-7000-FL 220荧光分光光度计、H-7650透射电子显微镜(transmission electron microscope,TEM) 日本日立公司;Evolution 220紫外分光光度计 美国Thermo Scientific公司;Accuri C6 plus流式细胞仪 美国Becton Dickinson公司;BX53荧光显微镜 日本奥林巴斯株式会社。
1.3 方法
1.3.1 MIC测定
将培养至对数生长期的菌种制备为1×106CFU/mL菌悬液。最小抑菌浓度(minimum inhibitory concentration,MIC)的测定根据Wiegand等[16]的方法略作修改,具体如下:在96 孔无菌微孔板上的2~11 列分别加入100 μL培养基,第12列加入200 μL培养基作为阴性对照;第1列加入200 μL蔗糖月桂酸酯,然后从第1列的孔中吸取100 μL加入到第2列的孔中并用移液枪吸打混匀;重复上述操作直至第10列,从第10列的孔中吸出100 μL液体弃掉;第11列不加入蔗糖月桂酸酯,直接加入浓度为1×106CFU/mL的菌悬液作为阳性对照;将菌液分别加入到第1~11列的孔中,使菌液终浓度约为5×105CFU/mL,置于37 ℃恒温培养箱中培养18 h后观察结果。
1.3.2 时间-杀菌曲线的绘制
向培养至对数生长期的金黄色葡萄球菌液中加入蔗糖月桂酸酯,以未添加蔗糖月桂酸酯为空白对照,使菌悬液终浓度为5×105CFU/mL,于37 ℃恒温培养箱中培养后取样,并采用平板计数法测定培养不同时间后菌液中的活菌数。以时间为横坐标,活菌数的对数为纵坐标绘制时间-杀菌曲线。
1.3.3 细胞膜电势的影响
将培养至对数生长期的金黄色葡萄球菌于4 000×g离心10 min,收集菌体,用含有10 mmol/L葡萄糖的Hepes缓冲液(5 mmol/L、pH 7.2)清洗两次,重悬制备OD600nm=0.05的菌悬液。向菌液中加入DiSC3(5)溶液(终浓度为1 μmol/L),于30 ℃黑暗条件下保温20 min,然后加入KCl溶液(终浓度为100 mmol/L),最后加入不同质量浓度的蔗糖月桂酸酯(1/2 MIC、MIC、2 MIC、4 MIC、8 MIC),对照组为Hepes缓冲液(5 mmol/L、pH 7.4),在激发波长λex=650 nm、发射波长λem=672 nm的条件下测定荧光强度变化。
1.3.4 细胞膜通透性分析
收集对数生长期的金黄色葡萄球菌并采用磷酸盐缓冲液(0.01 mol/L、pH 7.4)制备OD600nm=0.2的菌悬液。向菌悬液中加入不同质量浓度蔗糖月桂酸酯溶液(终质量浓度为0 mg/mL、1/2 MIC、MIC)后立即置于37 ℃下保温,之后加入PI荧光探针溶液(终质量浓度为10 µg/mL),并在4 ℃黑暗条件下染色20 min。染色结束后用磷酸盐缓冲液洗涤菌体两遍,再通过流式细胞仪测定PI沾染率。
向上述用磷酸盐缓冲液制备的菌悬液中加入不同质量浓度蔗糖月桂酸酯溶液(终质量浓度为0 mg/mL(对照组)、1/2 MIC、MIC),于37 ℃下处理1 h。将菌悬液离心,用相同的磷酸盐缓冲液清洗并重悬。将SYTO-9和PI探针染料以体积比1∶1混匀,加到各实验组和对照组中,使终浓度分别为3 μmol/L和20 μmol/L,避光在室温条件下孵育15 min后用磷酸盐缓冲液清洗、重悬,用荧光显微镜观察。
1.3.5 细胞膜完整性分析
将培养至对数生长期的金黄色葡萄球菌用磷酸盐缓冲液(0.01 mol/L、pH 7.4)制备为108CFU/mL的菌悬液。将蔗糖月桂酸酯与菌液等体积混合,使蔗糖月桂酸酯终质量浓度分别为0 mg/mL(对照组,CK)、1/2 MIC、MIC、2 MIC,并置于37 ℃下150 r/min振荡培养。分别在0、15、30、60、90、120 mim后取出2 mL菌悬液,经0.22 μm微孔膜过滤,滤液于紫外分光光度计下测定260 nm波长处的吸光度。
1.3.6 钾离子泄漏实验
采用钾离子敏感性探针PBFI考察钾离子的泄漏。首先制备对数生长期的细胞,清洗并重悬于Hepes缓冲液(含5 mmol/L葡萄糖溶液)中,菌悬液调整为OD600nm=0.3。将PBFI探针加入到菌悬液(终浓度为2 μmol/L)中。向菌悬液中加入不同质量浓度的蔗糖月桂酸酯(0 mg/mL(对照组,CK)、1/2 MIC、MIC、2 MIC、4 MIC)作用10 min。采用荧光分光光度计在激发波长346 nm、吸收波长505 nm处测定荧光强度。
1.3.7 菌体超微结构观察
将培养至对数生长期的金黄色葡萄球菌采用磷酸盐缓冲液(0.01 mol/L、pH 7.4)制备为108CFU/mL的菌悬液,加入蔗糖月桂酸酯(0 mg/mL(对照组,CK)、MIC、2 MIC)作用1 h后,采用相同的磷酸盐缓冲液清洗3 遍,体积分数4%戊二醛固定2 h,然后按TEM生物样品制备法[17]制样,将清洗好的菌体用体积分数1%锇酸和3%戊二醛进行双重固定,经磷酸盐缓冲液清洗后依次用体积分数30%、50%、70%、85%、90%和95%乙醇溶液脱水,无水乙醇洗脱两次、环氧丙烷洗脱两次。用环氧树脂和环氧丙烷包埋并在50 ℃聚合48 h,冷却后于室温进行超薄切片,染色后使用TEM观察菌体的微观结构。
1.4 数据统计与分析
所有实验均重复3 次取其平均值。采用Origin 2016软件通过单因素方差分析法对实验结果进行统计分析并作图,P<0.05为差异显著。
2 结果与分析
2.1 蔗糖月桂酸酯对金黄色葡萄球菌的抑菌活性

图 1 蔗糖月桂酸酯对金黄色葡萄球菌的时间-杀菌曲线Fig. 1 Time-killing curve of S. aureus by sucrose laurate
蔗糖月桂酸酯对金黄色葡萄球菌的MIC为0.312 5 mg/mL,显著低于Zhao Lei等[13]报道的蔗糖癸酸酯对金黄色葡萄球菌的MIC(1.24 mg/mL)。图1显示,与对照组相比,蔗糖月桂酸酯作用于金黄色葡萄球菌8 h内活菌数迅速降低后趋于稳定,作用24 h后活菌数下降了2.09(lg(CFU/mL)),比对照组的活菌数降低了5.14(lg(CFU/mL))。结果表明蔗糖月桂酸酯对金黄色葡萄球菌具有较好的抑菌效果,与Staroń等[3]对乳糖脂肪酸酯的抑菌特性的总结一致,即糖酯对革兰氏阳性菌具有较好的抑菌作用。
2.2 蔗糖月桂酸酯对金黄色葡萄球菌膜电势的影响
DiSC3(5)是一种细胞膜电势敏感性荧光探针,当细胞处于正常的膜极化状态时能在细胞内富集并发生荧光自猝灭,然而当抑菌物质导致细胞膜去极化时,DiSC3(5)会从细胞膜内释放出来,导致荧光信号增加。因此,本研究采用DiSC3(5)探针考察蔗糖月桂酸酯对金黄色葡萄球菌细胞膜电势的影响。由图2可以看出,经蔗糖月桂酸酯作用的金黄色葡萄球菌与对照组相比,DiSC3(5)探针的荧光强度呈现剂量依赖性增大,且荧光强度增加较快,仅在4 min内即达到峰值,表明蔗糖月桂酸酯会导致金黄色葡萄球菌细胞膜电势去极化,且对膜电势的影响较大。上述结果与其他抑菌物质如乳酸菌素LLC518对单细胞增生李斯特菌作用机理,以及细菌素bifidocin A对大肠杆菌的作用机制类似,即均可导致细胞膜电势消散[21-22]。

图 2 蔗糖月桂酸酯对金黄色葡萄球菌细胞膜电势的影响Fig. 2 Effect of sucrose laurate on membrane potential of S. aureus
2.3 蔗糖月桂酸酯对金黄色葡萄球菌细胞膜渗透性的影响
采用SYTO-9和PI双染法可直观观察到抑菌物质对菌体细胞膜的损伤,对于细胞膜完整的菌体,仅有SYTO-9能够进入细胞内将DNA染色呈现绿色荧光;若细胞膜完整性受到破坏,PI进入细胞将核酸染色发出红色荧光,此时SYTO-9和PI的荧光信号叠加呈黄色乃至橙红色[18]。图3显示,未经蔗糖月桂酸酯处理的金黄色葡萄球菌细胞为绿色荧光;经1/2 MIC蔗糖月桂酸酯处理的菌体大多数呈现黄色荧光;经MIC蔗糖月桂酸酯处理的菌体发出橙色荧光,表明随着蔗糖月桂酸酯质量浓度的增加,细胞膜的损伤程度增大。

图 3 蔗糖月桂酸酯对金黄色葡萄球菌细胞膜渗透性影响的荧光显微镜图Fig. 3 Effect of sucrose laurate on membrane permeability of S. aureus evaluated by fl uorescence microscopy

图 4 蔗糖月桂酸酯对金黄色葡萄球菌细胞膜渗透性影响的流式细胞图Fig. 4 Effect of sucrose laurate on membrane permeability of S. aureus evaluated by fl ow cytometry
图4显示,未经蔗糖月桂酸酯作用的菌体基本未被PI沾染,1/2 MIC和MIC蔗糖月桂酸酯作用于金黄色葡萄球菌30 min后,PI探针对菌体细胞的沾染率分别为84.7%和94.1%。结果表明蔗糖月桂酸酯导致金黄色葡萄球菌细胞膜渗透性受到损伤,且损伤程度与蔗糖月桂酸酯的质量浓度呈正相关。Weeks等[19]研究乳酸链球菌素对单细胞增生李斯特抑菌机理时,发现乳酸链球菌素作用10 min后细胞PI沾染率达到59.9%;Li Lirong等[20]采用PI作为荧光探针研究抗菌肽P7作用机理时发现,P7作用于沙门氏菌1 h后PI沾染率达到83.47%。上述研究表明蔗糖月桂酸酯与乳酸链球菌素和抗菌肽P7等物质抑菌机制类似,均可以破坏细胞膜的渗透性。
2.4 蔗糖月桂酸酯对金黄色葡萄球菌细胞膜完整性的影响
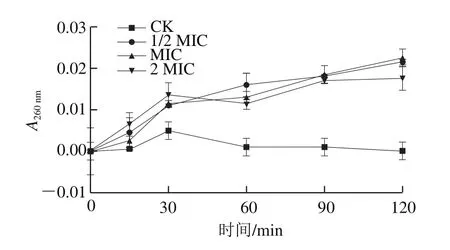
图 5 蔗糖月桂酸酯对金黄色葡萄球菌胞内大分子物质泄漏的影响Fig. 5 Leakage of intracellular macromolecular substances from S. aureus treated with sucrose laurate
细胞膜作为细菌的外部屏障,能够保护自身结构的完整性,保证正常的生理活动。若细胞膜系统遭到损伤,便会造成细菌内部多种重要生物大分子(核酸、蛋白质、糖类等)的泄漏,从而影响正常的合成代谢功能。因此,可以通过测定细胞内物质泄漏来反映细菌膜完整性。如图5所示,与对照组相比,金黄色葡萄球菌经不同质量浓度的蔗糖月桂酸酯处理后,260 nm波长处的吸光度随着作用时间的延长逐渐增强,然而各质量浓度的最高值仅在0.02左右,表明蔗糖月桂酸酯会造成金黄色葡萄球菌完整性受到轻微破坏,导致胞内核酸等生物大分子出现微量泄漏。这与蔗糖葵酸酯对沙门氏菌的完整性影响[14]不同,蔗糖葵酸酯会导致沙门氏菌核酸等大分子物质发生显著泄漏(A260nm增加约0.6)。
2.5 蔗糖月桂酸酯对金黄色葡萄球菌钾离子泄漏的影响

图 6 蔗糖月桂酸酯对金黄色葡萄球菌钾离子泄漏的影响Fig. 6 Effect of sucrose laurate on the leakage of potassium ions in S. aureus
蔗糖月桂酸酯与金黄色葡萄球菌细胞膜的作用可能会使细胞膜上形成跨膜通道,导致细胞内小分子物质(如钾离子等)泄漏,因此,本研究通过高灵敏度膜不渗透性探针PBFI考察蔗糖月桂酸酯对金黄色葡萄球菌细胞内钾离子泄漏的影响。由图6可知,蔗糖月桂酸酯会导致金黄色葡萄球菌细胞钾离子泄漏,且泄漏量与添加的蔗糖月桂酸酯质量浓度呈正相关。因此,推测蔗糖月桂酸酯会破坏金黄色葡萄球菌细胞膜的渗透性。这与Yang Xu等[23]研究的抗菌肽对金黄色葡萄球菌的作用机制类似,他们也发现抗菌肽作为“双亲性”物质会破坏金黄色葡萄球菌的细胞膜,导致胞内钾离子发生显著性泄漏。
2.6 蔗糖月桂酸酯对金黄色葡萄球菌超微结构的影响

图 7 蔗糖月桂酸酯对金黄色葡萄球菌影响的TEM观察结果Fig. 7 Transmission electron microscope observation of S. aureus treated with sucrose laurate
通过TEM可直观地观察到菌体细胞内部及外部超微结构的变化[24]。图7表明,未经蔗糖月桂酸酯处理的金黄色葡萄球菌表面光滑且呈边缘清晰的球形,细胞质分布均匀;经MIC蔗糖月桂酸酯作用1 h后,菌体表面变粗糙,边缘模糊;经2 MIC蔗糖月桂酸酯作用1 h后,细胞发生严重形变,菌体细胞膜开始皱缩,胞内物质密度显著降低。根据上述结果推测,蔗糖月桂酸酯作用于金黄色葡萄球菌细胞壁,使其变得疏松粗糙,但并不会使其破裂;其作用于细胞膜,破坏细胞渗透性,导致细胞质固缩,胞内物质轻微泄漏。这与胡静等[25]利用TEM观察槐糖酯对金黄色葡萄球菌超微结构影响的结果相似,即槐糖脂作用于金黄色葡萄球菌后,TEM观察结果显示其能够破坏菌体细胞膜和细胞壁,造成细胞质固缩、形成空腔。
3 讨 论
随着生活水平的提高,人们对食品添加剂提出了更高的要求。然而,在食品加工过程中为了达到保持食品良好感官性状、提高食品保藏性能等目的需要使用食品添加剂。双功能性添加剂由于能够发挥双重作用而受到青睐。
糖酯作为双功能性添加剂近年来受到人们关注。一方面,糖酯具有亲水和亲油特性,可作为非离子型乳化剂在食品、医药及化妆品等领域有广泛应用:Anarjan等[26]发现蔗糖月桂酸酯作为乳化剂可以制备小粒径的虾青素纳米乳液;Amalini等[27]发现糖酯作为表面活性剂加入鱼皮明胶中制备的蛋白质可食用膜水分渗透性和溶解性均降低;Nakamura等[28]发现蔗糖脂肪酸酯可以作为润滑剂,通过直接压片法制备高硬度和短崩解时间的药片。另一方面,糖酯对食品中常见的致病菌与腐败菌具有广谱抑菌作用:Furukawa等[29]发现脂肪酸糖酯可以有效抑制食源性致病菌生物膜的形成;Maja等[30]发现蔗糖月桂酸酯可以抑制蜡样芽孢杆菌的生长。本研究中所考察的蔗糖月桂酸酯对金黄色葡萄球菌具有较好地抑菌作用(MIC为0.312 5 mg/mL),在食品中可同时发挥乳化和抑菌双重作用,在火腿肠、乳饮料等食品生产中具有较大的应用潜力。
目前关于糖酯抑菌活性的相关报道较多,但是对于蔗糖月桂酸酯的抑菌机制目前尚鲜见报道。细胞膜作为菌体自我保护的第一道屏障,在自我防御系统中发挥着重要作用。本研究利用荧光显微镜结合流式细胞术考察了蔗糖月桂酸酯对细胞膜渗透性的影响,通过荧光分光光度法考察细胞膜电势的变化,采用钾离子敏感性探针考察小分子物质的泄漏,通过260 nm波长处吸光度的变化考察核酸等大分子物质的泄漏,最后通过TEM观察细胞膜及胞内物质密度的变化,全方位分析了蔗糖月桂酸酯对细胞膜的损伤。本研究发现,蔗糖月桂酸酯可以改变细胞膜电势,导致钾离子泄漏,但是不会导致大分子物质发生显著泄漏,表明蔗糖月桂酸酯主要通过改变细胞膜渗透性但不显著改变其完整性而发挥抑菌作用。这与Zhao Lei等[13]对蔗糖葵酸酯对金黄色葡萄球菌细胞膜损伤的研究结果不同,他们认为蔗糖葵酸酯可以显著破坏细胞膜完整性,导致大分子物质蛋白质发生显著性泄漏。然而,本研究对于蔗糖月桂酸酯对细胞膜的作用机制主要从细胞层面分析,对于分子层面上的细胞膜作用机制(如是否对细胞膜脂肪酸表达模式及脂蛋白的结构产生影响)有待进一步研究。
综上,蔗糖月桂酸酯对金黄色葡萄球菌具有较强的抑制作用。可以通过消散细胞跨膜电势、破坏细胞膜渗透性造成胞内钾离子泄漏,但不会明显破坏细胞膜完整性,核酸等大分子物质仅发生轻微泄漏。因此,推测细胞膜是糖酯发挥抑菌作用的一个主要靶点。

