生长激素促进斑马鱼尾鳍的再生
刘雪静,王雪雯,石运伟,王新,高煜,刘东1,*
(1. 南通大学生命科学学院,南通 226001;2. 南通大学医学院,南通 226001; 3. 南通大学教育部江苏省神经再生重点实验室,南通 226001)
近年来,组织再生研究取得了很大进展,但对组织再生的理解与临床需要仍有很大距离。各物种间再生能力差异很大[1],与哺乳动物相比,非哺乳类脊椎动物、两栖动物、硬骨鱼类拥有良好的再生潜能,例如:斑马鱼(Daniorerio, zebrafish)作为模式动物具有较强的再生能力,它的鳍[2]、心脏[3]、肝[4]、视网膜[5]、脊髓[6]和感觉毛细胞[7]在损伤后能够再生,是研究再生问题的良好模型[8]。大量研究发现,组织再生过程中,FGF、Wnt、Notch、BMP、Hedgehog、IGF等信号通路参与其中[9-11]。然而,至今组织再生的信号调控机制还没有被阐述清楚[12-15]。
组织再生过程中,涉及大量细胞的分裂、增殖生物学过程,因此,物质代谢的调控对组织再生过程具有重要作用。其中,生长激素(growth hormone, GH)是调控代谢的重要信号。GH是组织生长和机体代谢中重要的肽激素,由垂体前叶合成并释放,通过作用于特异性膜结合受体发挥其对细胞增殖的调节功能[16],因此在人类以及动物的生长发育过程中具有重要的作用。GH通过与靶细胞膜上的特定受体结合激活MAPK/ERK通路促进软骨细胞的分离和增殖[17];此外,GH还可通过JAK/SATA途径刺激胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)生成[17],在此过程中肝是主要的靶器官并且是产生IGF-1的主要部位,产生的IGF-1对多种组织的生长具有促进作用。GH缺乏或过量均能引起代谢紊乱,如巨人症通常是由于垂体病变导致垂体腺瘤从而使生长激素分泌过多引起的[18]。儿童GH缺乏的主要表现是生长障碍,身材矮小和性成熟延迟。在成人中,生长激素缺乏(GH deficiency, GHD) 将导致破骨细胞活性增强,使得骨骼更加脆弱,更容易发生病理性骨折和骨质疏松症[19]。
本文以斑马鱼为研究对象,通过 Gateway技术和 Tol2 系统建立转基因系Tg(ubi:GH)。ubi 启动子来自于斑马鱼泛素基因的上游调控区,能够诱导下游基因在全身各组织器官表达[20],我们利用ubi启动子驱动下游GH在斑马鱼全身表达,发现GH过表达能够促进斑马鱼尾鳍再生。
1 材料与方法
1.1 材料
1.1.1 实验动物
斑马鱼由南通大学实验动物中心提供,本文中显微注射以及外交所使用的斑马鱼均为野生型AB系斑马鱼,喂养和产卵方案依照ZFIN:The Zebrafish Book (http://zfin.org/zf_info/zfbook/zfbk.html)。
1.1.2 仪器设备
PV830显微注射仪(World Precision Instruments)、手术器械(World Precision Instruments)、MVX10体视显微镜(Olympus)、MIR-154恒温培养箱(Sanyo)、T100TM Thermal Cycler PCR仪(Bio-Rad)、SDS-PAGE电泳系统(Bio-Rad)、StepOnePlusTMReal-Time PCR System。
1.2 方法
1.2.1 模型制作
取6月龄转基因斑马鱼与野生型斑马鱼,麻醉至失去运动能力后置于培养皿中,于显微镜下横切80%尾鳍。横切尾鳍后的斑马鱼暂喂养在杂交缸中,并对其进行编号。横切尾鳍后每天记录斑马鱼尾鳍再生情况,记录至斑马鱼尾鳍再生完全(切除后15 d)。
通过 Ensembl 数据库(http://asia.ensembl.org/index.html)查询生长激素基因(growth hormone)序列,合成重组质粒 pME-GH,将其与 p5E-ubi、p3E-polyA 重组克隆到表达载体 pDestTol2CG2 中,获得表达质粒“pDestTol2CG2; ubi:GH-polyA”。将表达质粒与transposase mRNA显微注射到1细胞期的斑马鱼胚胎中,发育至48 h,在荧光显微镜下观察筛心脏带有绿色荧光的胚胎,培养至成鱼(G0)。G0 与野生型 AB 系交配筛选出子一代(F1 代)。
1.2.2 qPCR检测GH表达
分别收集48 hpf的野生型和转基因斑马鱼胚胎各10枚,加入1 mLTrizol提取总RNA,经逆转录后获得cDNA,通过qPCR检测分析GH的表达情况。利用Primer 3 在线引物设计工具(http://primer3.ut.ee)设计生长激素基因GH和内参基因ef1a的PCR引物为:GH-qPCR-L: 5’-ggtggtggttagtttgctgg-3’,GH-qPCR-R: 5’-caactgtctgcgttcctcag-3’; ef1a-L:5’-tgatctacaaatgcggtgga-3’,ef1a-R:5’-caatggtgataccac gctca-3’。
1.3 数据采集及统计学方法
实验中使用体视显微镜自带软件对斑马鱼尾鳍生长长度进行测量,分别选取背侧、腹侧以及中间部位的固定位置进行测量并记录数据。相关数据在 GraphPad Prism 5.0上利用 Student’sttest 进行组间的差异分析,P< 0.05 具有显著性差异。
2 结果
2.1 建立转基因斑马鱼Tg(ubi: GH)
为研究GH过表达对斑马鱼尾鳍再生的影响,我们利用 Gateway技术构建转基因表达质粒—pDestTol2CG2; ubi:GH-polyA(图1A),其中在心脏表达的绿色荧光蛋白用于筛选转基因斑马鱼。在一细胞期显微共注射表达质粒“pDestTol2CG2; ubi:GH-polyA”和转座酶 mRNA(图1B),发育至48 h,通过荧光显微镜下筛选出在心脏组织特异性表达绿色荧光蛋白斑马鱼胚胎(图1C),培养至成年,与AB系野生型斑马鱼交配产生F1代,筛选出心脏表达绿色荧光蛋白的斑马鱼,继续培养至成年,用于斑马鱼尾鳍再生实验。如图1D所示,qPCR检测也发现心脏表达绿色荧光蛋白的转基因斑马鱼中GH表达显著高于野生型斑马鱼(P< 0.05)。成年后,转基因斑马鱼也比野生型体积大(图1E)。
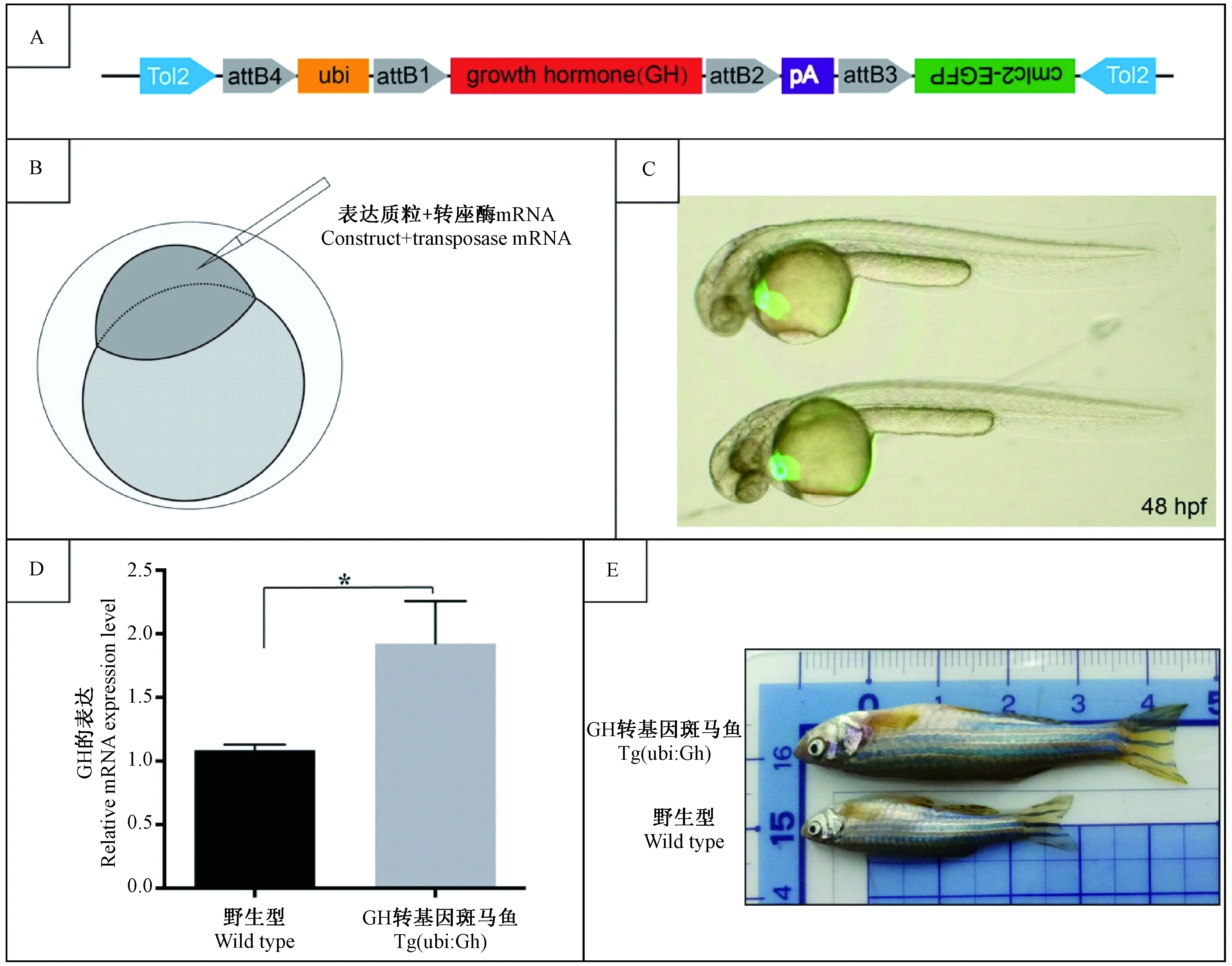
注:A. GH表达质粒示意图。B. 在斑马鱼胚胎一细胞期共注射GH过表达质粒和转座酶mRNA。C. 48hpf,转基因斑马鱼心脏表达绿色荧光蛋白。D. qPCR技术检测转基因斑马鱼中GH的表达,*P=0.0123 < 0.05。E. 过表达生长激素的成年转基因斑马鱼比野生型体积大。图1 建立转基因系 Tg(ubi: GH)Note. A. Schematic representation of the “pDestTol2CG2; ubi:GH-polyA” vector fragment. B. Co-injection of GH overexpression vector and transposase mRNA in one cell stage. C. The green fluorescent protein was detected the in heart of transgenic zebrafish at 48 hpf. D. The expression of GH was detected by qPCR in the transgenic zebrafish.*P=0.0123 < 0.05. E. Transgenic zebrafish overexpressing GH was bigger than the wild type fish.Figure 1 Establishment of the transgenic line Tg(ubi: GH)
2.2 斑马鱼尾鳍再生过程
将成年斑马鱼分为野生型对照组和转基因组,麻醉后于显微镜下将尾鳍横切约80%后,连续观察尾鳍再生情况(图2),在15 ~ 18 d后能够观察到完整的尾鳍再生。
2.3 GH促进斑马鱼尾鳍再生过程
对野生型和转基因系Tg(ubi:GH) 的斑马鱼尾鳍再生过程进行连续拍照记录尾鳍,测量斑马鱼尾鳍再生长度并进行统计分析(图3A)。结果显示:与野生型斑马鱼相比,过表达GH的斑马鱼在相同时间点尾鳍再生的长度明显增加(图3B-D)。为进一步评估过表达GH对斑马鱼尾鳍再生的影响程度,分别测量横切后8 d和18 d的尾鳍再生长度,进行t-test分析。结果显示:与野生型斑马鱼相比,GH过表达的斑马鱼在8 dpa(图3E)和18 dpa(图3F)再生尾鳍的长度具有显著性差异,说明过表达GH在斑马鱼尾鳍再生过程中表现出显著的促进再生作用。

注:野生型和转基因斑马鱼尾鳍横切后再生过程。红色虚线标记为横切位置。图2 成年斑马鱼尾鳍再生过程Note. The red dashed line is marked as the cross-cutting site.Figure 2 Regeneration process of adult wild-type and transgenic zebrafish caudal fins after amputation
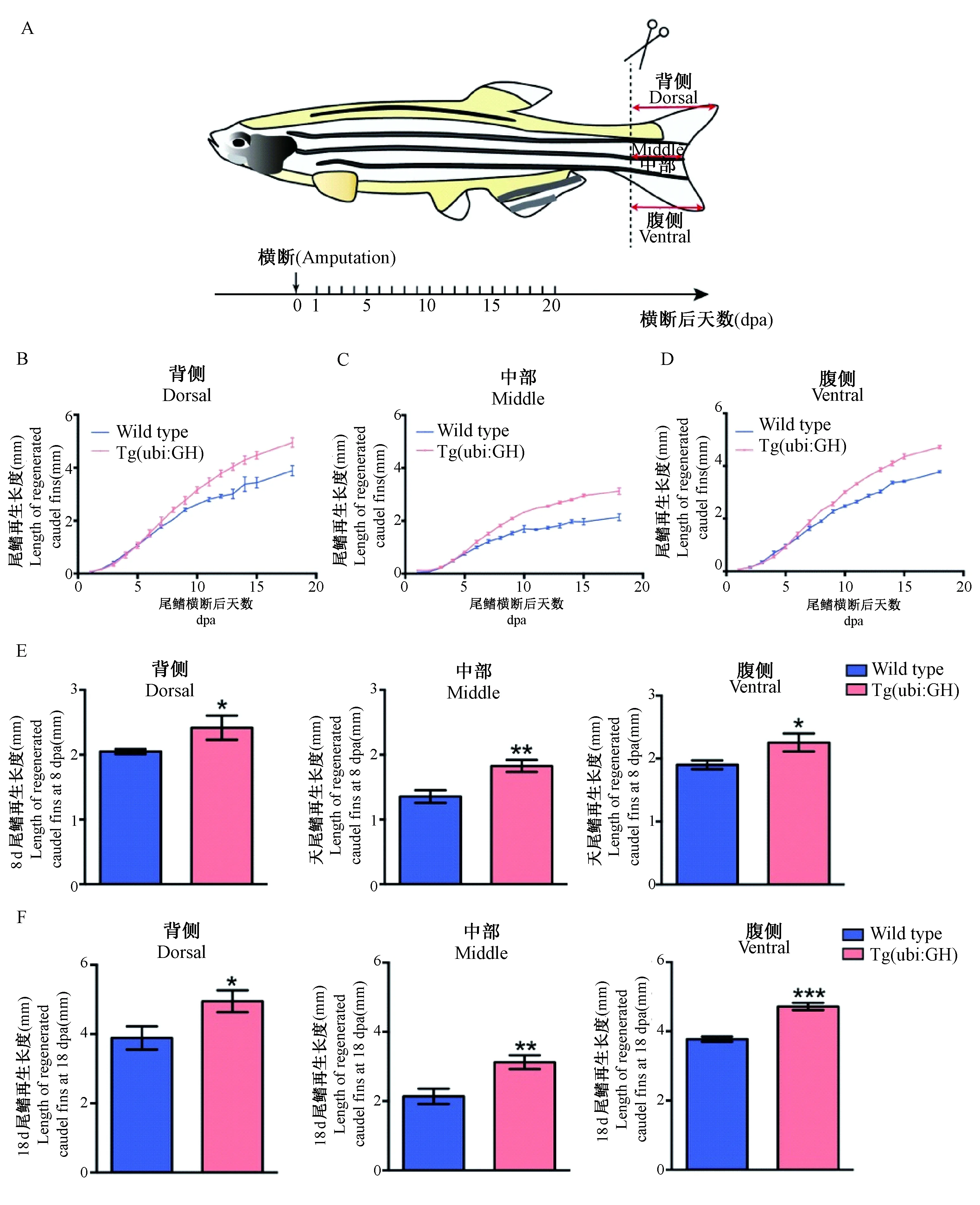
注:A.成年斑马鱼尾鳍横切示意图;B-D. 不同时间点斑马鱼尾鳍背侧、中部、腹侧部位再生长度;E. 横切手术后8 d,斑马鱼尾鳍再生长度t-test分析;F. 横切手术后18 d。斑马鱼尾鳍再生长度t-test分析,n4,*P < 0.05,**P < 0.001,***P < 0.001。图3 GH促进斑马鱼尾鳍再生Note. A. Schematic representation of an adult zebrafish caudal fin amputation. B-D. Regenerative length of dorsal, medial and ventral parts of the caudal fin at different time points. E. t-test analysis of zebrafish caudal fin regeneration length at 8 days after amputation. F. t-test analysis of the caudal fin regeneration length at 18 days after amputation, n 4,*P < 0.05,**P < 0.001,***P< 0.001.Figure 3 Growth hormone promoted the regeneration of zebrafish caudal fin
3 讨论
哺乳动物再生能力非常有限,在组织再生研究过程中,仍存在着亟待解决的关键性问题:决定再生能力的因素、再生的起始因子、再生过程中细胞的去分化与转分化、以及再生过程中细胞增殖和分布模式的控制机制等[10]。因此,充分理解再生的调控机制有助于推动再生医学的发展。近年来,斑马鱼作为脊椎动物再生研究模型,组织再生能力强,在多方面优于果蝇、小鼠等其他模式生物[21],例如成年斑马鱼尾鳍结构简单、便于手术、快速再生,越来越多的受到人们关注[21-23]。多种遗传操作技术在斑马鱼上的也得到了广泛应用,包括转基因技术和基因编辑技术,使其作为再生研究的模型更加强大。
研究发现,斑马鱼鳍再生大致可以分为五个阶段:再生上皮形成、间充质解体(mesenchymal disorganization)、再生原基形成(blastema formation)、组织生长和终止。再生原基的形成是关键性步骤,多个信号通路参与调控再生过程。如fgf20a被报道是鳍再生早期阶段的一个关键基因[24],能够启动鳍再生过程。Geoffrey等[23]研究发现,在鳍再生开始阶段,fgf20a在上皮-间充质边界(epithelial-mesenchymal boundary)表达,而在Y148S突变的fgf20a突变体中,出现再生原基形成缺陷的表型(即Dob,devoid of blastema mutant),阻碍鳍再生。 此外,如Lepb最近被报道为增强调节原件来激活组织再生[25];Jak1/Stat3信号通路的靶基因Socs3b与再生过程中细胞免疫、免疫调节密切相关[26];Wnt作为Fgf信号的上游调控斑马鱼鳍再生[24, 27];视黄酸、Bmp和Hedgehog信号也被认为在鳍再生中发挥重要作用[11]。组织再生过程涉及细胞的增殖和分裂,GH被报道通过参与调控MAPK/ERK通路、JAK/SATA/IGF-1通路等,促进组织再生过程中细胞增殖和分裂[27-28]。
生长激素在个体的生长发育过程中发挥着极其重要的作用,可以通过作用于肝细胞膜上的生长激素受体,产生生长介素从而促进全身组织细胞的发育、增殖。研究表明,生长激素具有明显的促进肝细胞再生的功能[28], 正常小鼠部分肝脏切除后,外源性GH能够增加肝细胞生长因子HGF(hepatocyte growth factor)基因的表达,加速肝细胞DNA合成反应,从而促进肝细胞的再生[29-30]。我们建立了过表达GH的转基因斑马鱼,通过尾鳍再生实验发现:GH过表达能够显著促进斑马鱼尾鳍再生过程。因此,生长激素具有治疗肢体创伤的潜在活性,但其具体的作用机制仍需要进一步研究。

