肿瘤酸度响应高分子药物载体研究进展
孙春阳综述,于春水审校
(天津医科大学总医院医学影像科,天津市功能影像重点实验室,天津300052)
高分子纳米药物载体系统具有独特的尺寸,可以通过键合、包载或囊封方式负载并保护化疗药物分子,提高药物的体内稳定性,避免药物在血液中被快速清除;此外,高分子纳米载体可以借助肿瘤血管的增强通透性和滞留效应(Enhanced Permeability and Retention effect,EPR effect) 改变药物的体内分布、被动地增强药物病灶富集、降低给药剂量和毒副作用[1-3]。由于在肿瘤治疗中体现出的巨大潜力,纳米载药系统长期以来一直是研究领域的热点,以DOXIL®、力朴素为代表的纳米药物已经进入临床,并获得了相当的市场份额[4-6]。
尽管药物载体系统经过近十几年的发展,取得了长足进步,但大量的基础研究结果表明,现有纳米载体还存在很多缺陷:如肿瘤细胞摄取量低、肿瘤渗透性差和药物释放速度不足等,严重制约载体疗效的提升[7-9]。
近年来,研究人员逐渐发现,肿瘤组织由于更加旺盛的生理活动,存在与正常组织完全不同的微环境[10]。这其中,弱酸性环境是肿瘤组织和肿瘤细胞都具有的特异性环境。肿瘤细胞的能量需求高,会以更高的效率吸收葡萄糖促进自身快速生长,而葡萄糖的利用方式主要是产能效率低下的糖酵解作用。与此同时,细胞会产生并外排大量乳酸,造成肿瘤组织基质呈现弱酸性,一般认为,肿瘤组织基质的pH值为6.5~7.2[11]。另一方面,为了维持酸性水解酶活性,肿瘤细胞内内涵体或溶酶体表面会表达特殊的转运蛋白,以泵入氢离子,从而将pH环境维持在 5.0~5.5 范围[12]。
综上所述,肿瘤细胞普遍性的生理活动造成了肿瘤组织基质和细胞内的弱酸性环境。这种生理基础十分稳定,在多种肿瘤细胞系中均有所报道。因此,基于其设计构建pH敏感高分子载药系统,有望解决药物体内输送的多重屏障,实现更好的治疗效果。近年来,该研究领域已有较大进展,本文将这些工作进行综述。
1 肿瘤基质酸度促进纳米载体组织渗透
当纳米颗粒经EPR效应进入肿瘤组织后,其尺寸大小是影响肿瘤渗透和组织深部给药的决定性因素。大尺寸颗粒(100~400 nm)的体内循环时间长,EPR效应受益性好,但无法进入肿瘤深层组织;小颗粒的肿瘤渗透性更好,但在系统给药后易被迅速清除,缺乏长血液循环和肿瘤富集性能。已有研究证明,肿瘤酸度可调控纳米颗粒尺寸,在正常生理环境下,其尺寸约为100 nm;而当外部刺激源出现,颗粒收缩或崩解,产生小尺度颗粒,完成肿瘤渗透。例如,Wang等[13]将聚酰胺胺(PAMAM)树枝状分子键合于100 nm尺度的纳米颗粒表面,在肿瘤组织pH条件,桥联化学键CDM发生降解,PAMAM从大颗粒表面释放。激光共聚焦显微镜观察发现,携载铂类药物的PAMAM分子可以在BxPC-3肿瘤模型中具有更优越的渗透能力,从而更好地抑制肿瘤生长(图 1)。
进而,他们还设计了超敏聚乙二醇-聚甲基丙烯酸2-(六甲撑亚胺)乙酯-聚酰胺胺嵌段聚合物(PEG-PAEMA-PAMAM/Pt),在 pH 7.4 环境下,聚合物可组装形成80 nm的纳米颗粒,在PEG壳层保护下实现体内长循环;在进入肿瘤组织后,疏水的PAEMA嵌段迅速转变为亲水性,纳米颗粒解离,小尺寸的亲水高分子链携载药物渗透至肿瘤组织深部(图2)[14]。组织分布及瘤内扩散实验证实,该纳米载体不仅具有较好的EPR效应,而且具有较好的瘤内深部渗透作用。Ge等[15]利用2,3-二甲基马来酸酐对聚乙二醇-聚天冬氨酸进行修饰,得到PEG-PAsp(EDA-DM);再将负电性 PEG-PAsp(EDA-DM)与正电性PAMAM-Pt(IV)前药分子进行自组装,形成~140 nm的大尺寸纳米颗粒。在pH 6.8条件刺激下,聚合物的侧基发生降解,使聚合物链由负电性转变为正电性,破坏其与PAMAM-Pt(IV)之间的相互作用,释放 PAMAM-Pt(IV),增强对 A549R 耐药细胞的增殖抑制作用。
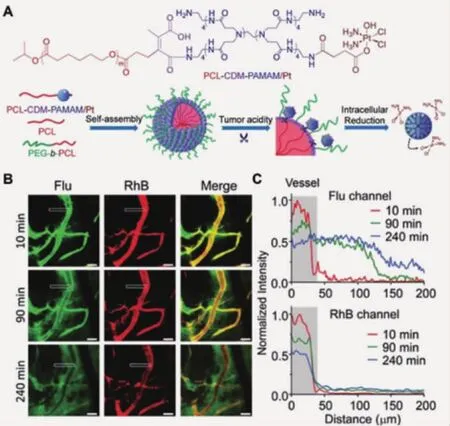
图1 激光共聚焦显微镜观察并分析响应性载体(红色荧光,RhB)在肿瘤内释放PAMAM分子(绿色荧光,Flu)的行为[13]
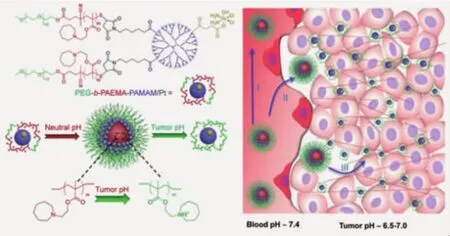
图2 超敏pH响应纳米颗粒将在进入肿瘤组织后,迅速解离为单分子链,增加进入肿瘤深层组织的能力[14]
2 肿瘤基质酸度增强纳米载体细胞摄取
已有研究表明,纳米载体表面“PEG化”会极大限制肿瘤细胞对其的摄取;同时,纳米颗粒的表面性质对其细胞摄取有重要影响。因此,可基于肿瘤组织pH环境设计响应性纳米载体,调控颗粒表面性质实现提高细胞摄取的目的。Bae课题组[16]利用聚丙交酯-聚乙二醇-聚组氨酸-生物素和聚乙二醇-聚组氨酸构建了混合胶束。在正常生理环境,聚组氨酸为疏水嵌段,使生物素靶向分子贴近胶束内核;而在肿瘤基质pH环境,咪唑环质子化,聚组氨酸转变为亲水性,生物素分子移动至胶束外层,发挥靶向功能,提高胶束进入肿瘤细胞的含量(图3)。
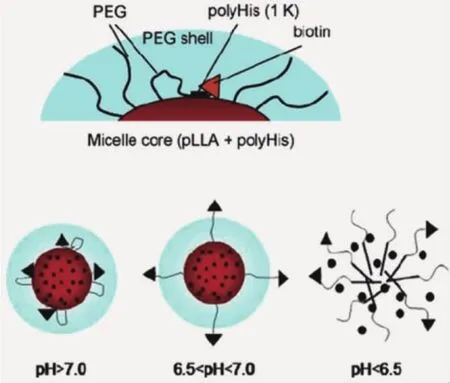
图3 肿瘤酸度触发靶向基团(biotin)发挥功能的示意图[16]
Wang等[17-20]构建了一系列响应性“电荷反转”纳米颗粒,在系统给药后,颗粒表面负电荷会降低蛋白吸附,延长颗粒的循环时间,提高被动靶向性能;而当颗粒富集于肿瘤组织后,聚合物侧基的DMMA基团发生降解,负电性纳米颗粒转变为正电性,增强颗粒与蛋白的结合作用。与非响应性载体相比,“电荷反转”颗粒能够兼顾长循环和细胞摄取两方面优势,将更多的药物输送至肿瘤细胞内,改善药物治疗效果。在此基础之上,Wang等[21-23]进一步对DMMA基团进行改进,合成了多种聚乙二醇化响应性桥联聚合物,通过“PEG脱壳”策略,进行siRNA和化疗药物体内递送。当载体被动进入肿瘤组织后,Dlinkm化学键降解,使PEG壳层从纳米颗粒表面脱落,提高肿瘤细胞对载体的识别能力。在给药后对肿瘤细胞进行分析,可发现胞内药物浓度显著提高(图4)。
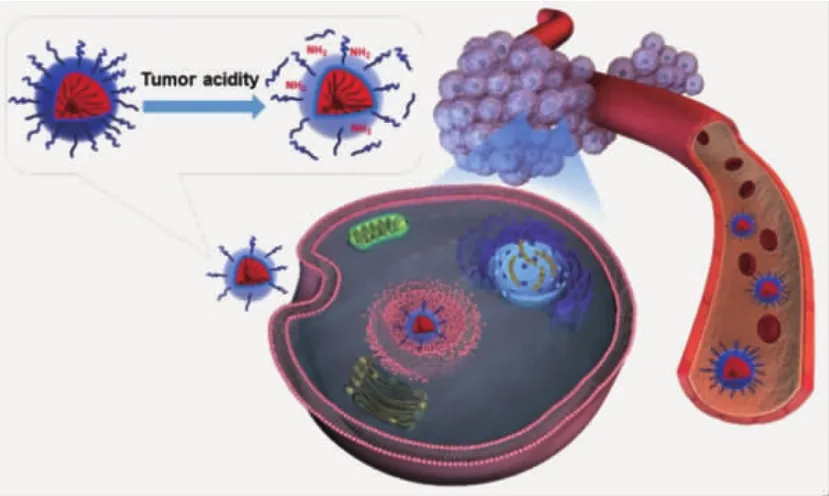
图4 高分子纳米载体借助PEG壳层的保护,延长药物的血液循环;在富集于肿瘤组织后,通过“电荷反转”/“PEG脱壳”等策略,提高肿瘤细胞的识别摄取[21]
使用细胞穿膜肽对聚乙二醇化载体进行修饰,可以在体外水平显著性增强细胞摄取;但修饰后的纳米颗粒后会在体内循环过程中被加速清除,降低载体系统的疗效[24-25]。Yang等[26]将穿膜肽Transcriptional Activator Protein(TAT)中的赖氨酸侧基用2,3-二甲基马来酸酐修饰,药代动力学和分布实验结果显示,当赖氨酸氨基被屏蔽后,TAT功能被显著抑制,载体的循环性能与未修饰TAT的颗粒相近;只有在pH 6.5条件下,DMMA基团降解,TAT才能在肿瘤组织发挥功能,增强颗粒的细胞摄取能力,在体内肿瘤抑制实验中,这种载体系统体现出了自身的优越性。Zhou等[27]采用类似方法,结合肿瘤细胞胞内谷胱甘肽响应性药物释放,同时解决细胞摄取和胞内药物释放屏障,实现了级联响应性药物递送。
3 肿瘤细胞酸度加速药物胞内释放
药物释放是纳米载体体内给药的最后一步,只有在细胞内将原药分子迅速释放,才能发挥杀伤肿瘤细胞的功能。纳米载体在细胞摄取后,会在较长时间内处于内涵体/溶酶体。因此,可以设计响应性的纳米药物载体,针对细胞器内弱酸性环境(pH 5.0~5.5)解离或降解,快速释放药物。目前,具备胞内敏感药物释放性质的载体的设计手段,主要有两种:一种是将反应基团修饰在聚合物侧基,当纳米颗粒接收到刺激源后,其侧基会发生响应性的降解或质子化,使得疏水嵌段转变为亲水嵌段,颗粒在无法获得疏水-疏水相互作用的支持后会快速解离为高分子链,同时释放包载药物。Yu等[28]报道了聚乙二醇-b-聚(二异丙基氨基甲基丙烯酸酯),在pH 7.4条件下,两亲性聚合物可自组装形成蠕虫状的纳米胶束。当纳米颗粒被A549肺癌细胞摄取后,由于二异丙基氨基基团的质子化,颗粒会迅速解离,恢复光敏剂Ce6功能,对肿瘤细胞进行高效的光动力学治疗(图5)。Zhong等[29]利用聚乙二醇-聚甲基丙烯酸(三甲氧基苯甲缩醛-三羟甲基乙烷酯)-聚丙烯酸(PEG-PTTMA-PAA)制备了携载阿霉素(DOX)的纳米囊泡,在pH 5.0条件下,缩醛键降解,使两亲性聚合物的亲疏水比例变化,调控纳米颗粒组装状态,DOX得以释放并杀伤Hela细胞。Wooley等[30]将紫杉醇(PTX)分子经β-硫代丙酸酯键键合于聚乙二醇-聚磷酸酯侧基,制备得到的PEO-PPEPTX在进入OVCAR-3细胞后,β-硫代丙酸酯键降解,PTX与聚合物骨架分离,使疏水嵌段转变为亲水嵌段,PTX快速释放。
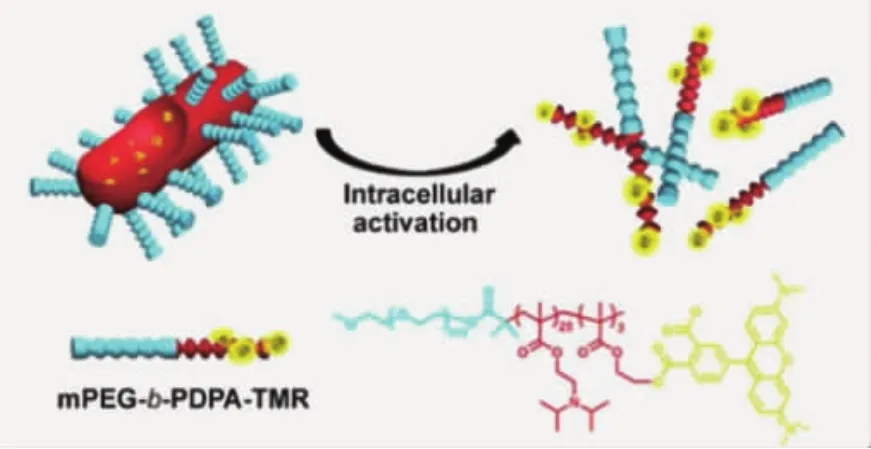
图5 在中性条件,两亲性聚合物自组装为蠕虫状纳米胶束;肿瘤细胞酸性条件刺激聚合物转变为全亲水性,胶束解离[28]
另一种实施方案是将化学键作为纳米颗粒亲疏水组分的桥联部分,当桥联化学键遭遇刺激源后,会迅速降解,从而将亲疏水组分分离,最终改变纳米颗粒的组装结构,进一步促进药物释放。Wagner研究组[31]曾利用腙键将PEG与疏水性胆固醇“桥联”,并与DNA复合,组装成纳米颗粒。在生理条件下颗粒可稳定存在,而被细胞摄取并进入内涵体后,在偏低的pH环境(pH=5.4)下腙键迅速降解断裂,使纳米颗粒表面脱去PEG保护层,去PEG化的纳米颗粒在响应性释放DNA的同时可以显著促进基因药物从内涵体的逃逸。上述载体系统在体外水平与非“桥联”的体系相比,基因药物的转染效果增强约40倍(图6)。
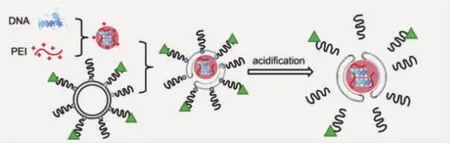
图6 桥联高分子的化学键被弱酸性环境降解,纳米载体崩解,释放携载DNA[31]
4 展望
肿瘤酸度响应纳米药物载体巧妙利用了肿瘤组织和肿瘤细胞内独特的微环境,有效解决了纳米载体在系统给药后面临的肿瘤渗透、高效摄取、快速释放药物等难以,改善了原有化疗药物的疗效,降低了毒副作用,受到纳米医学科研工作者的广泛关注。除了肿瘤酸度,肿瘤组织还存在还原物质、特异性表达酶等内在微环境;同时,超声、激光等也是很好的外部刺激因子。在未来抗肿瘤药物递送研究中,多重级联响应性载体将成为研究热点。这种载体集成了不同微环境下的协同效应,不仅能够更好地克服各个给药屏障,还可以协调各个屏障间的关系,实现高效药物递送。然而,多重响应性载体的材料合成步骤复杂,质量不容易控制,只有联合推动材料学和相关学科共同发展,才能有效解决该问题,使纳米药物载体的给药向更加精准化方向发展。

