美沙拉嗪口服联合灌肠治疗轻-中型急性溃疡性结肠炎患者的疗效研究*
李周玉
自贡市第五人民医院内科 四川自贡 643000
溃疡性结肠炎(ulcerative coliti,UC)属于一种常见、多发的消化系统疾病,其病程漫长、反复发作,甚至可出现癌变,严重影响患者的身心健康。其发病机制尚不清楚,目前认为其发病多与自身免疫低下、肠道菌群失调、遗传及环境等因素有关[1-2],近年来,我国UC发病率有逐年上升趋势[3]。轻-中型UC治疗首选药物为水杨酸制剂[4],因柳氮磺吡啶在临床使用中不良反应发生较多,目前已逐渐被美沙拉嗪替代[5],已有研究显示,美沙拉嗪口服联合灌肠治疗UC的效果良好[6]。本研究旨在探讨美沙拉嗪口服联合灌肠给药治疗轻-中型急性UC患者的疗效及安全性,以期为临床治疗提供参考,现报告如下。
1 资料与方法
1.1 一般资料
纳入2016年1月至2018年1月本院内科门诊及住院部收治并经临床诊断为轻-中型急性溃疡性结肠炎的患者为研究对象,按患者就诊顺序将其分为M1组(予以美沙拉嗪口服)、M2组(予以美沙拉嗪口服联合灌肠)及M3组(予以柳氮磺吡啶口服),每组各纳入41例。M1组中男性17例、女性24例,平均年龄(27.13±5.82)岁;M2组中男性20例、女性21例,平均年龄(25.70±4.93)岁;M3组中男性19例、女性22例,平均年龄(26.37±4.12)岁;三组患者性别、年龄比较,差异均无统计学意义(均P>0.05)。本研究经医院伦理委员会同意,所有患者签署知情同意书。
1.2 纳入与排除标准
纳入标准[7-8]:(1)符合UC有关诊断标准,经肠镜检查、病理等诊断为确诊为轻-中型急性患者;(2)粪便常规及霉菌培养阴性。排除标准:(1)对研究所使用药物过敏患者;(2)经内镜或实验室检查属于暴发型肠炎、单纯慢性肠炎及细菌性腹泻患者;(3)妊娠、哺乳期患者;(4)合并严重心脑血管疾病或全身感染患者。
1.3 治疗方法
M1组予以美沙拉嗪口服(葵花药业集团佳木斯鹿灵制药有限公司生产,批号H19980148,0.5 g/片;0.5 g/次,4次/d)。M2组予以美沙拉嗪口服(0.5 g/次,2次/d)+美沙拉嗪保留灌肠(1.0 g美沙拉嗪研末溶入39~41℃温开水,1次/d)联合治疗。M3组予以柳氮磺吡啶餐后口服(上海中西三维药业有限公司,批号150504,0.25 g/片;起始剂量0.5 g/次、4次/d,1 w内逐渐增加到1.0 g/次、4次/d)。三组均连续干预8 w,并予以相应的对症处理,治疗期间禁食海鲜、生冷、辛辣饮食,戒烟酒。
1.4 观察指标
1.4.1 疗效评价[9]于治疗结束后1 w进行评价:治愈,指临床症状及肠黏膜完全恢复;显效,指临床症状及肠黏膜病变明显改善;有效,指临床症状及肠黏膜病变有好转;无效,指临床症状及大肠黏膜病变无变化。总有效率=(治愈例数+显效例数+有效例数)/总例数×100%。
1.4.2 血清炎症因子 于治疗前3 d内及治疗后7 d内抽取患者空腹静脉血,采用ELISA法分析(试剂盒由上海酶联生物耗材公司提供)测定血清肿瘤坏死因子-α(TNF-α,0.02~0.40μg/L)、C反应蛋白(CRP,0~10 mg/L)、白细胞介素-1(IL-1,0~1.5 ng/mL)水平。
1.4.3 肠黏膜损伤、出血情况 治疗前3 d内及治疗后1月内由同一医师对患者进行内镜检查,并参照相同标准进行评分。(1)Mayo活动指数[10]:>2分为症状缓解,3~5分表示轻度,6~10分为中度,11~12分为重度。(2)Baron内镜评分[11]:0分表示正常;2分表示轻度炎症(黏膜充血、水肿,无出血);4分表示中度炎症(黏膜接触性出血);6分表示重度炎症(黏膜溃疡出血)。
1.4.4 不良反应 记录治疗期间患者不良反应发生情况。
1.5 统计学方法
采用SPSS 20.0统计软件对数据进行分析。计量资料用(xˉ±s)表示,多组间比较使用One-way ANOVA比较,两两比较采用LSD-t检验;计数资料用[n(%)]表示,采用χ2检验或校正χ2检验进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 临床治疗效果评价
三组患者临床治疗总有效率比较,差异有统计学意义(χ2=6.689,P=0.035);M2组总有效率高于M3组,差异有统计学意义(χ2=6.248,P=0.012);M1组、M3组比较,差异无统计学意义(χ2=2.040,P=0.153);M1组、M2组比较,差异无统计学意义(校正χ2=0.625,P=0.429)。见表1。
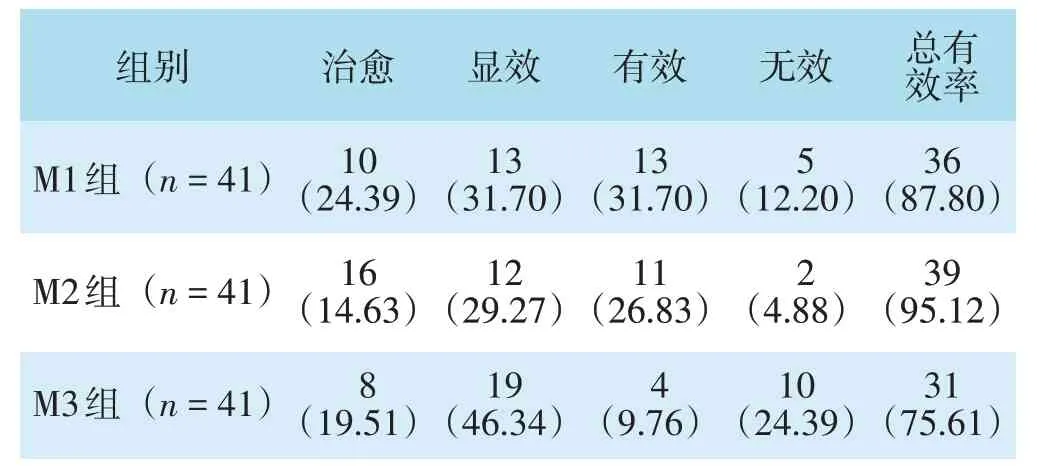
表1 三组临床治疗效果评价比较[n(%)]
2.2 血清炎症因子水平
治疗前,三组血清炎症因子水平比较,差异均无统计学意义(F=0.084、0.213、1.004,P=0.431、0.818、0.369);治疗后,三组TNF-α、CRP、IL-1水平比较,差异均有统计学意义(F=11.772、80.086、15.408,均P<0.001)。治疗后,M2组血清TNF-α、CRP、IL-1水平低于M3组,差异均有统计学意义(均P<0.001);M2组血清CRP、IL-1水平低于M1组,差异均有统计学意义(P<0.001、P=0.016);M1组血清TNF-α、CRP、IL-1水平低于M3组,差异均有统计学意义(P<0.001、P<0.001、P=0.002)。见表2。
2.3 肠黏膜损伤、出血情况
治疗前,三组Mayo评分及Baron内镜评分比较,差异均无统计学意义(F=0.219、1.517,P=0.803、0.224)。治疗后,三组患者Mayo评分及Baron评分比较,差异均有统计学意义(F=26.426、8.537,均P<0.001);M2组Mayo评分、Baron评分低于M3组,差异均有统计学意义(均P<0.001);M1组Mayo评分、Baron评分低于M3组,差异均有统计学意义(P<0.001、P=0.002)。M2组Mayo评分低于M1组,差异有统计学意义(P=0.043),两组Baron评分比较差异无统计学意义(P=0.448)。见表3。
2.4 不良反应发生情况
三组治疗期间均有患者出现头痛、恶心等一过性不良反应,不良反应在治疗期间均自行消失,三组不良反应总发生率比较,差异有统计学意义(χ2=7.306,P=0.026)。M2组不良反应总发生率低于M3组,差异有统计学意义(χ2=6.613,P=0.010)。M1组、M2组不良反应总发生率比较,差异无统计学意义(χ2=0.823,P=0.364),M1组、M3组不良反应总发生率比较,差异无统计学意义(χ2=2.961,P=0.085)。见表4。

表2 三组血清炎症因子水平比较(xˉ±s)
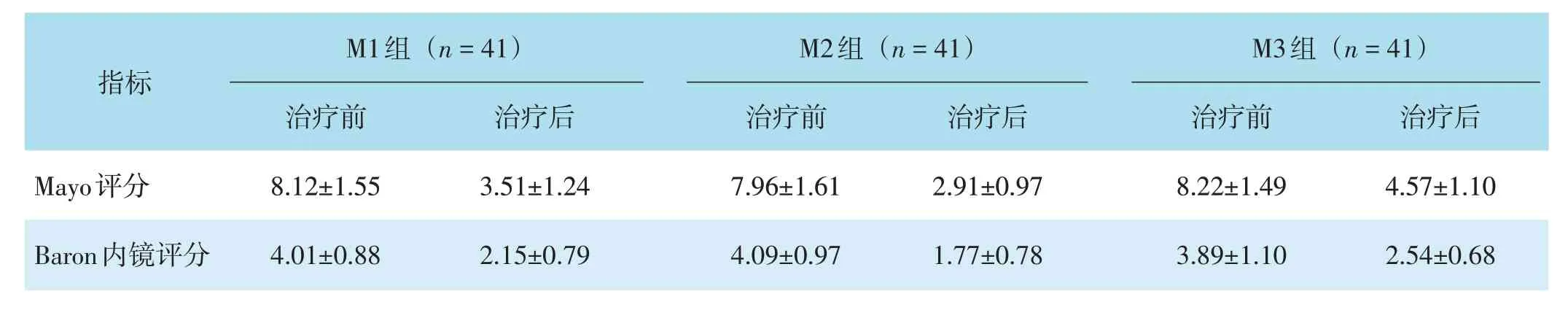
表3 三组Mayo评分及Baron内镜评分比较(分,xˉ±s)
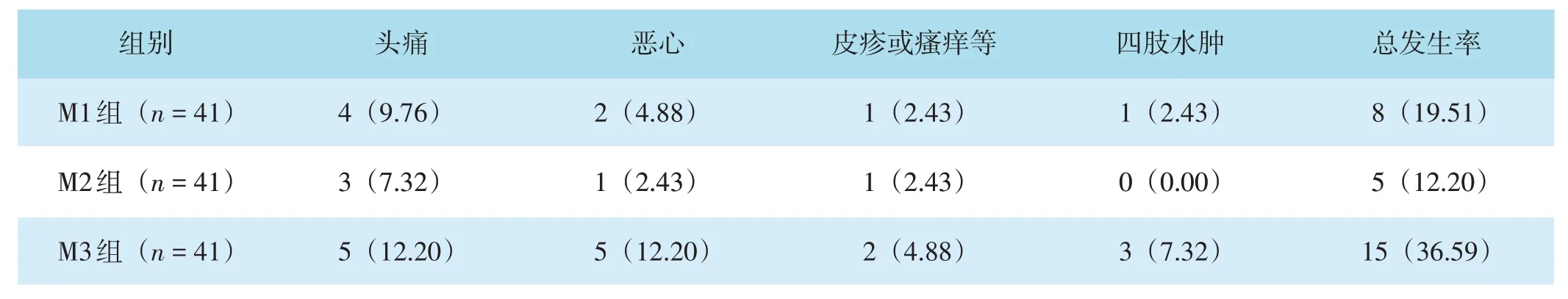
表4 三组不良反应发生情况比较[n(%)]
3 讨论
现有的研究资料显示UC发病与遗传、免疫、环境等多种因素有关,疗程长,且病情容易反复[12-13]。柳氮磺吡啶是临床治疗UC的常用药物,主要通过抑制炎症介质释放控制肠道炎症,但柳氮磺吡啶使用后多出现头痛、恶心呕吐、过敏等不良反应[14]。在本次研究中,M3组患者应用柳氮磺吡啶治疗出现5例头痛、5例恶心呕吐及2例过敏(主要表现为皮疹),不良反应在治疗初始1~2 d内开始出现,3 d后自行消失。有研究认为[15],柳氮磺吡啶中的磺胺吡啶是引起不良反应的主要原因。美沙拉嗪不含磺胺吡啶,其抗炎的有效成分为5-氨基水杨酸(5-ASA)[16],通过抑制前列腺素及炎性介质白三烯的合成减轻肠壁炎症反应。UC患者肠道黏膜PGE2、白三烯较正常人升高[17],美沙拉嗪可通过抑制前列腺素的合成及抑制iNOS活性达到治疗UC的目的[18-20]。
美沙拉嗪的用药方式主要包括口服、保留灌肠及栓剂塞肛等,口服可出现消化道不适或诱发肝损伤等风险[21],保留灌肠及栓剂塞肛可使美沙拉嗪有效成分直接作用于病变局部,改善局部黏膜微循环,延长了药物局部作用时间,可一定程度加快UC肠黏膜修复,减少全身毒性,但保留灌肠及栓剂塞肛药物价格相对较高,不适合在更大范围内推广。本次研究M2组将每日一半剂量(以M1组为参照)的美沙拉嗪研末以温水灌肠,结果显示,与M3组比较,治疗总有效率更高、不良反应总发生率更低、血清炎性因子水平更低、Mayo评分及Baron评分更低,提示了美沙拉嗪口服+灌肠治疗相比于柳氮磺吡啶口服的优势;此外,M2组与M1组相比,前者部分血清炎性因子水平更低、Mayo评分更低,提示美沙拉嗪口服+灌肠治疗相比于单用口服治疗在相当的治疗总有效率及未增加不良反应总发生率的前提下,更有助于减轻炎症反应、改善肠黏膜状况。但因实验条件及人力资源限制,所得结果仍有待多中心、更大样本的研究支持。
综上所述,美沙拉嗪小剂量多次口服联合灌肠给药方式治疗轻-中型急性溃疡性结肠炎疗效确切,安全性良好,相比于单用口服治疗更有助于降低血清CRP、IL-1水平及改善肠黏膜状况。

