桑脉带相关病毒RTLAMP检测方法的建立
吴凡 李杨秀 黄海娟 陈保善 蒙姣荣


摘要桑脉带相关病毒Mulberry vein bandingassociated virus (MVBaV)是广西桑树病毒病的主要病原病毒。本研究根据MVBaV基因组的核外壳蛋白(nucleocapsid protein, N)基因序列设计了5组引物,筛选获得了1组有效引物,建立了该病毒的反转录环介导等温扩增技术(reverse transcription loopmediated isothermal amplification, RTLAMP)检测方法。该方法能在恒温条件(63℃)下1 h内检测MVBaV,其灵敏度是RTPCR检测方法的10倍。对6个田间样品进行RTLAMP检测,其结果与RTPCR的结果一致。该方法可直接在反应管中加入SYBR GreenⅠ,通过颜色变化即可判定结果,无需经过琼脂糖电泳或专门仪器,具有灵敏、快速和特异性好的优点,可应用于MVBaV 的快速诊断及其田间监测。
关键词桑脉带相关病毒;反转录环介导等温扩增技术;检测方法
中图分类号:S 888.71
文献标识码:A
DOI:10.16688/j.zwbh.2018063
桑树病毒病是桑园常见的一类病害,在广西桑蚕区发生严重,发生率为40%左右,是广西桑树的主要病害之一,严重影响广西桑蚕业的发展[12]。桑脉带相关病毒Mulberry vein bandingassociated virus(MVBaV)是番茄斑萎病毒属Tospovirus成员,是广西桑树病毒病主要病原病毒[34]。病毒检测在了解病毒分布、病害发生规律及品种抗性评估中均具有重要意义,是病害预防与防治研究的重要基础[5]。目前尚未有针对MVBaV检测方法进行系统研究的报道。
植物病原物的检测方法主要有酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)、PCR技术、小RNA深度测序以及环介导等温扩增技术(loopmediated isothermal amplification, LAMP)等[58]。ELISA检测需要制备高质量的病毒血清,且检测时间长,灵敏度低[7]; PCR技术以及小RNA深度测序等具有灵敏度高的优点[67],但是需要购买专门的仪器,且费用昂贵。LAMP技术则可以恒温条件下对靶基因进行扩增,反应结束后加入荧光染料即可观察到结果,具有检测速度快、灵敏度高和无需专业仪器等优点[89]。RTLAMP检测是在LAMP检测的基础上加入反转录酶,在同一温度条件下实现反转录及核酸扩增[10]。多数的植物病毒是RNA病毒,RTLAMP已被广泛应用于植物病毒病的诊断与病毒检测[1015]。本研究依据MVBaV基因组N基因的序列,设计、筛选该病毒RTLAMP检测体系的特异引物,评估其特异性及灵敏性,并进行田间样品检测应用,以期为桑脉带病毒病的早期诊断、预测预报及防控决策等提供方便、快捷的检测技术。
1材料与方法
1.1材料
具有典型脉带症状的桑脉带病毒病样品采集于广西忻城县并移栽种植于广西大学桑园, 疑似MVBaV感染样品及健康桑叶样品采集自广西大学桑园;番茄环纹斑点病毒Tomato zonate spot virus (TZSV)侵染的烟草样品采自广西靖西烟田、朱顶红褪绿环斑病毒Hippeastrum chlorotic ringspot virus (HCRV)侵染的水鬼蕉,采自广西大学校园。以上样品均经过RTPCR检测验证,置于-80℃冰箱保存。携带N基因的质粒SXCSY17由亚热带农业生物资源保护与利用国家重点实验室构建并保存[3]。
Loopamp脱氧核糖核酸扩增试剂盒、核糖核酸扩增试剂盒购自荣研生物科技(中国)有限公司。Bst DNA polymerase、硫酸镁由New England Biolabs公司生产;AMV逆转录酶购自Promega公司;RNA提取试剂盒购自天根生化科技(北京)有限公司;SYBR Green Ⅰ (10 000 ×) 购自上海索莱宝生物科技有限公司;一步法 RTPCR Kit购自诺唯赞生物科技有限公司。
1.2方法
1.2.1引物设计
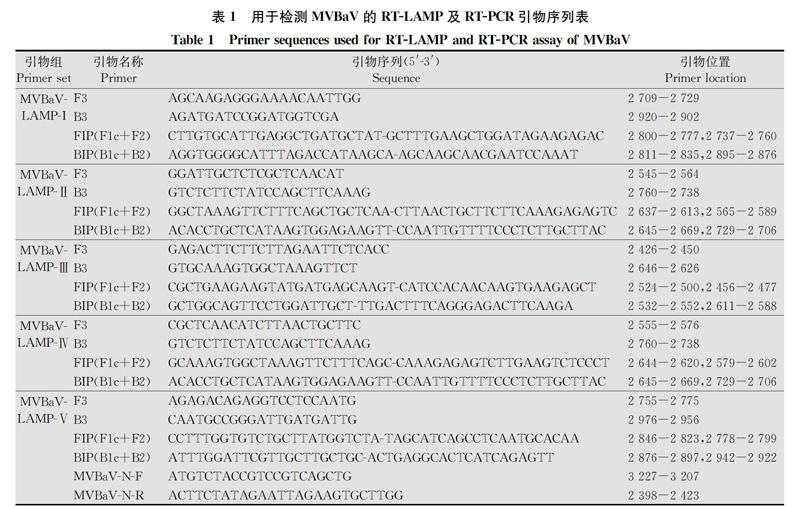
依据MVBaV的N基因序列(KM819701.1)[3],利用LAMP在线引物设计网页Primer Explorer V4 (http:∥primerexplorer.jp/elamp4.0.0/index.html),设计5组LAMP引物,同时设计一对引物MVBaVNF和MVBaVNR特异扩增N基因,用于MVBaV RTPCR检测,该引物目的片段大小为800 bp。所有引物序列见表1,由北京奥科鼎盛生物合成。
1.2.2总RNA的提取
参照天根生化科技(北京)有限公司总RNA提取试剂盒说明书分别提取所有植物样品的总RNA,分别用于MVBaV的RTPCR扩增和RTLAMP检测。
1.2.3MVBaV的RTPCR檢测
参照诺唯赞生物科技有限公司的一步法RTPCR试剂盒说明书进行操作。反应体系50.0 μL,依次加入2×One Step Mix 25.0 μL,One Step Enzyme Mix 2.5 μL,MVBaVNF、MVBaVNR 各1.0 μL(浓度为10.0 μmol/L),模板总RNA 1.0 μL,加水至50.0 μL。反应条件为:50℃反转录30 min;94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸55 s,35个循环;72℃终延伸7 min。取1.0 μL产物进行1%琼脂糖凝胶电泳检测。
1.2.4MVaBV的LAMP及RTLAMP反应体系
LAMP反应体系为25.0 μL:2×反应缓冲液(RM)12.5 μL,酶溶液(EM)1.0 μL,FIP、BIP各2.0 μL(浓度为20.0 μmol/L),F3、B3各0.5 μL(浓度为20.0 μmol/L),质粒DNA模板(质粒SXCSY17, 浓度10 ng/μL)1.0 μL,去离子水补足25.0 μL。63℃反应60 min,80℃ 5 min。反应结束,取1.0 μL产物进行2%琼脂糖凝胶电泳检测。LAMP反应体系用于筛选LAMP检测引物组。
RTLAMP反应体系25.0 μL:Bst DNA polymerase 1.0 μL,10 ×Bst Buffer 2.5 μL,MgSO4 1.5 μL,Betaine 1.0 μL(1.0 mol/L),AMV 1.0 μL,RNase Inhibitor 1.0 μL,FIP、BIP各2.0 μL(浓度为20.0 μmol/L),F3、B3各0.5 μL(浓度为20.0 μmol/L),dNTPs 3.5 μL(10 mmol/L),总RNA模板,加RNase Free H2O至25.0 μL,充分混匀。63℃反应60 min,80℃灭活5 min。反应结束,取1.0 μL产物进行2%琼脂糖凝胶电泳,同时向RTLAMP产物中加入2.0 μL SYBR Green Ⅰ(稀释10倍),直接观察,绿色为阳性,橙色為阴性。
1.2.5RTLAMP特异性和灵敏度测定
提取TZSV和HCRV阳性样品的总RNA,使用本研究筛选获得的RTLAMP引物按照“1.2.4”的反应体系进行RTLAMP检测,评估引物特异性;提取感染桑脉带病毒病并且已经显症的桑叶样品总RNA,并将总RNA进行10倍梯度稀释,共设10.0 ng/μL、1.0 ng/μL、100.0 pg/μL、10.0 pg/μL、1.0 pg/μL、100.0 fg/μL和10.0 fg/μL共7个梯度,分别按照“1.2.3”进行RTPCR检测和“1.2.4”进行RTLAMP检测,通过比较其最低检测量评估灵敏度。
1.2.6MVBaV病株的检测
提取田间采集的MVBaV病株或疑似病株的总RNA,分别按照“1.2.3”进行RTPCR检测和“1.2.4”进行RTLAMP检测。
2结果与分析
2.1引物筛选及RTLAMP体系的建立
使用所设计的5组候选引物组(表1),以携带MVBaVN基因重组质粒SXCSY17为模板,在63℃恒温条件下LAMP反应。LAMP产物经2.0%琼脂糖凝胶电泳检测,结果显示,第Ⅴ组引物组的反应产物可见典型的LAMP反应阶梯状条带,而第Ⅰ~Ⅳ组引物组的反应产物除了一些疑似模板DNA的条带,没有可见阶梯状条带(图1)。因此选择第Ⅴ组引物组进行下一步的RTLAMP检测。
分别以感染MVBaV的桑叶及健康桑叶(均经过RTPCR方法确认)的总RNA为模板,利用第Ⅴ组引物组,63℃恒温条件下进行RTLAMP反应1 h,80℃处理5 min终止反应,向RTLAMP反应液中加入SYBR Green Ⅰ,阳性样品变成绿色,阴性样品为橙色(图2)。
2.2RTLAMP检测方法的特异性
以MVBaV阳性样品为对照,对TZSV、HCRV阳性样品进行RTLAMP检测。结果显示,只有MVBaV阳性样品为绿色,TZSV与HCRV阳性样品为橙色(图3),RTLAMP仅检测出目标MVBaV,不能检测出TZSV和HCRV,表明MVBaV的RTLAMP引物具有较强的特异性。
2.3RTLAMP检测方法的灵敏度
提取MVBaV感染的桑病叶组织总RNA,使用微量分光光度计测定其浓度并按照10倍比例稀释,共设7个梯度,分别进行RTLAMP检测和RTPCR检测。结果显示,使用RTLAMP方法检测,当模板含量为100 fg时,反应液呈绿色(阳性反应),电泳时条带清晰可见(图4a~b);使用RTPCR方法检测,采用1%的琼脂糖凝胶电泳检测RTPCR扩增产物,当模板含量为1 pg时,扩增条带较弱;当模板含量为100 fg时,已无明显的可见特性条带(图4c)。RTLAMP检测方法比RTPCR检测方法的灵敏度高10倍。
2.4MVBaV RTLAMP检测方法的应用
采用RTLAMP对6份田间样品进行检测。结果显示,1、3、5、6号样品显示为绿色,表明这4个样品中带有MVBaV(图5a),2、4号样品显示为橙色,表明这2个样品中没有MVBaV。进一步RTPCR进行验证,其结果显示1、3、5、6号样品可扩增出约800 bp的特异性条带(图5b),2、4号样品无可见条带,与RTLAMP结果一致。值得一提的是,3号样品为无明显症状的隐症样品,说明RTLAMP方法检测到隐症样品中的目标病毒。
3讨论
本研究以MVBaV N基因为靶标,建立了该病毒的RTLAMP 检测技术,该技术可以直接检测桑叶中的MVBaV,可用于桑脉带病毒病的快速诊断及MVBaV检测。桑树病毒病在田间具有花叶状、环斑状和畸形等多种症状表现,是由多种病毒引起的病害类群[2,16]。国际分类委员会网站及其历年的病毒报告中记录的侵染桑树的病毒有桑潜隐病毒和桑环斑病毒[17]。近年来,随着小RNA深度测序技术的应用,在桑树病毒病样品中发现了番茄斑萎病毒属Tospovirus[4]、双生病毒属Geminiviruses[18]、杆状DNA病毒属Badnavirus[19]和线虫传多面体病毒属Nepovirus[20]等多种病毒。桑树病毒病的诊断依据主要是病害症状。由于多数病毒的田间症状常受不同气候条件、品种、栽培条件的影响,症状复杂多变,而且不同的病毒也有可能引起相同或相似的症状,易造成误诊。本研究建立的MVBaV RTLAMP 检测技术在反应完成后可以依据颜色变化直接判断检测结果,不需要对产物进行电泳,具有检测时间短、操作简便等优点,可为科研单位及生产单位检测MVBaV提供技术支持。MVBaV引起的桑脉带病毒病存在高温隐症现象[23],也给该病害的诊断和无毒苗木的调运带来一定的困难。本研究建立的RTLAMP 检测方法不仅适用显症样品中病毒的检测,对隐症样品的快速检测同样有效,在无毒种苗生产中也有重要实用价值。
参考文献
[1]张璐,朱丽玲,潘瑞兰,等.利用酵母双杂交系统研究桑脉带相关病毒核外壳蛋白自身相互作用[J].基因组学与应用生物学,2015,34(11):24282435.
[2]邱长玉,朱方容,林强.桑树花叶病的研究进展[J].广西蚕业,2011(2):3237.
[3]MENG Jiaorong, LIU Pingping, ZHU Liling, et al. Complete genome sequence of mulberry vein banding associated virus, a new tospovirus infecting mulberry [J/OL]. PLoS ONE, 2015, 10(8): e0136196.
[4]MENG Jiaorong, LIU Pingping, ZOU Chengwu, et al. First report of a tospovirus in mulberry [J]. Plant Disease, 2013, 97(7): 1001.
[5]陶源, 吳兴泉. 植物病毒检测方法的研究进展[J]. 分子植物育种, 2017, 15(7): 29012906.
[6]FANG Y, RAMASAMY R P. Current and prospective methods for plant disease detection[J]. Biosensors, 2015, 5(3): 537561.
[7]BOONHAM N, KREUZE J, WINTER S, et al. Methods in virus diagnostics: from ELISA to next generation sequencing[J]. Virus Research, 2014, 186: 2031.
[8]WARD L I, HARPER S J. Loopmediated isothermal amplification for the detection of plant pathogens [M]∥SUCHER N J, HENNELL J R, CARLES M C. Plant DNA Fingerprinting and Barcoding: Methods and Protocols.New York: Humana Press, 2012: 161170.
[9]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loopmediated isothermal amplification of DNA[J/OL]. Nucleic Acids Research, 2000, 28(12): e63.
[10]WU Xinghai, CHEN Chanfa, XIAO Xizhi, et al. Development of reverse transcription thermostable helicasedependent DNA amplification for the detection of tomato spotted wilt virus [J]. Journal of AOAC International, 2016, 99(6): 15961599.
[11]张永江, 辛言言, 李桂芬, 等. 葡萄A病毒RTLAMP检测方法的建立[J].中国农业科学, 2016, 49(1): 103109.
[12]汤亚飞, 何自福, 佘小漫, 等. 辣椒黄脉病毒RTLAMP快速检测方法的建立[J].植物保护, 2016, 42(6): 100104.
[13]陈柳, 尚巧霞, 陈笑瑜, 等. 草莓轻型黄边病毒RTLAMP检测方法的建立[J].中国农业科学, 2015, 48(3): 613620.
[14]陈先锋,张吉红,崔俊霞,等.南芥菜花叶病毒的RTLAMP检测试剂盒的研制[J].植物保护学报,2013,40(2):189190.
[15]郭木金,廖富荣, 陈青, 等. 豇豆重花叶病毒RTLAMP检测方法的建立[J].植物保护, 2012, 38(1): 123127.
[16]蒯元璋. 桑树病毒与病毒病的研究进展(Ⅰ)[J].蚕业科学, 2010(5): 818825.
[17]陈明胜, 吴福安. 桑花叶病研究的现状与对策[J].中国蚕业, 2009(2): 2023.
[18]MA Yuxin, NAVARRO B, ZHANG Zhixiang, et al. Identification and molecular characterization of a novel monopartite geminivirus associated with mulberry mosaic dwarf disease [J].The Journal of General Virology,2015,96(8):24212434.
[19]CHIUMENTI M, MORELLI M, DE STRADIS A, et al. Unusual genomic features of a badnavirus infecting mulberry [J]. The Journal of General Virology, 2016, 97(11): 30733087.
[20]LU Quanyou, WU Zujian, XIA Zhisong, et al. A new nepovirus identified in mulberry (Morus alba L.) in China [J]. Archives of Virology, 2015, 160(3): 851855.
(责任编辑:田喆)

