棉铃虫作为单核细胞增生李斯特菌感染模型的初步研究
杨丽玉, 刘婵娟, 杨诗怡, 王菁妍, 罗 勤
(华中师范大学 生命科学学院 遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
单核细胞增生李斯特菌(Listeriamonocytogenes,以下简称Lm)是一种人畜共患的革兰阳性致病菌,可以穿透人体的三大屏障—道屏障、血脑屏障和胎盘屏障[1],造成人体感染,严重的可导致败血症、脑膜炎、流产,死亡率达20%~30%,曾被世界卫生组织(WHO)列为21世纪四大食源性致病菌之一[2-3]。因此,充分利用各种模型系统,深入研究Lm致病机制将为预防和治疗李斯特菌病提供重要的理论和实践基础。Lm致病能力的高低与其毒力基因的表达调控密切相关,由prfA、hly、plcA、actA、mpl和plcB组成的Lm毒力基因岛,在Lm发挥致病作用中起着至关重要的作用[1]。毒力基因岛上基因的表达均直接或间接地受PrfA的调控。PrfA蛋白由prfA基因编码,缺失prfA将会导致Lm致病能力的极大降低。PrfA属于转录活化因子Crp/Fnr家族中的一员[4]。研究发现,当PrfA蛋白的第145位甘氨酸突变为丝氨酸时就会导致该蛋白组成型表达(通常以PrfA*表示)。由于这种组成型表达蛋白不受环境因素变化的影响而一直处于高量表达状态,导致携带有PrfA*菌株的毒力高于其他菌株[5],因此PrfA*常被用作检验和比较李斯特菌对宿主致病能力的参照。近年来,由于昆虫的操作便利性、培养的低成本以及道德上的可接受性等特点,特别是其虽只具有天然免疫系统,但与哺乳动物在进化上的保守性,利用适宜的昆虫作为研究人类疾病致病机制的模型系统已被广为接受。Mansfield等[6]在2003年已报道了利用黑腹果蝇作为探索Lm致病机制以及宿主对Lm免疫反应的模式生物;2010年Mukherjee等[7]发现不同毒力的Lm在侵染大蜡螟幼虫后,可造成幼虫不同程度的损伤和死亡。而且,大蜡螟可在37 ℃下生长和繁殖,此温度条件对于模拟Lm侵染人体后毒力因子的表达是最为适宜的温度[8-9]。尽管如此,大蜡螟作为研究人类病原菌致病机制的模型系统仍有一些不足。首先,大蜡螟全基因组序列尚未公布,这对于研究病原菌与宿主的互相作用存在较大的限制;其次,已报道的文献中大多数是选择大蜡螟幼虫最后一个龄期注射病原菌,该龄期幼虫虫体一般长约20 mm,重约250 mg,大小适合人工注射和采集虫体组织用于免疫组化等研究[7],但最后一期幼虫面临变态成蛹,注射培养几天后的病理反应往往受到变态反应的干扰,尤其是观察幼虫中肠细胞的形态时,遇到的问题最为突出。棉铃虫(Helicoverpaarmigera(Hübner))广泛分布在中国及世界各地,是棉花蕾铃期重要的钻蛀性害虫[10]。棉铃虫和大蜡螟一样,同属于鳞翅目,但棉铃虫相较于大蜡螟,不仅各虫态经历的时间短(棉铃虫完成一个世代所需时间大约是大蜡螟的一半),而且幼虫形体较大。棉铃虫4龄幼虫的长度(20~23 mm)和体重(180~230 mg)已达到大蜡螟幼虫最后一个龄期的长度和体重,不但便于精准注射,而且易于收集虫体内血淋巴、脂肪体和一些其他组织。同时,由于4龄棉铃虫不是最后一个龄期,在观察虫体中肠细胞的病理变化时,不容易受到变态反应的干扰,对病原菌的侵染也较为敏感。更为欣喜的是,棉铃虫的全基因组序列已在2017年公布[11]。但迄今为止,尚未有棉铃虫作为研究人类病原菌致病机制的模型系统的文献报道。因此,本研究探索利用容易获取、饲养方便且能在短时间内获取结果的棉铃虫4龄幼虫作为探究Lm致病机制的昆虫模型,以期为进一步研究Lm与宿主的相互作用机制提供参考。本研究用Lm野生株(EGDe,中毒)和PrfA缺失株(EGDeΔprfA,弱毒)、以及PrfA组成型高表达株(EGDeΔprfA+pERL3-prfA*,高毒)注射棉铃虫4龄幼虫,通过检测不同毒力的Lm菌株对棉铃虫幼虫的半数致死量、全虫及体内不同部分(肠道、血淋巴、体液)的载菌量,观察棉铃虫中肠病理变化,以及感染不同毒力的Lm对血细胞包囊作用和数目的影响,探究棉铃虫是否适合作为研究Lm致病机制的昆虫模型。
1 材料与方法
1.1 材料
1.1.1 菌株和昆虫 选用个体大小一致、生长发育同步的4龄棉铃虫幼虫(购自河南科云生物科技有限公司)。在温度(27±1) ℃,相对湿度(RH)65%~75%,光周期14 L∶10 D条件下饲养[12]。所用菌株EGDe和质粒pERL3为德国维尔茨堡大学Werner Gobel教授惠赠,EGDeΔprfA和EGDeΔprfA+pERL3-prfA*为本实验室构建和保存。
1.1.2 主要试剂 BHI(Brain Heart Infusion,购自B&D 公司);苦味酸混合固定液(购自湖北百奥斯生物科技有限公司);Sephadex DEAE A-25色谱珠(购自Biosharp);抗凝剂:NaCl(国药)1.81 g、柠檬酸钠(国药)4.41 g、葡萄糖(Sigma)9.9 g、柠檬酸(国药)2.73 g、EDTA(武汉飞扬生物)1.86 g,加入蒸馏水500 mL定容;李斯特菌显色培养基(购自青岛海博生物技术有限公司);引物由天一辉远生物科技有限公司(武汉)合成。
1.1.3 仪器与设备 六孔板(6孔,购自无锡耐思生物科技有限公司);人工气候箱(HP300GS-C,购自武汉瑞华仪器设备有限责任公司);倒置显微镜(COIC XDS-1B,购自重庆光电仪器有限公司);微量进样器(10 μL,购自上海高鸽工贸有限公司);解剖镜(SOPTOP,购自宁波舜宇仪器有限公司);本研究病理切片由湖北百奥斯生物科技有限公司制作。
1.2 方法
1.2.1 不同毒力Lm生长曲线及生长形态的测定 将待测菌株过夜活化,次日按照1∶100转接入新鲜的BHI培养基中,混匀后测定菌液在600 nm处的吸光度值(OD600),记为0 h的值,180 r/min震荡培养,每隔1 h检测菌液OD600的变化,直到细菌生长至稳定期。与此同时,在指定时期取0.1 mL菌液适当稀释后涂布平板,37 ℃倒置培养24 h后拍照并计数。以上实验至少进行3次生物学重复。
1.2.2 棉铃虫半数致死量LD50的测定 选取生理状态基本一致的4龄棉铃虫幼虫置于冰上麻醉2 h待用。培养至108cfu/ml时,用BHI进行5倍梯度稀释,稀释为5个浓度(50、51、52、53、54倍)后,用微量进样器分别吸取稀释后的菌液5 μL,自棉铃虫第一腹足注入。每个浓度各注射18条棉铃虫,以注射5 μL BHI的棉铃虫为对照。注射后的棉铃虫幼虫置于六孔板中,放入人工气候培养箱中继续饲养。分别在24、48和72 h统计棉铃虫幼虫的死亡数量(幼虫在触摸时无任何反应时被认为已死亡),计算死亡率,按照周一平[13]的方法,采用SPSS17.0软件计算细菌对棉铃虫的半数致死量LD50。
1.2.3 棉铃虫中肠病理切片的制备和观察 选取感染症状明显的棉铃虫幼虫,用无菌剪刀剪开第三头足到第四腹足部分,取出中肠,用苦味酸混合固定液充分固定24 h后水洗。经过脱水、浸蜡、包埋一系列工序后,进行切片、展片、捞片、烤片和脱蜡,最后进行HE(苏木精-伊红染色法,Hematoxylin-Eosin staining)染色。所得病理切片置于倒置显微镜下观察(10×和40×),拍照记录。
1.2.4 单核细胞增生李斯特菌对棉铃虫血细胞包囊作用的影响 参照Ling等[14]的方法进行体内包囊测定。Sephadex DEAE A-25色谱珠用作包囊目标。为了便于观测珠子在虫体的包囊程度,色谱珠事先用0.1%刚果红染色2 h,UV光下干燥后,重悬于0.1 mol/L PBS溶液待用。生理状态基本一致的4龄棉铃虫幼虫经注射不同毒力的Lm或者BHI(如1.2.2所述处理)48 h后,从每组处理中选取18只幼虫,并使用微量注射器将约30个珠子注射到每个幼虫体腔中,12 h后解剖幼虫,解剖镜下观察凝胶珠的包囊程度,拍照记录。以上实验至少进行3次生物学重复。
1.2.5 血细胞计数 分别对4龄棉铃虫幼虫在感染Lm后的24、48和72 h时进行采血:剪去被感染棉铃虫幼虫一对腹足,取血淋巴10 μL,加入90 μL抗凝剂混匀后,置于血球计数板,显微镜下观察计数。每次随机选取被感染棉铃虫3头,重复3次取平均值,以注射BHI的棉铃虫为对照,方法相同。
1.2.6 棉铃虫全虫及体内不同部分(肠道、血淋巴、体液)载菌量的测定 将感染Lm后的棉铃虫体表消毒后,无菌获取棉铃虫全虫或者体内不同部分(肠道、血淋巴、体液),在装有1 mL BHI的离心管中充分剪碎碾匀,用10 μm滤器过滤去除大的碎片和组织后,取10 μL滤液于李斯特菌显色培养基进行平板涂布,37 ℃倒置培养24 h后计数统计。实验重复3次。
2 结果与分析
2.1 单核细胞增生李斯特菌的生长曲线及菌落大小
为了保持细菌在注射棉铃虫时的初始浓度一致,对所用的3株Lm菌株(Lm野生株EGDe、PrfA缺失株EGDeΔprfA以及PrfA组成型高表达株(EGDeΔprfA+pERL3-prfA*))进行了生长曲线的测定。如图1所示,在营养丰富的BHI培养基中,野生型EGDe生长最快,EGDeΔprfA次之,PrfA组成型高表达株(EGDeΔprfA+pERL3-prfA*)最慢。为了准确比较这3株细菌的生长状态,参照戴雄风等[15]的方法,检测了EGDe、EGDeΔprfA以及EGDeΔprfA+pERL3-prfA*的对数生长时期的倍增时间,分别为68、71和82 min,与生长曲线的结果相符。进一步比较3株菌在固体BHI平板上的菌落大小,发现在相同培养条件下PrfA组成型高表达菌株(EGDeΔprfA+pERL3-prfA*)的菌落(平均直径0.46 mm)明显比野生株EGDe(0.788 mm)
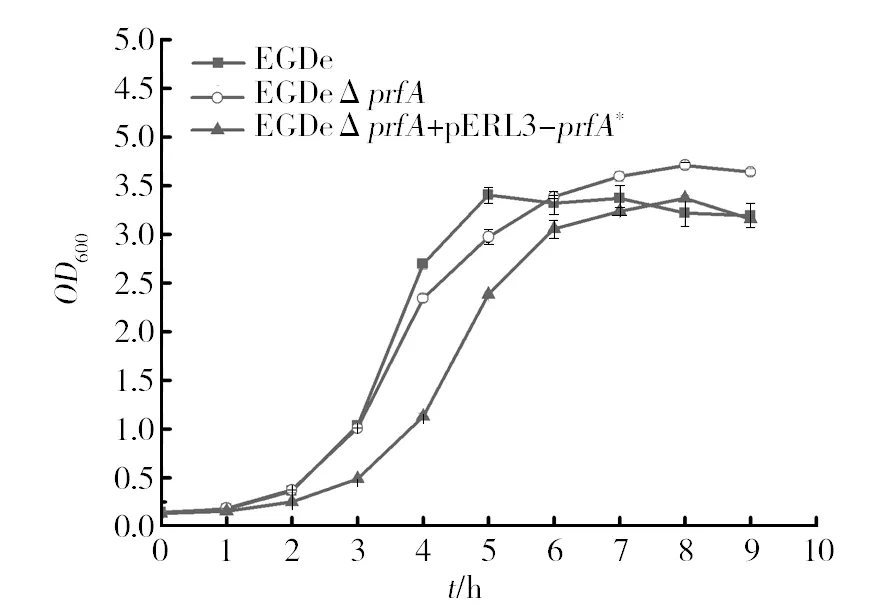
图1 不同毒力Lm在BHI中生长曲线的测定
和PrfA缺失株EGDeΔprfA(0.784 mm)的菌落小,且具有显著性(P﹤0.05)。由此得出,当细菌在营养丰富的培养基中生长时,独立于染色体外的多拷贝质粒pERL3以及所携带基因的高表达可能会影响细菌染色体基因的表达,从而影响细菌的生长速率和菌落大小。该结论与Klumpp等[16]在大肠埃希菌中表达多拷贝质粒pBR322以及外源R1蛋白的结果一致。
2.2 单核细胞增生李斯特菌对4龄棉铃虫幼虫的致病能力
2.2.1 不同毒力单核细胞增生李斯特菌的半数致死量LD50及感染不同毒力单核细胞增生李斯特菌的棉铃虫的致死率 如表1所示,EGDe、EGDeΔprfA以及EGDeΔprfA+pERL3-prfA*对棉铃虫的LD50分别为2.56×103cfu/mL、1.98×106cfu/mL、6.63×102cfu/mL。与野生株EGDe相比,PrfA组成型高表达菌株EGDeΔprfA+pERL3-prfA*有显著性差异(P﹤0.05),PrfA缺失株EGDeΔprfA有极显著差异(P﹤0.01)。
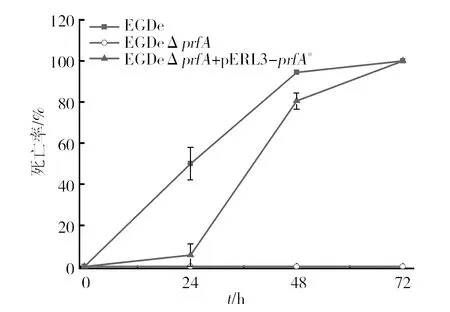
图2 棉铃虫在注射不同毒力Lm后不同时间段的死亡率
当注射细菌量为105cfu/mL的不同毒力的Lm后,如图2所示,在24 h时观察到感染了野生株EGDe的棉铃虫死亡率为50.01%,而感染了高毒株EGDeΔprfA+pERL3-prfA*的棉铃虫的死亡率却低于10%(仅为5.56%),弱毒株EGDeΔprfA(注射量仅为LD50的5/6)几乎不造成棉铃虫死亡;但在之后的24 h(即从注射时开始的24~48 h)内,高毒株EGDeΔprfA+pERL3-prfA*致幼虫的死亡率急速上升,48 h时棉铃虫全部死亡;EGDe对幼虫的死亡率趋于平缓,为94.4%,72 h致棉铃虫100%死亡,而弱毒株EGDeΔprfA在此时间内致棉铃虫死亡率几乎为零。

表1 EGDe、EGDeΔprfA以及EGDeΔprfA+pERL3-prfA*对棉铃虫的半数致死量(LD50)
注:a、b分别表示与野生株(EGDe)相比,在同一时间内,其他菌株对棉铃虫半数致死量(LD50)的显著差异性,a:P﹤0.05,b:P﹤0.01
2.2.2 感染单核细胞增生李斯特菌后,棉铃虫全虫及体内不同部分(肠道、血淋巴、体液)的载菌量 4龄棉铃虫幼虫经注射感染不同毒力的Lm后,分别在24 h和48 h选取相同数量的幼虫,进行体表消毒,全虫或者肠道、血淋巴、体液在BHI中充分剪碎碾匀,过滤除去大的碎片和组织,取适量浓度的滤液涂布Lm显色鉴定平板,比较全虫及体内不同部分(肠道、血淋巴、体液)细菌的数量。结果如图3所示,不同毒力Lm注射感染棉铃虫后,24 h时,尽管同一菌株在棉铃虫体内的不同部位,如肠道、血淋巴和体液的载菌量无明显差异,但不同菌株在棉铃虫同一组织的载菌量却存在较大差别。其中,野生株EGDe的数量最高,达到了3.4×107cfu/mL(全虫),显著高于其他菌株在体内的活菌数,而弱毒株EGDeΔprfA的数量最低,为3.36×103cfu/mL。该结果与注射细菌后棉铃虫在24 h的死亡率(图2)相符。结合各个菌株的生长曲线(图1)和对数期的倍增时间,对于野生株EGDe在感染24 h内表现出的较高毒力,认为由于野生株EGDe在虫体内繁殖速度最快,从而相对于染色体上缺失了prfA的高毒株(EGDeΔprfA+pERL3-prfA*),表达了更多的毒力蛋白。48 h时,野生株EGDe和高毒株(EGDeΔprfA+pERL3-prfA*)在棉铃虫体内各部分的载菌量均有所上升,其中体液中的载菌量增加最为明显,其次为肠道;而EGDeΔprfA在棉铃虫各部分的载菌量却随时间推移不断降低,48 h时,全虫的载菌量仅为注射量的1/100左右,暗示了棉铃虫的天然免疫系统能够较好地抵抗弱毒株EGDeΔprfA在体内的生长繁殖,而野生株EGDe及其高毒力突变株却能成功突破棉铃虫的防御系统,在虫体内生长繁殖,从而导致幼虫死亡。
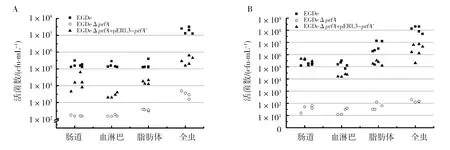
图3 棉铃虫感染不同毒力Lm后全虫及肠道、血淋巴和体液的载菌量
2.2.3 不同毒力单核细胞增生李斯特菌对棉铃虫中肠组织的致病性 4龄棉铃虫幼虫经不同毒力Lm感染后,定时取中肠组织染色,制备病理切片。如图4 A和B所示:注射BHI的空白对照组中肠肠壁形态完整,肠道上皮细胞(EC)排列紧密,围食膜(PM)及微绒毛(AMP)清晰可见,上皮层与基底膜(BM)紧密接触,这与南宫自艳等[17]的结果一致;注射24 h后,除PrfA缺失株EGDeΔprfA(弱毒)外,其余实验组中肠柱状细胞(GC)已开始伸长变成长椭圆形,围食膜仍然存在,微绒毛开始出现断裂脱落,注射了EGDe的棉铃虫肠道上皮细胞此时已开始出现溶解现象;注射48 h后(图4 C、D),各实验组中肠局部细胞排列紊乱,出现空泡化及溶解现象,同时注射了高毒株(EGDeΔprfA+pERL3-prfA*)和中毒株(EGDe)的棉铃虫中肠细胞微绒毛断裂脱落现象严重,而注射了弱毒株(EGDeΔprfA)的中肠细胞微绒毛清晰可见且较为完整。此外,发现此时感染了高毒株(EGDeΔprfA+pERL3-prfA*)的中肠细胞出现脱落现象,所剩近乎单层细胞,而感染弱毒株(EGDeΔprfA)和中毒株(EGDe)的肠细胞无明显脱落现象;注射72 h后(图4 E、F),除弱毒株外,其余实验组的中肠细胞细胞核(NV)向肠腔扩散,此时感染了高毒株(EGDeΔprfA+pERL3-prfA*)的中肠细胞溶解脱落现象最为严重,细胞形态破坏殆尽,仅能见到残存的围食膜片段。以上结果显示,Lm侵染棉铃虫幼虫后,损害了棉铃虫中肠细胞的结构和形态,其受损程度与Lm毒力高低正相关。
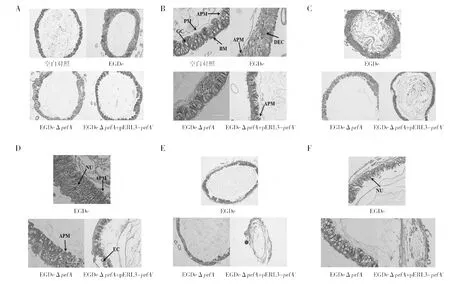
图4 棉铃虫中肠肠道病理切片
2.3 单核细胞增生李斯特菌对棉铃虫血细胞包囊作用和数量的影响
血细胞在昆虫免疫应答中具有重要作用,活化的血细胞可对入侵的病原体进行吞噬、结节和包囊。小的病原体可直接被血细胞吞噬而杀灭,较大的病原体,首先被血细胞包围,形成囊状,然后进行黑化反应被清除。病原体引发的包囊作用取决于募集的血细胞数量和形成包囊的厚度。为了确定Lm感染棉铃虫后引起血细胞的防御反应和血细胞数量的波动情况,用Lm野生株及其突变株(EGDeΔprfA、EGDeΔprfA+pERL3-prfA*)感染棉铃虫,并如上所述(方法1.2.4和1.2.5)感染后72 h内,检测Lm对昆虫血细胞的作用。
2.3.1 单核细胞增生李斯特菌对棉铃虫血细胞包囊作用的影响 棉铃虫在感染Lm 48 h时,微量注射Sephadex DEAE A-25色谱珠入体腔,12 h后,解剖幼虫并在显微镜下观察凝胶珠的包囊程度。如图5所示,与注射BHI培养基的对照组相比,感染了弱毒株(EGDeΔprfA)的棉铃虫血细胞包裹凝胶珠的形态和厚度无明显变化,而其他实验组均有明显的抑制血细胞包囊作用的现象,其中感染了高毒株(EGDeΔprfA+pERL3-prfA*)的凝胶珠外仅有少量血细胞包囊,而感染中毒株(EGDe)的血细胞包囊程度虽然有所减少,但远不及高毒株(EGDeΔprfA+pERL3-prfA*)的减少程度。表明Lm能够抑制棉铃虫血细胞的包囊作用,其抑制程度与细菌毒力正相关。
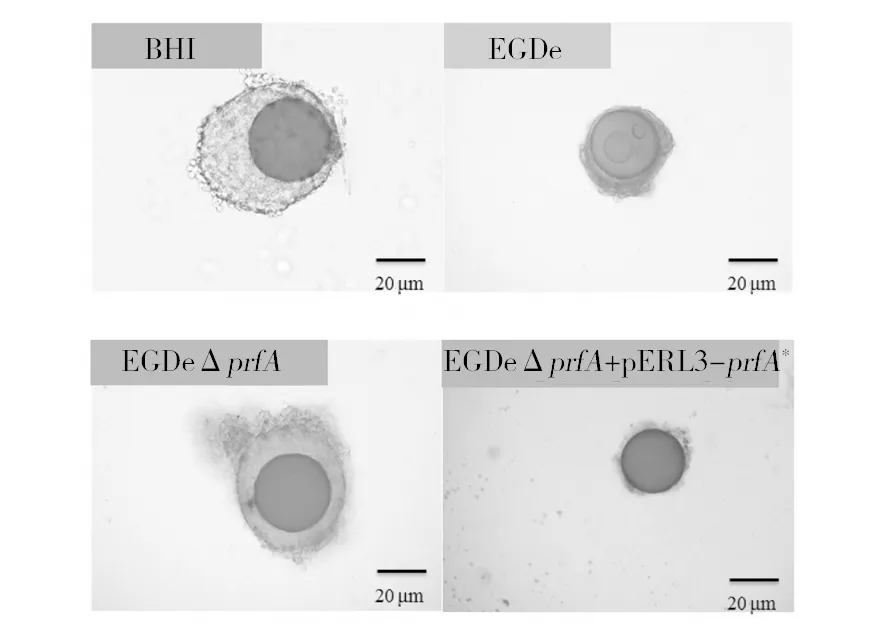
图5 感染不同毒力Lm 48 h后棉铃虫血细胞对凝胶珠的包囊作用
2.3.2 棉铃虫血细胞数量变化 用不同毒力Lm感染棉铃虫后,分别于不同时间(24、48和72 h)进行血细胞计数。结果如图6所示,相较于对照组,各实验组在感染24 h后血细胞数量急剧上升,随后不断减少,在72 h后达到最低;且各实验组72 h血细胞数量均显著低于24 h。相比感染24 h时的血细胞数量,在72 h时,感染中毒株EGDe的棉铃虫血细胞数量减少45%,感染高毒株EGDeΔprfA+pERL3-prfA*的棉铃虫血细胞数量减少71%,只有弱毒株(EGDeΔprfA)感染的棉铃虫保持了较高水平的血细胞数量,仅减少27%。由于棉铃虫的死亡与血细胞数量的破坏呈正相关[18],因此实验结果表明,Lm感染棉铃虫后,不仅导致棉铃虫血细胞数量减少,而且减少的程度与细菌的毒力高低呈正相关。
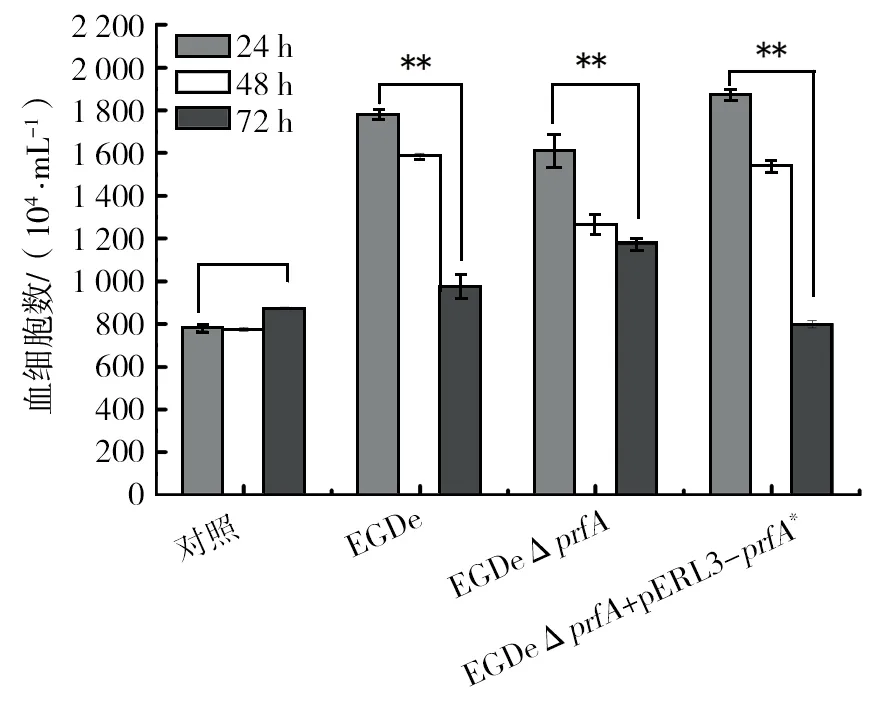
图6 感染不同毒力Lm后棉铃虫血细胞数量变化
3 讨 论
目前已经报道了利用多种模式宿主研究单核细胞增生李斯特菌的致病机制,如小鼠[19]、大蜡螟[7,20]、黑腹果蝇[6,21]和线虫[22]等。每种宿主系统均有其操作的优势,同时也存在一定的限制。因此,不断探索适合自身实际研究工作所需的模式系统是每位科学研究者的重要工作。
棉铃虫具有饲养方便、成本低廉、易于注射操作、实验周期短等优点,已作为模式昆虫广泛用于植物病虫害防治的基础研究,但迄今尚未有应用于人类病原菌研究的报道。本研究利用不同毒力的3株Lm菌注射感染4龄棉铃虫幼虫,比较不同毒力Lm对棉铃虫的致病作用以及所引起的棉铃虫免疫反应。实验结果显示,不同毒力的Lm均能造成棉铃虫死亡。其中,高毒株EGDeΔprfA+pERL3-prfA*对棉铃虫的半数致死量LD50最低,弱毒株EGDeΔprfA的LD50最高,且菌株之间存在显著差异。棉铃虫中肠病理切片结果也显示,不同毒力的Lm均能造成棉铃虫中肠细胞的结构和形态发生病理改变,且其受损程度与Lm毒力高低正相关。虽然野生株EGDe在注射棉铃虫24 h内,造成虫体死亡率显著高于高毒株EGDeΔprfA+pERL3-prfA*和弱毒株EGDeΔprfA,但这种差异并不影响细菌对棉铃虫半数致死量的检测。结合细菌在丰富培养基BHI中的菌落大小和生长速率结果,认为在棉铃虫感染的初期(24 h及以内),由于多拷贝质粒的快速扩增耗费了大量ATP[17],导致携带质粒的高毒株EGDeΔprfA+pERL3-prfA*的生长受到抑制,而野生株EGDe不受质粒影响,在棉铃虫体内的繁殖速率较高,分泌出较多的毒性蛋白,从而导致更多的棉铃虫死亡。弱毒株EGDeΔprfA虽然也没有多拷贝质粒,但由于细菌缺失了主要的毒力调控蛋白PrfA,分泌的毒力因子最少,因此造成棉铃虫的死亡率最低。与此类似,野生株EGDe感染棉铃虫24 h时,全虫、肠、血淋巴及体液的载菌量同样远远多于高毒株EGDeΔprfA+pERL3-prfA*,也可能是因为野生株EGDe较快速的生长繁殖造成的。同理,弱毒株EGDeΔprfA随着感染时间的延长,在棉铃虫体内的活菌数逐渐减少,则可能是因为菌株的致病能力较弱,从而被激活的棉铃虫的免疫系统不断清除而死亡,该结果与不同毒力的Lm对棉铃虫血细胞包囊作用的抑制以及血细胞数量的影响相符,表明Lm能在棉铃虫体内生长繁殖、分泌毒性蛋白、激活棉铃虫的免疫系统产生免疫反应,最终被清除或者导致棉铃虫免疫系统崩溃死亡。Lm对棉铃虫幼虫的致病能力强弱与菌株毒力高低正相关。因此,我们认为棉铃虫幼虫(至少是4龄棉铃虫幼虫)适合作为研究Lm致病机制的宿主模型,且可进一步用于探究天然免疫系统抵御病原菌入侵的机理以及病原菌与宿主的相互作用的基础研究中。尽管如此,该模型仍存在一些限制,主要表现在棉铃虫这种鳞翅目昆虫并不具有像哺乳动物那样完善的获得性免疫防御系统,且其最适温度是28 ℃,而人类病原菌适合在37 ℃下生长,这可能影响某些基因的表达。因此,在运用模型系统研究病原菌的致病机制时,需要考虑这些因素的影响,谨慎分析实验结果。

