BMSCs与VEGF 165-HUVEC局部皮下组织层共移植大鼠缺血皮瓣存活率观察
明华伟,何芸,付光新,李彪,甘升远,邵学垒,夏德林
(1南充市中心医院,四川南充 637000;2西南医科大学口颌面修复重建和再生实验室;3西南医科大学附属口腔医院)
由于恶性肿瘤切除、创伤、严重感染及先天畸形等各种因素所致颌面部组织缺损,给患者身心带来极大的负面影响,这使对创面进行修复以恢复患者的功能及外观显得尤为迫切。皮瓣移植应用于颌面部缺损的修复重建由来已久,其同时具有创面修复、功能重建等重要作用[1]。但有研究[2,3]报道,皮瓣移植术后部分坏死率达11.4%,完全坏死率为4.0%~6.3%;术后一旦出现皮瓣血运障碍、缺血坏死,临床处理会非常棘手[4]。因此,如何提高缺血皮瓣的存活能力是修复重建外科一直以来研究的重点。血管生成是由血管内皮祖细胞原位聚集、增殖分化、发育成血管系统的一个需要多种细胞因子参与的复杂过程[5]。血管内皮生长因子(VEGF)及骨形态发生蛋白(BMP)在成骨及成血管方面发挥极为重要的生物学作用,骨髓基质干细胞(BMSCs)及脐静脉内皮细胞(HUVEC)共培养后,两者分泌的VEGF与BMP之间存在着相互促进、级联放大的作用[6]。VEGF被认为是作用最直接、特异性最高的一种促血管化生长因子,其中VEGF 165在体内含量最为丰富,促血管化作用最强[7~10]。但VEGF在体内半衰期短,局部应用很快被周围组织液稀释。将VEGF 165基因导入HUVEC后再与BMSC共移植,在体内是否能够持续释放VEGF促进缺血皮瓣的血管生成以往鲜有报道。本研究通过制备大鼠背部缺血皮瓣模型,并移植BMSCs、VEGF 165基因修饰的HUVEC(VEGF 165-HUVEC),观察两者共移植对缺血皮瓣存活能力的影响
1 材料与方法
1.1 实验动物 6~8周龄雌性SD大鼠50只,体质量180~200 g;4周龄雄性SD大鼠2只,体质量250~300 g;均由西南医科大学实验动物中心提供。
1.2 HUVECs、pHBAd-MCMV-GFP-VEGF165及试剂、仪器 HUVECs(Sciencell公司);pHBAd-MCMV-GFP-VEGF165(由汉恒生物科技公司包装、构建及鉴定);DMEM培养基、胎牛血清(HyClone公司)、EGM-2(Lonza公司)、血管内皮生长因子抗原、ELISA检测试剂盒、兔抗大鼠CD31抗体(一抗)、羊抗兔IgG(二抗,碧云天生物科技有限公司);倒置相差显微镜(奥林巴斯)。
1.3 BMSCs和HUVEC的培养、计数、定容 全骨髓贴壁培养法培养雄性SD大鼠股骨、胫骨骨髓。当细胞增殖达到90%融合时进行胰酶消化传代,传至第3代后制成单细胞悬液,离心后重悬细胞,计数、定容至1 mL培养液含1×106个BMSCs备用。从液氮容器中取出HUVECs,常规复苏后将按比例接种、传代。传至第3代后制成单细胞悬液,离心后重悬细胞,同样定容至1 mL培养液含1×106个HUVEC备用。
1.4 腺病毒介导VEGF-165基因转染HUVEC第3代HUVEC 在前期体外实验中[11],我们通过VEGF 165-HUVEC的MOI摸索时发现,当MOI=30时为其最佳感染复数,故在本实验中采用MOI=30进行基因转染。参照病毒转染说明书步骤操作,将腺病毒介导携带VEGF 165基因重组pHBAd-MCMV-GFP-VEGF165质粒转染至HUVEC。
1.5 缺血皮瓣模型制备、分组及BMSCs和VEGF 165-HUVEC共移植 SD大鼠经10%水合氯醛0.3 mL/100 g腹腔麻醉,备皮后在大鼠背部设计随意皮瓣(4.0 cm×1.5 cm),并于皮瓣中轴线上等距离处标记三个注射点,锐性分离掀起皮瓣,再对位缝合,术后创口涂布红霉素眼膏,无需敷料包扎。所有动物模型由同一组人员制备,大鼠术后分笼饲养。建模成功(缺血皮瓣制备手术过程顺利,手术探查确认皮瓣无轴心血管,手术过程中及术后取材前未死亡,麻醉苏醒后能正常活动)后所有大鼠随机分为5组各10只,术后即刻在标记点(分别距离皮瓣远蒂端1、2、3 cm处)皮下组织层移植等量细胞5×105个,A组移植BMSCs与VEGF 165-HUVEC(1∶1),B组移植VEGF 165-HUVEC,C组移植BMSCs与HUVEC(1∶1),D组移植HUVEC,E组注射等体积0.9%NaCl溶液。
1.6 皮瓣存活率测算 术后第11天,数码相机对各组皮瓣拍照,采用 Image-Pro Plus 6.0软件分析、计算各组皮瓣存活率(每组10只大鼠),皮瓣存活率(%)=皮瓣总面积(cm2)-皮瓣坏死面积(cm2)/皮瓣总面积(cm2)。
1.7 大鼠血清VEGF蛋白检测 于术后第2、4、7、14天采用经眼眶后静脉丛采血法抽取大鼠外周血0.5~1.0 mL,离心取血清,采用ELISA法检测血清中VEGF(第2、4、7天VEGF水平检测时大鼠数为10只,第14天VEGF水平测定时大鼠数为5只)。
1.8 皮瓣微血管密度(MVD)测算 术后第11天,各组随机抽取5只大鼠,麻醉过量处死后于皮瓣存活区域取材,行CD31免疫组化,检测皮瓣MVD。在每组中随机抽取10张切片,于200倍光镜下每张随机计算20个视野中的血管断面数目,求均值计算各组皮瓣的MVD值[12]。皮瓣MVD(条/mm2)=第1个视野血管断面数目(N1)+N2+、+N20/20。
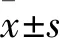
2 结果
2.1 各组术后第11 天皮瓣存活率比较 A、B、C、D、E组皮瓣存活率分别为84.3%±4.7%、61.2%±4.5%、50.1%±3.8%、43.8%±2.9%、30.7%±1.9%,两两比较,P均<0.05。
2.2 各组不同时点血清VEGF蛋白水平比较 血清VEGF蛋白水平比较见表1。


组别 VEGF蛋白 术后第2天术后第4天术后第7天术后第14天 A组486.3±7.5∗583.7±13.4∗682.5±12.6∗274.2±7.1∗B组352.3±4.8435.2±6.9550.2±9.7215.5±5.8C组34.8±2.935.6±3.229.1±2.826.9±1.9D组33.1±2.031.2±3.727.9±2.824.7±2.1E组33.2±3.630.7±2.833.2±2.725.7±1.8
注:与其余4组比较,*P<0.05。
2.3 各组皮瓣局部MVD计数比较 A、B、C、D、E组MVD计数分别为62.1±5.2、53.7±4.8、40.5±3.1、25.9±3.0、17.8±1.1,两两比较,P均<0.05。
3 讨论
口腔颌面部常因手术切除良恶性肿瘤、颌面部创伤、间隙感染及发育性畸形等各种因素所致组织缺损,从而导致面部畸形,严重影响患者的吞咽、言语等生理功能及日常生活,不可避免的给这类患者的身心健康造成较大的影响。临床选用何种方法对组织缺损来进行修复重建,才能尽可能恢复较为正常的生理功能及面部外形显得尤为迫切。皮瓣移植自应用于口腔颌面部软组织缺损的修复重建以来,取得了较为满意的临床效果,其兼具创面修复、功能重建等重要作用。但是皮瓣移植后由于局部压迫、血栓形成等各种复杂的局部或全身因素造成其血流动力学发生变化,最终导致皮瓣因缺血而发生局部或全部坏死。皮瓣移植术后一旦出现血运障碍、缺血坏死,临床处理较为棘手,往往需再次或多次手术,增加了患者的创伤及医疗费用,如何提高缺血皮瓣的存活能力一直以来是临床研究的重点和难点。
BMSCs是一种存在于骨髓中的非造血干细胞,具有自我复制及多向分化的干细胞潜能,在体外特定的诱导环境中可以向成骨细胞、脂肪细胞、血管内皮细胞等方向分化,经体外培养后不影响其增殖、分化能力。HUVEC来源丰富,取材、操作方便,不像胚胎干细胞涉及安全性及伦理学问题,且具有干细胞的功能-能够无限次(理论上)增殖传代。VEGF已被公认为是在血管生成中发挥重要作用的促血管化生长因子,包括五种异构体,其中VEGF 121和VEGF 165两种蛋白质是主要的分泌成分和效应因子[13,14]。而VEGF 165在体内含量最为丰富,促血管化作用最强[15]。国内外学者利用VEGF促血管化研究的实施方案包括对其进行蛋白重组和基因转染这两种形式。但是经过蛋白重组后的VEGF应用于体内实验研究时发现,其半衰期非常短,很快就会溶解于周围组织液当中并降解而失去生物学活性,无法持续、稳定地发挥促血管生成的作用;通过血液循环途径不能精准定位至损伤局部发挥作用,且需要多次给药,不可避免地增加了经济负担。近年来,大多数学者将目光投向基因转染这个方式,通过将目的基因导入宿主细胞后让自身源源不断的合成效应蛋白,从而能够在体内持续发挥促血管生成的生物学效应[16]。应用HUVEC与BMSCs共培养体系时,利用它们之间分泌的细胞因子在生物学功能方面产生偶联协同效应,加速血管生成,相互促进,相互影响。本研究显示,各组皮瓣存活率两两比较有差异,且A组皮瓣成活质量明显高于其他四组。
有研究发现[17],BMSCs与HUVEC在共培养条件下,除HUVEC自身能够分泌VEGF 165外,还能增加BMSCs合成和分泌VEGF 165,两者分泌的VEGF 165共同促进了HUVEC的分裂、增殖、迁移以及血管芽的形成。本研究显示,A组VEGF蛋白表达水平并未明显升高,C、D、E组各时间点的VEGF水平波动较小。我们分析,出现这种现象的原因可能是由于HUVEC和BMSCs自身能分泌多种促血管化生长因子,如VEGF、bFGF、PDGF等,这些促血管化因子通过一系列复杂的生物学效应发挥了血管生成的作用,一定程度上提高了皮瓣存活率,但是这些促血管化生长因子的量较少,在全身血液循环过程中被稀释。而本实验经大鼠眼眶后静脉丛采血离心后检测VEGF水平,其局部产生的VEGF蛋白经全身血液循环至眼眶后静脉时已被大量稀释,C、D组皮瓣局部实际的VEGF水平应该明显高于实验检测的结果。比较B、D组的VEGF蛋白水平,我们发现转染基因的HUVEC在体内能持续高表达VEGF蛋白,结合两组相应的皮瓣存活率及MVD表明,VEGF发挥了促血管生成的作用;A组皮瓣存活率高于B、C组,转染基因的HUVEC与BMSCs共移植后VEGF表达水平明显高于单独共移植或单独转染基因,A、B、C组皮瓣MVD数据比较同样印证该结果。有研究[18]发现,在BMSCs与HUVEC共培养体系中,HUVEC分泌的尿激酶类纤容酶原激活剂(uPA)和VEGF受体增加,同时BMSCs中VEGF 165的表达也上调,VEGF 165进而活化HUVEC中uPA,uPA与血管内皮钙粘蛋白可能一起启动了共培养细胞的自组装进网络以及细胞的迁移、增殖、分化。Kaigler等[19]发现,在BMSCs与血管内皮细胞共培养体系中,BMSCs能分泌VEGF来促进内皮细胞的分裂、增殖分化形成血管芽状结构。还有研究发现[20~23],共培养的VECs可以释放BMP-2,一方面促进成骨分化,另一方面还可以促进成骨及其前体细胞分泌VEGF,VEGF反过来作用于VECs,促进内皮细胞的分裂、增殖、分化及血管形成。两者相互促进,起到级联放大的作用,共同促进血管生成。
总之,BMSCs与VEGF 165-HUVEC共移植入大鼠背部缺血皮瓣后,在体内能持续高表达VEGF蛋白,大鼠背部缺血皮瓣的存活率及皮瓣局部的MVD明显增加,具有提高缺血皮瓣存活的能力。

