右旋美托咪啶对惊厥性癫痫持续状态大鼠认知功能和神经炎症的影响
韩耀国,张涛,叶明荣,陈刚,姚玉龙,许开亮,孙跃喜,雷鸣
作者单位:上海中医药大学附属第七人民医院重症医学科,上海 200137
癫痫持续状态(status epilepticus,SE)是一种常见的神经系统疾病,可分为惊厥性(convulsive status epilepticus,CSE)和非惊厥性(nonconvulsive status epilepticus,NSE)。CSE表现为有规则的胳膊和腿的交替收缩和伸展。CSE可导致海马神经元的丧失[1]。由于严重的脑损伤,一些CSE病人表现出认知功能障碍、抑郁、焦虑和其他精神症状,严重降低了病人的生活质量[2]。CSE也可以诱导神经炎症反应并参与其发病机制[3]。因此,抗炎治疗已经显示出预防和治疗癫痫发作的希望[4]。
右旋美托咪啶(dexmedetomidine,DEX)是一种有效的α2-肾上腺素能(a2A)特异性激动剂,具有镇静和镇痛作用,维持血流动力学稳定,减少麻醉相关并发症的发生[5]。DEX具有抗炎症特性,从而促进脑缺血后的神经保护作用[6]。DEX的神经炎症抑制作用是通过激活α7-烟碱乙酰胆碱受体(α7-nAChR)诱导的[7]。DEX改善认知功能的一个重要作用部位是海马,一个对于学习和记忆功能至关重要的脑区[8]。然而,目前DEX对CSE 的抗惊厥作用的机制尚未完全阐明。
在本研究中,我们自2017年1—7月建立了CSE大鼠模型,并用DEX进行预处理。观察大鼠的认知功能,癫痫发作严重程度和电生理指标。测量海马组织胆碱能抗炎通路的相关蛋白,以阐明DEX的机制,并寻找CSE病人的治疗靶点。
1 材料和方法
1.1 动物选择和分组研究对象为成年雄性Sprague-Dawley大鼠,年龄10周,体质量(200±20)g,由SLRC实验动物中心(中国上海)提供,饲养于20~24 ℃和40%~70%的湿度条件下。应用随机数字表法将动物分为对照组,CSE组和DEX组,每组30只。DEX组大鼠腹膜内注射右旋美托咪啶(100 μg/kg,1次/天,恒瑞制药有限公司,批号130621)。DEX给药总时间为8 d,包括CSE诱导前3 d,CSE诱导后5 d。动物研究符合一般动物实验伦理学原则。本研究中对于大鼠的处理符合动物伦理学相关标准。
1.2 建立CSE模型每只大鼠腹膜内注射氯化锂(3 mEq/kg),18~20 h后腹膜内注射毛果芸香碱(30 mg/kg)。如果没有发生惊厥,则另外注射毛果芸香碱(约为原始剂量的约1/4)。根据Simialowski方法评估大鼠的惊厥,并将其分为0~5级。具有IV和V惊厥水平的大鼠表示广泛性抽搐,用以本研究的实验。对照组大鼠用等体积的0.9%盐水替代氯化锂和毛果芸香碱。
1.3 癫痫严重度测量CSE诱导后立即监测大鼠的癫痫发作活动120 min,用修订版Racine评分(MRS)评估癫痫发作严重程度:1~2级:面部阵挛和头部点头;3级:单侧前肢阵挛;4级:竖起和双侧前肢阵挛;5级:竖起和倒下;6级:抽搐发作;7级:后肢伸展。
1.4 Morris水迷宫试验应用Morris水迷宫试验测量大鼠CSE诱导后1、3和5 d时的空间记忆能力。一个透明平台放置在水迷宫池四个象限中的1/2个半径内,水面高于平台顶部1 cm。将大鼠放在水迷宫池中远离平台的象限,并引导其找到并爬上平台,并将该持续时间记录为逃避潜伏期(最大60 s)。然后将平台从池中取出,将大鼠置于前一测试对面象限的水中。观察游泳路径60 s,并将大鼠越过原来平台位置的次数记录为穿越平台次数。
1.5 LTP的电生理记录CSE诱导后第5天,用1.2%异氟烷麻醉大鼠,提取大脑,置于含氧切片液(0~4 ℃)中1~2 min。制备海马切片,并在35 ℃下在记录溶液中放置30~45 min,连续灌注氧合记录溶液(1.5 mL/min,35 ℃)。将单极记录电极插入CA1锥体细胞的海马区,应用高频刺激(high frequency stimulation,HFS;10列,400 Hz)诱导,在HFS之后每5 min记录一次细胞外群体峰电位振幅(population spike amplitude,PSA),持续120 min,作为场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)。
1.6 免疫组织化学检测海马α7-nAChR表达CSE诱导后第5天,用1.2%异氟烷麻醉大鼠,取海马组织用4%多聚甲醛固定、脱水、石蜡包埋,以制备连续切片(5 μm厚)。切片与兔抗小鼠α7-nAChR(1∶100)孵育4 ℃过夜,PBS洗2次后与生物素化 HRP-IgG(1∶100,第二抗体)在室温下孵育2 h。切片用二氨基联苯胺(DAB)着色,并用苏木精复染。在Olympus BX51显微镜(日本奥林巴斯公司)下观察并计数α7-nAChR阳性神经元(褐色细胞),然后将5个视野的总计数转化为细胞密度(细胞/HP)。
1.7 海马细胞因子分析CSE诱导后1、3、5 d大鼠麻醉,取海马组织制备匀浆。通过4 ℃离心10 000g×10 min分离上清液,使用酶联免疫吸附法(ELISA)试剂盒测定IL-1β、TNF-α、S-100β和BDNF水平。通过酶标仪(Ricso RK201,深圳瑞科索科技有限公司)测量450 nm处的光密度(OD)获得数据。
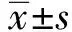
2 结果
2.1 DEX对CSE大鼠认知、癫痫严重程度和LTP的影响Morris水迷宫试验显示:与CSE组相比,DEX组在3 d和5 d的逃避潜伏期显著缩短(P<0.05)(图1A),穿越平台次数显著增加(P<0.05)(图1B)。表明DEX能显示改善CSE大鼠的空间记忆能力。
我们通过评估CSE诱导后120 min的癫痫指数,探索DEX是否影响CSE大鼠的癫痫发作严重程度。与CSE大鼠相比,DEX大鼠在诱导后40、60、80、100和120 min时癫痫发作明显降低(P<0.05)(图1C)。这表明DEX在CSE大鼠中显示了抗惊厥作用。
为了研究DEX对突触传递的影响,于CSE诱导后第5天制备海马切片,应用高频刺激(HFS)测量LTP。HFS诱导5 min后LTP急剧增加至基线的2.8倍左右,然后缓慢下降。与对照组比较,CSE大鼠fEPSP斜率较低。DEX能增加CSE大鼠大多数时间点的fEPSP斜率(图1D)。这表明DEX能增强CSE大鼠HFS后的LTP。和CSE组相比,DEX显著升高HFS诱导后30、60和90 min的fEPSPS 振幅(P<0.05)(图1E)。
注:fEPSP幅度归一化为相对于基线fEPSP的比值。与对照组相比,aP<0.05;与CSE组相比,bP<0.05图1 DEX对CSE大鼠认知功能障碍、发作严重程度和LTP的影响:与CSE大鼠相比,DEX预处理(100 μg/kg,1次/天)显著降低逃避潜伏期时间(A),增加平台交叉数在癫痫发作后比较CSE组和DEX组大鼠的癫痫发作评分,每20分钟记录一次评分大鼠HFS前后LTP诱导的时程和程度。(E)HFS诱导后30、60和90 min的平均fEPSP幅度

注:与CSE组相比,bP<0.05图2 DEX增加CSE大鼠海马中α7-nAChR阳性神经元表达:免疫组织化学显示CSE诱导后第5天对照组(A)、CSE组(B)和DEX组大鼠海马的α7-nAChR阳性神经元(C)(×200)。定量数据显示,DEX显著增加α7-nAChR阳性神经元的细胞密度

注:相对于CSE组,aP<0.05图3 DEX对CSE大鼠海马组织细胞因子水平的影响:在CSE诱导后第1、3和5天,ELISA测量大鼠海马组织匀浆IL-1β、TNF-α、S-100β和BDNF蛋白水平。DEX降低海马IL-1β(A),TNF-α(B),S-100β(C)水平,增加BDNF(D)水平
2.2 DEX对CSE大鼠海马中α7-nAChR阳性神经元的影响免疫组化显示数量与对照组相比,CSE大鼠海马组织α7-nAChR阳性神经元数目明显低于对照组(P<0.05)。与CSE大鼠相比,DEX组的α7-nAChR阳性神经元数量显著增多(P<0.05)(图2)。这表明DEX可以增加CSE大鼠海马中的α7-nAChR表达。
2.3 DEX对CSE大鼠海马细胞因子水平的影响
和CSE组相比,DEX显著降低CSE大鼠海马IL-1β、TNF-α和S-100β水平(P<0.05)(图3A,3B,3C),显著升高CSE大鼠海马BDNF水平(P<0.05)(图3D)。这表明DEX可以抑制海马组织生成促炎症细胞因子,减少脑损伤,并改善神经再生的微环境。
2.4 α7-nAChR参与DEX对CSE大鼠的抗癫痫作用为了探讨α7-nAChR在DEX对CSE大鼠抗惊厥中的作用,我们用DEX,尼古丁(0.5 mg/kg,)皮下注射或DEX +α-BGT(1.0 μg/kg)静脉注射预处理CSE大鼠。与CSE大鼠相比,DEX和尼古丁预处理组均显著降低CSE诱导后120 min的癫痫发作评分,DEX降低癫痫发作评分的作用能被α-BGT减弱(P<0.05)。此外,DEX增加LTP的作用可以被α-BGT预处理逆转(P<0.05)(图4)。
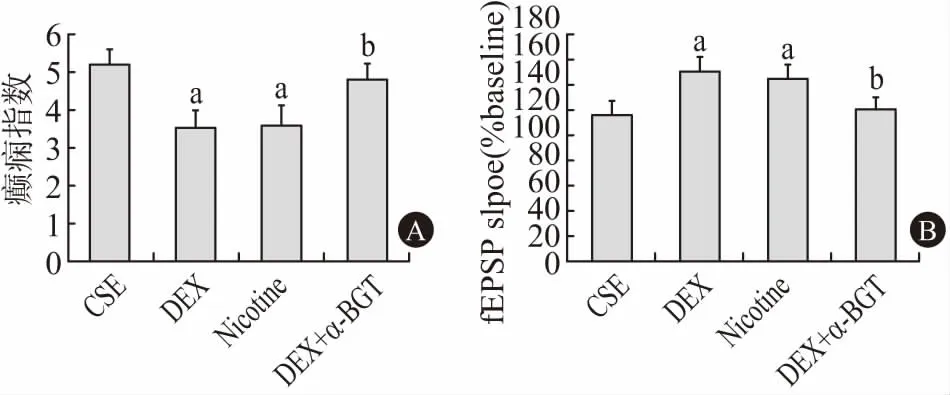
注:相对于CSE组,aP<0.05;相对于DEX组,bP<0.05图4 DEX对CSE大鼠的作用依赖于α7-nAChR:CSE大鼠用DEX、尼古丁、DEX+α-BGT(1.0 μg/kg)静脉注射预处理。(A)与CSE大鼠相比,DEX和尼古丁显着降低了癫痫发作。α-BGT预处理减弱DEX的抗癫痫作用。(B)DEX和尼古丁显着增加CSE大鼠的LTP。DEX对LTP的作用可以通过α-BGT预处理逆转
3 讨论
在本研究中,我们应用腹膜内注射氯化锂和毛果芸香碱建立CES大鼠模型,并探索了右旋美托咪啶(DEX)的抗癫痫作用和机制。研究结果表明,DEX改善了CSE大鼠的认知功能,减轻CSE大鼠癫痫发作,增强LTP,延长其持续时间,表明DEX具有抗惊厥作用。DEX显著增加CSE大鼠海马中α7-nAChR阳性神经元数量,降低海马组织IL-1β、TNF-α、S-100β蛋白水平,升高BDNF水平。此外,DEX对癫痫严重程度和LTP的作用依赖于α7-nAChR途径,因为尼古丁(α7-nAChR激活剂)预处理具有和DEX类似的作用,α-BGT(α7-nAChR抑制剂)可以逆转DEX的作用。
认知缺陷是CSE的常见症状,也加重了癫痫活动[2]。这表明能改善认知功能的药物也可能减轻癫痫发作严重程度。DEX降低了手术或ICU期间病人认知功能障碍的风险[9]。我们的结果显示了DEX在癫痫发作动物模型中的认知改善功能。DEX预处理也显示了抗惊厥作用,表现为CSE大鼠癫痫发作评分下降。DEX能提高麻醉剂利多卡因的中毒剂量阈值,从而延迟了利多卡因诱发的惊厥的发生[10]。在我们的CSE模型中,DEX也可能增强了毛果芸香碱的中毒剂量阈值。DEX可能是CSE的潜在治疗剂。
长时程增强增强(LTP)是基于近期活动的突触持续强化,从而在两个神经元之间产生长期增强的信号传输,其主要表现为fEPSP的增强。海马中LTP的抑制可能会损害学习和记忆能力[11]。在本研究中也观察到,由氯化锂和毛果芸香碱诱导的癫痫大鼠海马切片中的LTP诱导减少[12],这种降低的LTP可能与认知功能障碍和发作严重程度相关。DEX能逆转CSE诱导的海马LTP下降,这表明其具有神经保护和抗癫痫效应,如其他报道所示[13]。我们的结果与其他报道相反,DEX抑制了麻醉啮齿动物的海马LTP,从而诱导镇静作用[14-15]。这种差异可能在于海马组织的种类。在正常海马切片中,低浓度DEX灌注(1和10 μmol/L)下LTP无变化,但在较高浓度DEX灌注(100 μmol/L)下LTP显著降低。然而,在经受氧-葡萄糖剥夺(OGD)的海马切片中的LTP降低,而DEX能促进LTP的恢复[16]。这表明DEX可以抑制正常的海马LTP(麻醉的啮齿动物),并增强患病动物的海马LTP,如OGD和CSE大鼠所见。这种差异可能在于DEX在正常和患病海马中所激活的不同信号传导途径。
DEX增加CSE大鼠海马中α7-nAChR蛋白的表达,这表明DEX可激活胆碱能抗炎通路,如胫骨骨折大鼠[7]和败血症小鼠[17]所支持的。在毛果芸香碱诱导的癫痫持续状态小鼠中,海马组织的乙酰胆碱酯酶(AChE)表达上调,促进癫痫发生过程[18]。上调的AChE能导致乙酰胆碱(ACh)水平降低和胆碱能通路减弱。相反,α7-nAChR激动剂改善了学习和记忆能力,减轻了小鼠和大鼠的癫痫发作[19]。α7-nAChR的活化也抑制炎症细胞因子的表达和释放,这支持我们的结果,如DEX降低 CSE大鼠的海马组织IL-1β和TNF-α水平。IL-1β和TNF-α常见的促炎症细胞因子,癫痫发作后L-1β和TNF-α在海马组织的表达持续上调,提示癫痫发作可能诱发炎症反应[20]。胆碱能途径也可能对LTP产生积极影响。α7-nAChRs基因敲除(KO)小鼠在海马CA3-CA1突触中表现出受损的LTP,而IL-1β降低了海马CA3-CA1的突触可塑性和LTP[22]。这解释了为什么在我们的结果中DEX也能增强CSE大鼠的LTP。此外,在我们的研究中,DEX在CSE诱导前3天施用,而其它文献中DEX给药时间在麻醉啮齿动物进行LTP测量之前20 min[14-15]。这可能给予足够的时间上调海马α7-nAChRs表达,从而增加对LTP诱导的敏感性。在我们的研究中,DEX还降低了CSE大鼠海马S-100β水平,升高了BDNF水平。S-100β是脑中酸性Ca2+结合蛋白,脑损伤后可释放到体液中。与健康受试者相比,癫痫病人血清和脑脊液S-100β蛋白水平较高,表明癫痫脑损伤[23]。BDNF是涉及神经元存活和突触可塑性的生长因子,在学习和记忆功能中起关键作用。大鼠癫痫发作脑损伤能降低血清BDNF水平[24]。因此,我们的研究结果表明,DEX可以减轻神经元损伤,促进CSE大鼠神经再生。
总之,DEX可以显著改善CSE大鼠的认知功能障碍,发作严重程度和LTP。DEX激活胆碱能抗炎症通路,抑制炎性细胞因子释放并显示出神经保护作用。DEX抑制癫痫发作严重程度和增强LTP依赖于α7-nAChR。我们的研究结果表明DEX是一种CSE和其他癫痫发作的潜在治疗药物。

