乳腺导管原位癌MRI 特征及其与病理分级的关系
许晓琴,汪登斌,王丽君,罗冉,刘欢欢,章华元,尹冬青
乳腺导管原位癌(DCIS)又称导管内癌、导管上皮内肿瘤。DCIS 有发展为浸润性导管癌的倾向,有报道显示40%的DCIS 会进展为浸润性导管癌[1],病理上,高核级别DCIS 进展为浸润性导管癌和局部复发的危险性显著高于非高核级别DCIS[2]。乳腺MRI 具有良好的软组织分辨力,在检出及评估DCIS 范围方面具有优势。本文回顾性分析35 例DCIS 的MRI影像特点,并分析其与病理分级的关系。
1 资料与方法
1.1 临床资料 选择上海交通大学医学院附属新华医院2015年1月—2018年1月经手术病理检查证实的34 例DCIS 患者为研究对象,均为女性,共有35 侧乳腺患病。年龄30~71 岁;右乳17 例,左乳18 例。1 例假体置入后右乳发生DCIS,1 例左乳恶性肿瘤术后右乳发生DCIS,1 例左乳浸润性导管癌后右乳发生DCIS;1 例双乳发生DCIS。无明显临床症状25 例,临床扪及肿块或局部软组织增厚10 例,乳头溢液3 例,局部胀痛3 例。
1.2 病理分级 病理标本均行HE 染色切片,必要时加用免疫组化分析,均由2 名有经验的病理科医师进行诊断,并将DCIS 根据组织学核级别分为低级别和中~高级别。
1.3 MRI 检查方法 MRI 检查采用飞利浦Ingenia 3.0T 超导型MR 设备。受检者常规俯卧位,双侧乳房自然悬垂于乳腺相控阵线圈中,适当加压固定乳房,乳头位于最低点。扫描基本序列包括:(1)短时间反转恢复序列(STIR);(2)扩散加权成像(DWI),扩散敏感系数b 值取0、800 s/mm2;(3)乳腺dyn-eTHRIVE 增强扫描采用频率选择脂肪抑制技术。在注射对比剂前先采集一期平扫图像,注射对比剂后再连续无间隔重复扫描共6 个时相,每一期扫描时间均为58 s,每期扫描层数150 层,层厚1.2 mm。对比剂使用钆喷替酸葡甲胺(GD-DTPA),剂量0.2 mmol/kg,使用高压注射器经手背静脉团注,流速控制在2.0 ml/s,随后以同样方式注入15 ml 0.9%氯化钠溶液。必要时后处理工作站冠状位及矢状位重建。
1.4 MRI 表现 MRI 图像均由2 名经验丰富的乳腺MRI 影像诊断医师在不知晓病理结果的情况下分别解读,意见不统一时通过讨论达成共识。按照美国放射学院提出的乳腺影像报告与数据系统(BI-RADS)图谱(2013 版)标准[3]。
对病灶形态学和病灶动态增强后第2 期图像进行描述和分类。肿块从形态学表现和内部强化特征对病变进行描述;非肿块样强化从病灶的分布形式和内部强化类型对病变进行描述。病灶动态增强表现根据时间-信号强度曲线(TIC)分为Ⅰ型(持续上升型:即增强后信号强度持续上升)、Ⅱ型(平台型:即增强早期信号强度快速上升达到峰值后保持基本恒定,信号强度变化不超过±10%)、Ⅲ型(流出型:即增强早期信号强度快速上升达到峰值后逐渐下降)。通过TIC计算早期强化率(EER):早期缓慢强化EER<50%,早期中度强化EER 为50%~100%,早期快速强化EER>100%。在后处理工作站上检测表观弥散系数(ADC)值。
1.5 统计学方法 采用SPSS 22.0 统计软件进行数据分析。计数资料以相对数表示,组间比较采用χ2检验或Fisher's 精确概率法。以P<0.05 为差异统计学意义。
2 结果
2.1 病理分级 低级别4 例,中~高级别31 例。
2.2 BI-RADS 分类 3 类1 例,4A 类2 例,4B 类5 例,4C类12 例,5 类15 例。
2.3 病灶形态学 (1)肿块型6 例,均表现类圆形,边界清,不均匀强化,其中1 例类似良性肿瘤表现,最大径约2.0 cm。 (2)非肿块样强化29 例。①分布形式:节段性强化15 例(见图1),指强化尖端指向乳头的三角形或锥形分布;区域性强化5 例,指强化超过1 个导管系统;线样强化4 例(见图2),指沿分支或不分支的线样(不一定是直线)排列;局灶强化2例,指局限于较小区域的可以被称为非肿块样强化的强化;多区域强化2 例,指至少含有两大块强化组织,不符合一个导管分布范围,中间夹杂有正常组织;弥漫强化1 例。②内部强化类型:成簇小环形强化15 例(见图3),指聚集在导管周围的细环形强化;集簇状强化5 例,指大小不一、形态各异的强化区呈鹅卵石样排布,偶有融合;不均匀强化8 例;均匀强化1 例。
2.4 病灶动态增强表现 Ⅰ型TIC 10 例,Ⅱ型TIC 15 例,Ⅲ型TIC 10 例。早期缓慢强化4 例、早期中度强化2 例、早期快速强化29 例。
2.5 病灶ADC 值(×10-3mm2/s,b=800) T1 加权像(T1WI)呈等或等低信号,T2 加权像(T2WI)呈高或稍高信号,DWI均呈高信号。ADC 值<1.2×10-3mm2/s 19 例,平均ADC 值为1.0×10-3mm2/s;ADC 值≥1.2×10-3mm2/s 16 例,平均ADC值为1.4×10-3mm2/s。
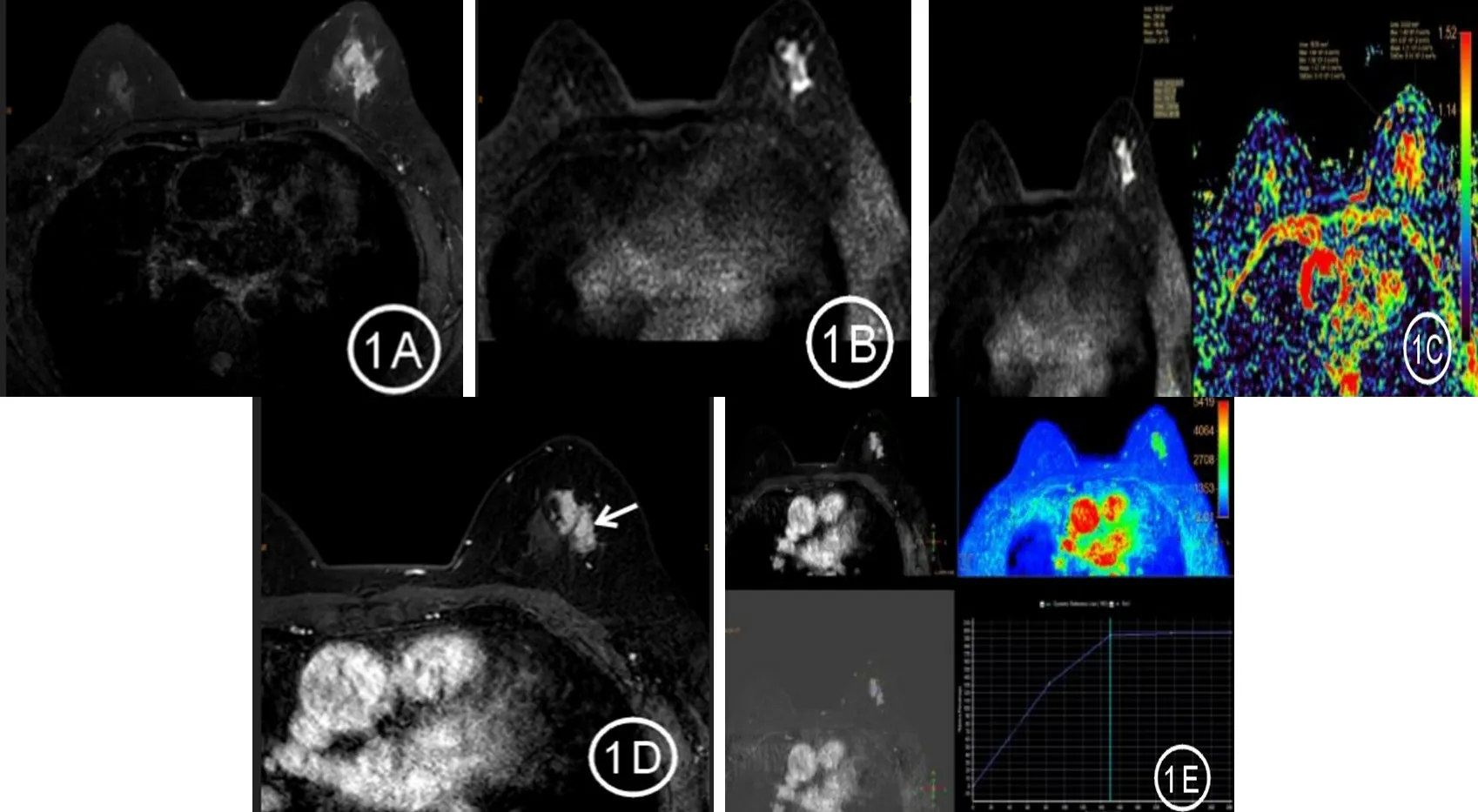
图1 左乳外上象限DCIS 的MRI 表现Figure 1 MRI findings of DCIS on the left upper outer quadrant of the breast

图2 右乳外侧象限DCIS 的MRI 表现Figure 2 MRI findings of DCIS on the right outer quadrant of the breast
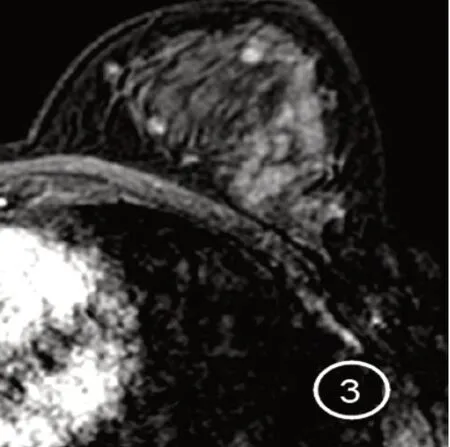
图3 左乳外上象限DCIS 的MRI 表现Figure 3 MRI findings of DCIS on the left upper outer quadrant of the breast

图4 左乳外上象限DCIS 的病理表现(HE 染色,×40)Figure 4 Pathology of DCIS on the left upper outer quadrant of the breast
肿块型6 例ADC 值均<1.2×10-3mm2/s。非肿块样强化29例中ADC 值<1.2×10-3mm2/s 14 例,ADC 值≥1.2×10-3mm2/s 15 例。成簇小环形强化15 例中ADC 值<1.2×10-3mm2/s 3 例,ADC 值≥1.2×10-3mm2/s 12 例。
2.6 DCIS 病灶MRI 表现与病理分级的关系 低级别和中~高级别患者病灶形态学、ADC 值比较,差异无统计学意义(P>0.05);低级别和中~高级别患者非肿块样强化分布形式、内部强化类型、TIC 类型、早期强化情况比较,差异有统计学意义(P<0.05,见表1)。
3 讨论
DCIS 发生于终末导管小叶单位,通常起源于一个导管束,可沿导管系统进行播散,其既可位于近乳头的大导管内,也可位于远离乳头的小导管内,临床相对少见,约占乳腺癌的3.66%。发病高峰年龄为40~60 岁,临床多无症状,约10%的患者可触及肿块,偶有乳头溢液。本研究DCIS 患者发病年龄为30~71 岁,平均52 岁,发生乳头溢液3 例(8.6%)。DCIS 可有多灶性、多中心性、隐匿性浸润等,腋窝淋巴结转移少见。DCIS 具有发展为浸润性癌的趋势,约14%~75%的DCIS 会进展为浸润性乳腺癌,其是一种高治愈率的疾病,患者10年生存率>97%,其恶性程度与病理类型及核级别相关[4]。
3.1 DCIS 的病理基础 DCIS 根据核异型性分为低级别、中级别和高级别。高级别DCIS(见图4)有时被称为“粉刺型”坏死,其局部复发危险性显著高于低级别DCIS。核级别比传统的DCIS 亚型分类更能真实反映DCIS 的生物学特点,更具有临床价值[5]。本研究中低级别4 例、中~高级别31 例,中~高级别DCIS 多于低级别DCIS。这可能与样本量不足有关,或是由于低级别DCIS 检查中存在漏诊、假阴性造成。造成漏诊、假阴性的原因可能与微血管差异有关,因为中~高级别DCIS 微血管密度显著高于低级别DCIS。

表1 DCIS 病灶MRI 表现与病理分级的关系〔n(%)〕 Table 1 MRI findings and pathological grade of DCIS lesions
3.2 MRI 表现 DCIS 是一组在表现形式、组织学形态、生物学特征以及发展为浸润性乳腺癌的危险性方面均呈高度异质性的疾病,因此DCIS 在MRI 形态学上表现多样,非肿块样强化中的节段性强化、线样强化被认为是DCIS 的MRI 增强后的特征性表现。MORAKKABATI-SPITZ 等[6]分析了1003例DCIS 患者的资料显示,这2 种强化形式对DCIS 的诊断有很高的特异度(96%)。本组非肿块样强化29 例,其中节段性强化、线样强化19例,内部强化类型表现为成簇小环形强化、集簇状强化、不均匀强化、均匀强化。有研究显示,成簇小环形强化出现在63%的恶性病灶中(DCIS 占85.7%),仅4%的良性病灶中有此征象,阳性预测值为96%[7]。TOZAKI 等[8]研究认为出现该征象的病理基础为导管内癌有丰富的血供,增强时导管周围基质和导管壁强化。垂直于导管切面表现为小环形强化,平行于导管切面表现为轨道样或线样强化。线样强化病理基础为萎缩的乳腺组织周围有散在的DCIS 成分;节段性强化呈三角形或锥形,尖端指向乳头,提示病灶累及整个导管束[7]。区域性强化是指范围较大,不沿导管走行,分布范围无明显特征,不能用节段性强化等征象来描述的一种分布方式,常表现为地图状或斑片状强化。本组有5 例表现为区域性强化,2例表现为多区域强化,1例表现为弥漫强化。
TIC 类型与对比剂从血管到细胞外间隙的灌注与弥散相关。FURMAN-HARAN 等[9]研究认为强化率随着病变的进展从良性到DCIS 再到浸润性导管癌逐渐增加,并与微血管密度相关。本研究Ⅰ型TIC 10 例、Ⅱ型TIC 15 例、Ⅲ型TIC 10例。LIBERMAN 等[10]研究认为并非所有DCIS 具有病理性肿瘤新生毛细血管,特别是侵袭基底膜前的导管内癌,其肿瘤血管密度低且血管化程度不一。故DCIS 的TIC 表现多样。姜婷婷等[11]研究发现高核级别DCIS 较易出现流出型曲线(Ⅲ型TIC),而非高核级别较易出现持续上升型曲线(Ⅰ型TIC);高核级别DCIS 更倾向于早期快速强化,病变范围也更大,这可能是其更具侵袭性的生物学行为所致。
本研究患者所有病灶MRI 表现DWI 呈高信号或以高信号为主,ADC 不同程度减低。本研究以1.2×10-3mm2/s,b=800作为乳腺良恶性病变的诊断阈值。研究发现肿块型6 例ADC值均<1.2×10-3mm2/s。而非肿块样强化DCIS ADC 值并不像其他恶性肿瘤所显示的ADC 值较低,≥1.2×10-3mm2/s 16 例。分析可能的原因如下:非肿块样强化DCIS 的肿瘤细胞密度低,纤维间质多[12-17],故所选取的感兴趣区内细胞密度增加不明显,水分子扩散不明显受限,ADC 值相对减少不明显。笔者认为:对于非肿块样强化DCIS,由于没有明确的占位效应和边界,病灶中夹杂正常的脂肪和腺体,导致ADC值偏高和离散。虽然DWI 即ADC 值的测量对非肿块样强化DCIS 的诊断正确率不如浸润性癌及肿块型DCIS,但同时结合TIC,综合诊断非肿块样强化DCIS 也具有较大的参考价值。
3.3 鉴别诊断 (1)肉芽肿性小叶性乳腺炎(GM)是一种少见的慢性乳腺炎症疾病,多发生于育龄期妇女,与自身免疫功能异常有关。非肿块样强化GM 在MRI 动态增强形态学方面,与DCIS 均可表现为边界不清,呈节段性、区域性、线样强化,但GM 多表现为不均匀强化伴多发环形强化,环形强化不等但厚薄较均匀,考虑与炎症治疗不及时,引起导管周围多发微脓肿的形成,进而出现中心性坏死有关。钼靶上GM 的征象具有非特异性,而DCIS 钼靶上恶性钙化多见。(2)导管内乳头状瘤:40 岁以上妇女多见,为导管内单个或者多个乳头状瘤体,伴或不伴导管上皮细胞增生,多表现为沿导管走行的散在分布,即多表现为线样强化伴散在小结节,多伴有导管扩张。(3) 乳腺腺病:大多数乳腺腺病MRI 表现为非肿块样强化的弥漫性、对称性改变,TIC 多呈Ⅰ型或Ⅱ型,DWI 不受限,腺病的ADC 值较高。
综上所述,MRI 上DCIS 主要表现为非肿块样强化,其中又以节段性、区域性、线样强化多见,内部强化类型以成簇小环形、集簇状强化的典型表现多见。MRI 能反映DCIS 病理改变,预测病理分级,可一定程度预测DCIS 是否伴有浸润及局部复发的可能性,以调整活检及临床治疗方案。由于本研究样本量少,仅有4 例低级别患者,在以后的研究中,应扩大样本量进一步分析DCIS 的MRI 表现与病理分级关系,以更好地指导临床治疗。

