拟南芥APX家族基因在植物生长发育与非生物逆境胁迫响应中的作用分析
李泽琴,李锦涛,邴杰,张根发
拟南芥APX家族基因在植物生长发育与非生物逆境胁迫响应中的作用分析
李泽琴1,李锦涛1,邴杰2,张根发2
1. 山西医科大学法医学院,太原 030001 2. 北京师范大学生命科学学院,抗性基因资源与分子发育北京市重点实验室,北京 100875
活性氧造成的氧化胁迫是植物主要非生物逆境胁迫之一。在不利的生长条件下,植物细胞内的各种代谢过程不协调可导致过氧化氢(hydrogen peroxide, H2O2)含量增加,从而对细胞造成多种威胁和伤害。抗坏血酸过氧化物酶(ascorbate peroxidase, APX)是植物中清除H2O2的一种重要酶,拟南芥() APX家族包括8个成员:APX1~APX6、sAPX和tAPX。本研究以拟南芥野生型和突变体为材料,对拟南芥不同发育时期和不同逆境胁迫下的8种基因表达模式进行了分析,同时研究了其相应的缺失突变体对盐、干旱和热胁迫的耐受性。mRNA差异表达模式分析显示:在拟南芥生长的第4~8周,表达量最高,表达量最低,、和随着生长发育的时间进程表达量逐渐减少,但表达量不断增加;在非生物胁迫下,、和受热胁迫诱导表达明显,响应盐胁迫,和对盐、干旱和热胁迫均表现出明显的诱导表达应答。盐和干旱胁迫耐受性分析结果表明:无论是在拟南芥的萌发期还是成熟期,任何一个基因缺失均使抗逆性降低;在萌发期,与盐胁迫相比,突变体对干旱胁迫更敏感;在成熟期,与野生型和其他突变体相比,和对盐和干旱胁迫更加不耐受。生理指标检测结果显示:干旱胁迫10 d后,所有突变体植株中的H2O2含量均明显高于野生型,其中、和中最高;盐胁迫5 d后,突变体中丙二醛(malondialdehyde, MDA)的含量显著高于野生型;热胁迫2 h就会导致、和中H2O2和MDA含量大幅增加,其中在中最高。本研究结果表明,拟南芥基因家族的8个成员均不同程度地参与植物生长发育及非生物胁迫响应的过程,在不同发育时期或逆境响应过程有特定的一种或几种APX发挥主要作用。
拟南芥();抗坏血酸过氧化物酶(APX);活性氧(ROS);逆境响应
植物在生长发育过程中会受到各种各样的环境胁迫,如干旱、冷冻、高盐、重金属和高温等非生物胁迫,以及病毒和真菌等生物胁迫。不良的环境刺激可导致过量活性氧(reactive oxygen species, ROS)产生,并通过脂质过氧化和蛋白氧化作用损伤DNA以及其他细胞成分,对植物细胞造成严重的伤害。ROS以自由基和非自由基两种形式存在,自由基状态包括超氧自由基(O2-)、羟自由基(OH)等,非自由基状态包括过氧化氢(H2O2)和单线态氧(1O2)[1,2]。ROS主要在叶绿体、过氧化物酶体和线粒体中产生,但也会作为胁迫诱导或常规代谢途径的副产物在细胞质、质外体和内质网产生[1]。ROS产生速率受环境条件的影响,如在强光照条件下,终端电子受体NADP+消耗殆尽,光合电子传递链过度还原,促进ROS产生[2]。ROS具有双重功能:一方面适量的活性氧为生物体所必须,作为信号分子参与信号网络调控;另一方面,过量的活性氧对细胞有毒害作用,须尽快清除[3,4]。因此,细胞内活性氧产生和清除的平衡十分重要,植物会通过酶或非酶机制维系机体活性氧的动态平衡,并在进化过程中形成了完整的抗氧化系统[5,6]。
清除活性氧的过氧化物酶系在生物体内普遍存在,包括谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)、过氧化氢酶(catalase, CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)。APX是非常有效的H2O2清除剂,在所有H2O2代谢酶中,其与H2O2的亲和力最高[7]。植物APX属于Ⅰ型血红素过氧化物酶和铜氧化酶家族,可通过抗坏血酸(ascorbic acid, ASA)-谷胱甘肽(glutathione, GSH)循环,以ASA为电子供体将H2O2还原为O2和H2O[2]。
APX广泛存在于绿色植物、藻类和具有叶绿体的原生生物中[8]。根据亚细胞定位,高等植物APX分为4个亚家族,分别是细胞质APX、线粒体APX、叶绿体APX和过氧化物酶体APX[6]。水稻() APX家族有8个成员,分别位于细胞质(OsAPX1和OsAPX2)、过氧化物酶体(OsAPX3和OsAPX4)、线粒体(OsAPX6)和叶绿体(OsAPX7和OsAPX8),OsAPX5同时定位于线粒体和叶绿体中[9~11]。拟南芥()APX家族也有8个成员,APX1、APX2和APX6位于细胞质,APX3和APX5位于过氧化物酶体,APX4、sAPX和tAPX位于叶绿体,其中APX4是一种类囊体腔蛋白,tAPX结合在类 囊体膜上,sAPX同时结合在叶绿体基质和线粒体 上[3,12~14]。全基因组分析发现,番茄()有7个APX编码基因[15]。其他植物如菠菜(L.)、豇豆()等由于全基因组序列未知,只发现了部分APX[16]。
Teixeira等[10]对水稻APX家族基因进行了系统研究,检测了野生型水稻在正常生长发育过程中的表达量及其在盐胁迫条件下的表达量变化。而拟南芥的8个APX中,只有APX1和叶绿体APX 研究较多,其他APX在拟南芥正常生长发育和各种非生物胁迫响应过程中的作用鲜有研究报道[3,12,17~24]。本文以拟南芥野生型和突变体为材料,对拟南芥在不同发育时期和不同逆境胁迫下APX家族的8个基因的表达模式以及相应突变体对盐、干旱和热胁迫的耐受性进行了系统的探究,以揭示拟南芥APX家族成员在植物正常生长发育和非生物逆境胁迫响应中的作用。
1 材料和方法
1.1 载体、菌株和实验材料
克隆载体pMD 18-T Simple Vector购自日本TaKaRa公司;大肠杆菌克隆表达菌株DH5α感受态细胞购自北京全式金公司;野生型拟南芥(, Columbia Ecotype)由张根发教授实验室保存;拟南芥APX家族基因T-DNA插入杂合突变体(SALK_143111)、(SALK_057686C)、(SALK_017480C)、(SALK_119726)、(SALK_075060C)、(WiscDsLox321c09)、(SALK_083737C)和(SALK_027804C)种子购于美国俄亥俄州立大学拟南芥生物资源中心(Biological Resource Center, ABRC)。
1.2 突变体筛选以及鉴定
1.2.1 拟南芥基因组DNA粗提取
从生长4周的植株上选取约1.0 cm×1.2 cm大小的叶片(不考虑叶龄和叶位)放入1.5 mL离心管中,置于液氮中速冻并捣碎。加入400 μL Gp1 buffer (购自北京天根生化科技有限公司,以下简称天根),用移液器吹匀,再加入400 μL氯仿。13 000 ×离心10 min,将300 μL上清液转入新的离心管中,加入300 μL异丙醇,颠倒混匀,−20℃放置20 min。13 000 ×离心10 min,沉淀DNA,去除上清液,用70%的乙醇洗涤沉淀,13 000 ×离心5 min,去除上清液,常温干燥DNA 15 min,用20 μL无菌水溶解,-20℃保存备用。
1.2.2 T-DNA插入纯合突变体筛选以及插入位点鉴定
将拟南芥突变体种子播种于含卡那霉素(Kan, 50 μg/mL)的MS培养基(1 L MS固体培养基含4.4 g MS粉、30 g蔗糖、7 g琼脂粉,用1 mol/L NaOH调pH至5.8,121℃高压灭菌20 min)上进行筛选。培养10 d后,将正常生长的小苗移栽到营养土中继续培养。生长3周后,提取叶片基因组DNA (方法见1.2.1),以其为模板,通过PCR扩增鉴定纯合突变体。鉴定拟南芥8个突变体所用的引物由美国索尔科研究所基因组分析实验室(http://signal.salk. edu/tdnaprimers.2.html)完成,引物序列见附表1。以各个突变体基因组DNA为模板,利用上下游引物(引物信息见附表1)分别扩增8个基因,经电泳分离并经胶回收后连接到pMD18-T克隆载体,转化大肠杆菌感受态细胞,挑取单克隆,经鉴定后由上海生工生物工程技术服务有限公司测序,分析测序序列即可确定突变体中T-DNA的精确插入位点。
1.2.3 拟南芥T-DNA插入纯合突变体中目的基因表达检测
将8种拟南芥纯合突变体种子种在营养土(营养土∶蛭石=3∶1)中萌发,待其生长至第5周时,用RNeasy Plant Mini Kit试剂盒(荷兰Qiagen公司)提取各突变体植株的总RNA,用RNA PCR Kit (AMV) Ver.3.0试剂盒(日本TaKaRa公司)反转录成cDNA。以合成的cDNA为模板,利用特异引物半定量RT-PCR扩增每种突变体相应的基因(~、和),引物序列见附表1。以(GenBank登录号:U41998)基因为内参,1%琼脂糖凝胶电泳检测PCR扩增结果。由于部分基因的表达量极低,取材之前对相应的突变体植株进行一定程度的胁迫处理,使其表达量易于检测。其中,用于检测的突变体材料于45℃放置2 h;用于检测、和的突变体材料用200 mmol/L NaCl处理12 h。
1.2.4 拟南芥T-DNA插入纯合突变体APX活性检测
分别称取1 g突变体或野生型拟南芥叶片,迅速置于预冷的研钵中,加入5 mL APX提取液[50 mmol/L PBS(K2HPO4-KH2PO4缓冲液),pH 7.8;2 mmol/L ASA;5 mmol/L EDTA],于冰水浴条件下快速充分研磨,匀浆置于离心管中,18000 ×、4℃离心40 min,收集上层清液备用。用南京建成生物工程研究所试剂盒测定APX活性。
每次检测从10株生长4周的植株中随机取叶片(不考虑叶位和叶龄),每批检测3次,设3个生物学重复。
1.3 APX基因表达定量分析
1.3.1 拟南芥APX家族基因本底表达量研究
野生型拟南芥种子春化处理3 d后,播种于灭菌的营养土中,保鲜膜(扎有小孔)覆盖3~5 d,种子全部萌发后去除保鲜膜。每隔3 d浇一次水,前3次用Hoagland营养液浇灌[945 mg/L Ca(NO3)2,506 mg/L KNO3,80 mg/L NH4NO3,136 mg/L KH2PO4,493 mg/L MgSO4,铁盐溶液2.5 mL (500 mL蒸馏水中溶有2.78 g FeSO4·7H2O,3.73 g Na2EDTA·H2O,pH 5.5),微量元素混合溶液5 mL (每升蒸馏水中含0.83 mg KI,6.2 mg H3BO3,22.3 mg MnSO4,8.6 mg ZnSO4,0.25 mg Na2MoO4·2H2O,0.025 mg CuSO4,0.025 mg CoCl2),pH 6.0],幼苗分别生长至第4、6和8周时,利用RNeasy Plant Mini Kit试剂盒(Qiagen公司)提取拟南芥叶片总RNA,通过琼脂糖凝胶电泳检测其完整性,应用分光光度计检测其纯度以及浓度。运用TransScriptTMOne-Step gDNA removal and a cDNA synthesis SuperMix kit试剂盒(全式金公司)进行反转录。以cDNA为模板,利用每个基因的特异引物进行Real-time qPCR (qRT-PCR)扩增,以基因为内参基因,设= 100REU (relative expression units)。每次检测从10株植株中随机剪取叶片,每批检测3次,设3个生物学重复。实时定量所用引物序列见附表1。
1.3.2 盐、干旱和热胁迫下拟南芥APX家族基因表达模式变化
砂培种植的拟南芥生长至1个月时,分别用含200 mmol/L NaCl和300 mmol/L甘露醇的Hoagland营养液浇灌处理72 h,分别于处理0 h、4 h、8 h、12 h、24 h和72 h时剪取叶片;或在45℃的培养箱中培养3 h,分别于0 h、0.5 h、1 h、2 h和3 h时取样,用铝箔纸包好迅速置于液氮中冷冻,再放于-80℃冰箱保存备用。利用RNeasy Plant Mini Kit试剂盒(Qiagen公司)提取RNA,运用TransScriptTMOne-Step gDNA removal and a cDNA synthesis SuperMix kit试剂盒(全式金公司)反转录成cDNA,并以此为模板,利用每个基因的特异引物进行qRT-PCR扩增,所用引物序列同1.3.1。每次检测从10株植株中随机取叶片,每批检测3次,设3个生物学重复。
1.4 盐和干旱胁迫处理后的表型观察
1.4.1 种子萌发以及幼苗生长期的胁迫处理
将表面消毒(0.1% HgCl消毒5 min,灭菌蒸馏水清洗5次,每次3 min)的拟南芥种子于4℃春化处理2~3 d后,播种于含NaCl(分别为0、50、100、150或200 mmol/L)或甘露醇(分别为0、100、200、300或400 mmol/L)的MS培养基上,置于植物培养间(培养间条件为:温度22℃,相对湿度60%~70%,16 h光照/8 h黑暗,光照强度110 μmol /m2s),MS板垂直摆放。7 d后统计胚根萌发率,10 d后统计幼苗的根长。每个株系每个MS板中点种40粒,每次同时培养两板,共80粒,设2个生物学重复。
1.4.2 对营养生长后期以及生殖生长期植株的胁迫处理
将野生型拟南芥和纯合突变体种子表面消毒,4℃春化处理3 d,点种在MS固体培养基上,放入植物培养间培养。7 d后,将生长情况一致的幼苗移栽至装有灭菌营养土(营养土∶蛭石=3∶1)的育苗小方盆(口径7 cm,高8 cm)中,每个小盆种9株。继续在植物培养间培养,每3 d浇一次水,待植株生长至第4周(开花前)时进行以下操作:(1)接受盐胁迫的植株,第一次用50 mmol/L的NaCl浇灌,以后每次浇灌均增加50 mmol/L NaCl,直至NaCl终浓度达到200 mmol/L为止,每3 d浇灌一次,盐胁迫持续28 d。每周定期拍照记录生长情况,统计植株的存活率;(2)接受干旱胁迫的植株,从第4周开始停止给水,其他生长条件不变,每周定期拍照记录生长情况,21 d后复水,复水3 d后统计植株存活率。每个株系每批种植36株(9株/盆×4盆),设3个生物学重复。
1.5 突变体和野生型植株中H2O2和MDA含量检测
将生长4周的拟南芥植株分为4组:第1组用200 mmol/L NaCl胁迫处理,分别于处理后的6 h、24 h、72 h和5 d取叶片;第2组干旱处理,分别在干旱5 d和10 d后取叶片;第3组热胁迫处理,在45℃的培养箱中放置2 h,然后立即取叶片;第4组作为对照。所有材料冻存于-80℃冰箱中备用。
利用南京建成生物工程研究所试剂盒测定H2O2、MDA和叶片总蛋白含量。
1.6 实验数据统计分析
统计数据用平均值(Mean)±标准差(SD)表示;用生物学统计软件SPSS 20.0进行单因素方差(One-way ANOVA)分析;用SigmaPlot 12.5软件制作柱状图。
2 结果与分析
2.1 拟南芥APX家族基因T-DNA插入纯合突变体筛选与鉴定
通过基因组DNA检测筛选出8个基因的纯合突变体,对其T-DNA插入位置进行分析。测序结果显示,突变体中T-DNA插入基因的第4个外显子,在翻译起始密码之后第803~804 bp之间(+803~+804);、、、、、和中T-DNA分别插入、、、、、和基因的第1个外显子、第7个内含子、第9个外显子、3¢UTR、第7个外显子、第1个外显子和5¢UTR (图1A)。RNA检测结果表明,8个突变体中相应基因的转录均被抑制(图1B)。APX活性检测发现,与野生型相比,、和3个突变体中酶活降低最显著(<0.01),、、和中APX活性也明显降低(<0.05),中无明显变化(图1C)。
2.2 拟南芥APX家族基因在不同发育时期的表达量
本研究对拟南芥APX家族8个基因在不同生长发育时期的表达量进行了分析,结果见图2所示。8个基因在第4、6和8周的表达量不同。、和在第4周表达量最高,此后逐渐减少,第8周最少,和在第4周和第8周的mRNA量有统计学差异(<0.05);、、和在第6周表达最多,第4周均多于第8周,和在第6周与第8周的表达量有统计学差异(<0.05);而随着植株成熟以及衰老mRNA表达量不断增加,第4周最少,第8周最多,且两个时期之间有统计学差异(<0.05)。除与生长发育周期有关外,在相同时期,各个基因的表达量也有较大差别。无论第4、6还是第8周,的表达量均最多,平均为80 REU;表达量最少,均小于0.2 REU;其次为,mRNA量在0.25~ 0.45 REU之间;和在3个检测期的表达无统计学差异,约为25 REU,介于6~ 9 REU之间;在3个检测期的表达差异比较大,尤其是第4、6周与第8周之间(<0.05),介于4~ 15 REU间;的差异最大,第4周表达量高达65 REU,而第8周小于10 REU (<0.01)。
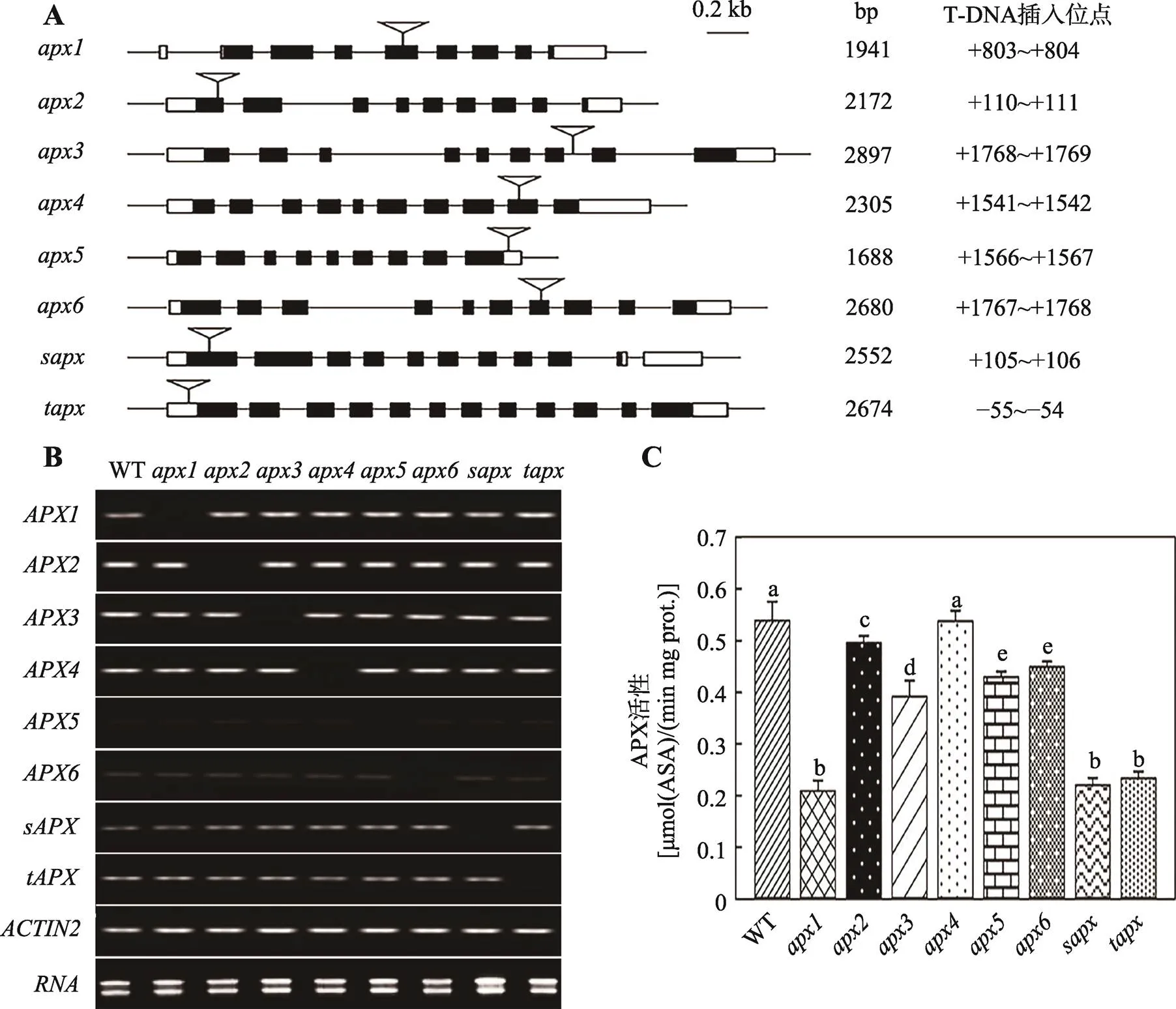
图1 纯合突变体筛选与鉴定
A:突变体中T-DNA精确插入位点。黑色方框代表基因的外显子,黑色方框之间的细线代表内含子,白色方框代表UTR区,倒三角形指示的位置为T-DNA插入位点;表示缺失突变体,1941 bp表示基因的mRNA长,其他以此类推;0.2 kb表示长度比例;最右边是T-DNA在每个基因中的精确插入位置;B:突变体中相应基因的mRNA表达情况;C:突变体和野生型株系的APX活性。误差线上方用不同的小写字母(a~e)标示代表彼此间有统计学差异(<0.05),若用相同字母标示说明无统计学差异。
2.3 盐、渗透和热胁迫对拟南芥APX家族基因表达的影响
为更好地了解基因表达与非生物逆境的相关性,本研究对8个s在盐、渗透和热胁迫条件下的表达响应进行了研究。如图3A所示,用200 mmol/L NaCl处理4 h后,8个基因均表达上调,其中、和受到明显诱导表达(< 0.05);在盐处理8~24 h之间,、、和处于明显诱导表达状态(<0.05)。8个s中,受盐诱导最强,胁迫24 h时,其相对表达量为对照组的3.67倍。用300 mmol/L甘露醇处理后,表达下调,、、、、和的表达量明显增加(<0.05) (图3B)。热胁迫对的影响最显著,除外,其他均表现出明显诱导表达(<0.05),尤其是。热处理0.5 h后,基因的相对表达量上升了573倍,其最高诱导表达量达790倍;和也受到较强的热诱导,其最高诱导表达量分别为4.9倍和4.6倍(图3C)。
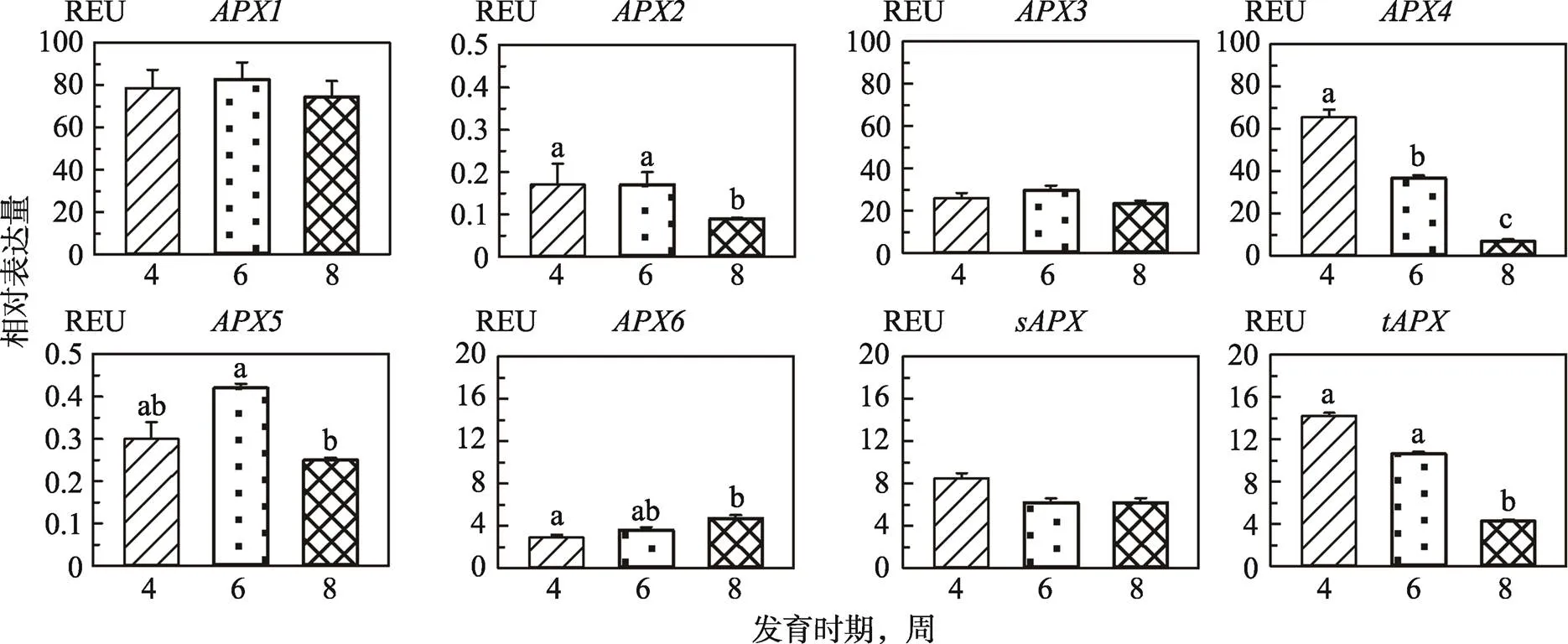
图2 拟南芥APX家族基因在不同发育时期的表达量
误差线上方不同的小写字母(a~c)代表彼此间有统计学差异(<0.05),用相同字母标示或无标示则代表无统计学差异。
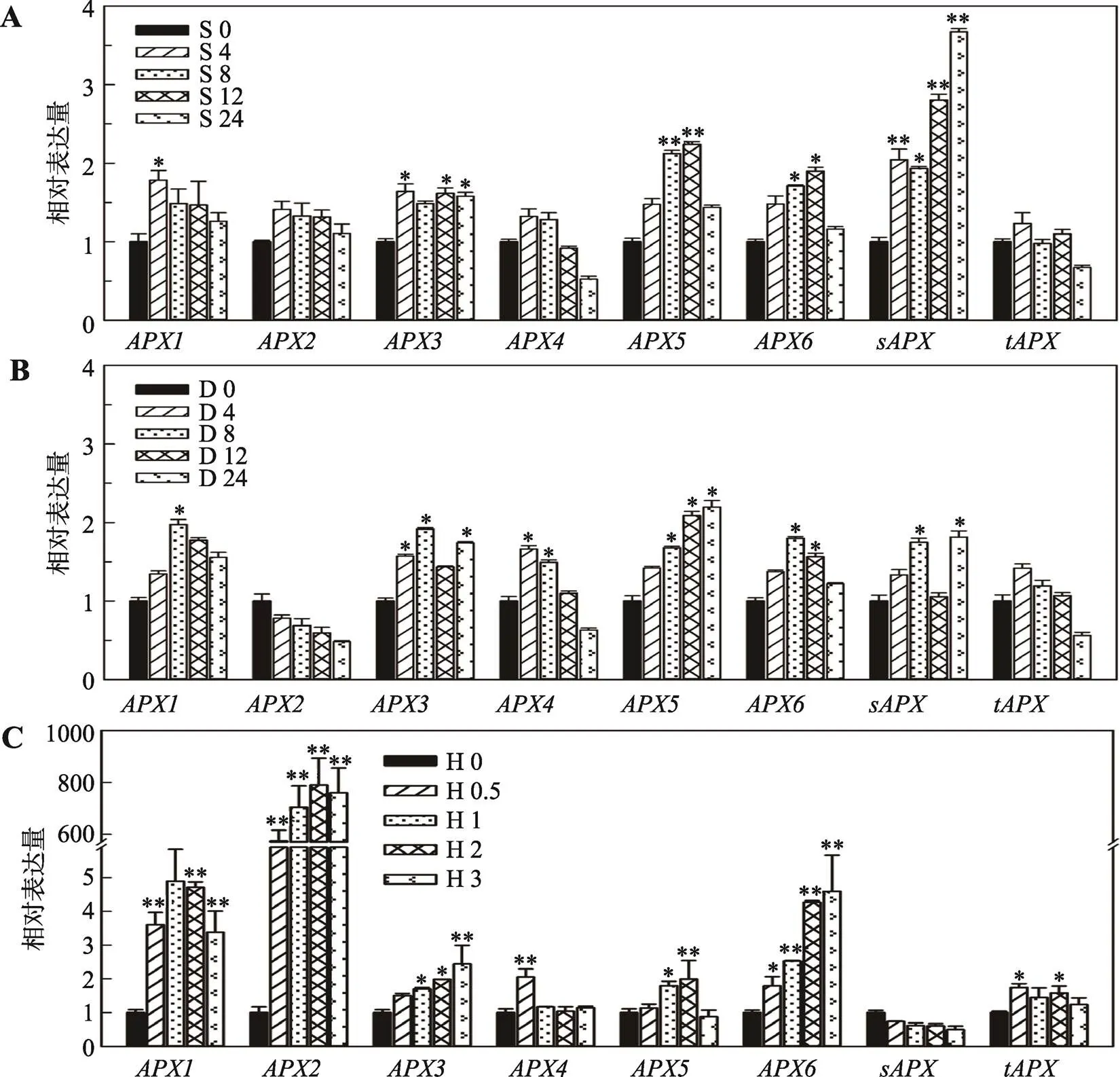
图3 拟南芥APX家族基因对盐、渗透和热胁迫的响应
A:盐胁迫下基因的表达量。S0、S4、S8、S12和S24表示盐胁迫处理时间(h);B:渗透胁迫下基因的表达量。D0、D4、D8、D12和D24表示渗透胁迫处理时间(h);C:热胁迫下基因的表达量。H0、H0.5、H1、H2和H3表示热胁迫处理时间(h)。*表示处理组与对照组之间存在统计学差异:*表示<0.05,有统计学差异;**表示<0.01,有显著的统计学差异。
2.4 apx突变体在萌发期以及幼苗生长期对盐和渗透胁迫的耐受性
在含50、100、150或200 mmol/L NaCl的MS固体培养基上萌发并生长10 d的拟南芥幼苗的表型和统计结果见图4。当NaCl浓度为50 mmol/L时,所有突变体与野生型种子的萌发情况无明显差别;而与野生型相比,、和的根长生长受到明显抑制(<0.05)当NaCl浓度为100 mmol/L时,突变体与野生型、胁迫处理组与对照组的胚根萌发率依然无统计学差异,但根生长均受到明显抑制。当NaCl浓度为150 mmol/L时,25%~30%的突变体、40%的野生型种子可萌发。在200 mmol/L NaCl环境中,约5%的野生型种子能萌发,而所有突变体均被抑制(<0.01)。
*表示处理组与对照组(CK)之间存在统计学差异:*表示P<0.05,有统计学差异;**表示P<0.01,有显著的统计学差异。
此外,在含100、200、300或400 mmol/L甘露醇的MS固体培养基上萌发并生长10 d的结果显示(图4),甘露醇对拟南芥种子的萌发和幼苗根生长有抑制作用,且随着甘露醇浓度增加,抑制作用增大。当甘露醇浓度为100 mmol/L时,野生型拟南芥的萌发率为94%,突变体的萌发率介于63% ()~ 92.9% ()之间;幼苗的根生长受到抑制,但突变体和野生型幼苗的根长无统计学差异。当甘露醇浓度高达400 mmol/L时,42%的野生型、1%的和突变体的胚根可萌发,其余突变体的萌发均被抑制。
2.5 apx突变体在营养生长后期以及生殖发育期对盐和干旱胁迫耐受性
盐胁迫处理结果如图5A和5B所示,盐处理前和处理7 d后突变体与野生型(WT)的生长状况没区别;胁迫14 d时,所有植株的叶片开始干枯,部分植株死亡,死亡率最高,约3.7%。21 d时,叶片干枯现象更严重,大量植株死亡,存活率为51.9% ()~ 75.7% (WT)不等。当盐胁迫持续到28 d时,大部分植株死亡,的存活率最低,仅为11.1%;WT存活率最高,为33.6%。
干旱胁迫处理结果如图5C和5D所示,干旱处理7 d之前,突变体和野生型植株的生长状况无明显变化;14 d时,叶片开始干枯;21 d时,植株明显萎蔫。复水3 d后,40.7%的野生型植株恢复生长;大部分突变体死亡,尤其和,存活率分别为4.6%和7.4% (<0.01)。
2.6 盐、干旱和热胁迫对植株H2O2和MDA含量的影响
通过叶片H2O2含量检测发现,在对照条件(即未经受逆境胁迫)下,植株H2O2含量较低,所有突变体和野生型之间均无统计学差异(图6)。盐胁迫使H2O2含量增加,且随着胁迫时间延长以及胁迫强度增加,H2O2含量持续上升;除外,其他突变体与野生型均有较大差异(<0.05),尤以、和最明显(图6A)。干旱处理5 d对植株H2O2含量无影响;干旱胁迫10 d后,所有植株H2O2含量均显著上升,突变体明显高于野生型(<0.05),其中仍以、和最高(图6B)。热胁迫2 h可导致叶片中H2O2含量大幅增加,、和的H2O2含量明显高于野生型(<0.05),尤其,其H2O2含量高达野生型的5.86倍(图6B)。
经受非生物胁迫后,植株中氧化蛋白的含量也升高,但没有H2O2含量升高明显。盐胁迫6 h和24 h时,、和的MDA含量增加较野生型明显(<0.05);当盐胁迫达到72 h以上时,所有植株MDA含量明显增加,且突变体与野生型有统计学差异(<0.05),其中仍以、和最高(图6A)。干旱处理5 d和10 d后,叶片MDA含量均增加,但突变体与野生型之间无统计学差异(图6B)。热处理2 h后,所有植株MDA含量显著增加,其中,、和显著高于野生型和其他突变体(<0.05) (图6B)。
3 讨论
3.1 拟南芥不同发育时期APX家族基因的表达分析
细胞质定位的APX1参与很多生物学过程[3,25],其在植物的根、茎、叶以及其他许多组织中组成性表达[17]。本研究通过系统分析进一步证实了这一结论,在不同生长发育时期的拟南芥叶片均保持高水平的表达量,且无统计学差异。对成熟番茄小孢子进行转录组分析,发现的表达量低到几乎无法检测[18,26]。李泽琴[19]对拟南芥的研究也得到了相同的结果,通过半定量RT-PCR在成熟拟南芥叶片中检测不到的表达[19]。
有关和在植物生长发育过程中的作用目前还未见报道。本研究通过qRT-PCR检测,发现与相似,在拟南芥正常生长发育过程中表达量非常低;此外,功能缺失对拟南芥萌发以及幼苗生长均无显著影响。这些结果表明,、和在植物正常生长发育过程中所起的作用较小。和随着发育进程表达量逐渐减少,进一步印证了随着植物衰老,这两个蛋白起的作用逐渐变小[20]。Chen等[12]研究表明,拟南芥在种子后成熟期的表达量非常高[12];本研究首次发现,随着植株成熟以及衰老,拟南芥叶片表达量呈显著上升趋势。这些结果说明,APX6可能在植物衰老以及种子后成熟-干燥期起着非常关键的作用。从本研究结果可以看出,的表达量比较稳定,可能与其功能有很大关系;定位于叶绿体,而叶绿体是植物进行光合作用的细胞器。光合作用会产生大量的活性氧,因此需要持续表达,以维持细胞内的活性氧稳态。
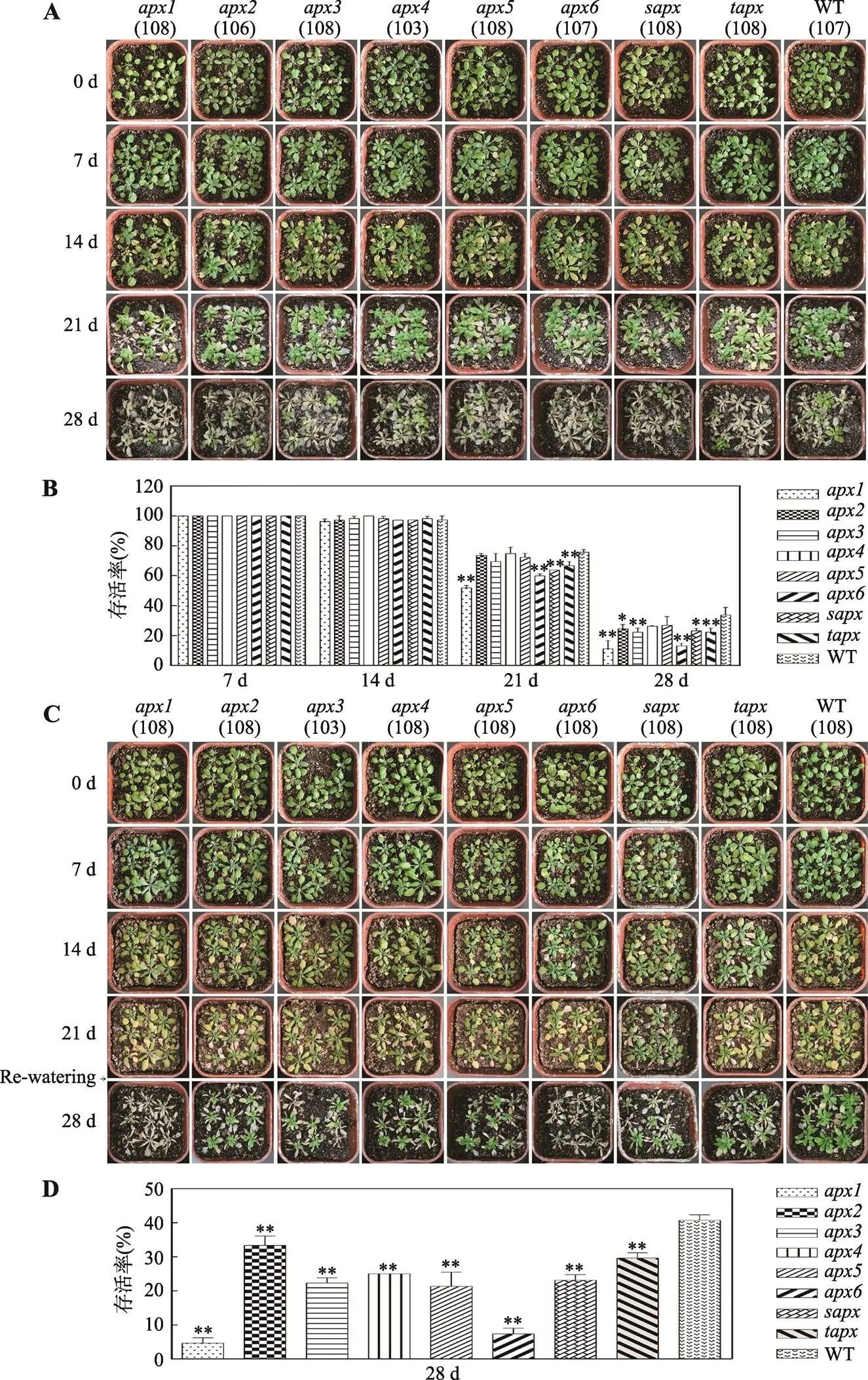
图5 拟南芥apx突变体和野生型植株在盐胁迫和干旱胁迫下的生长状况以及存活率
A:拟南芥突变体和野生型植株在盐胁迫下的生长状况;B:拟南芥突变体和野生型植株在盐胁迫不同时期的存活率;C:拟南芥突变体和野生型植株在干旱胁迫下的生长状况;D:拟南芥突变体和野生型植株在干旱胁迫下的存活率。A和C括号中的数字表示统计的植株(野生型或突变体株系)总数。*表示突变体与野生型(WT)之间存在统计学差异,<0.05;**表示突变体与野生型(WT)之间存在显著的统计学差异,<0.01。
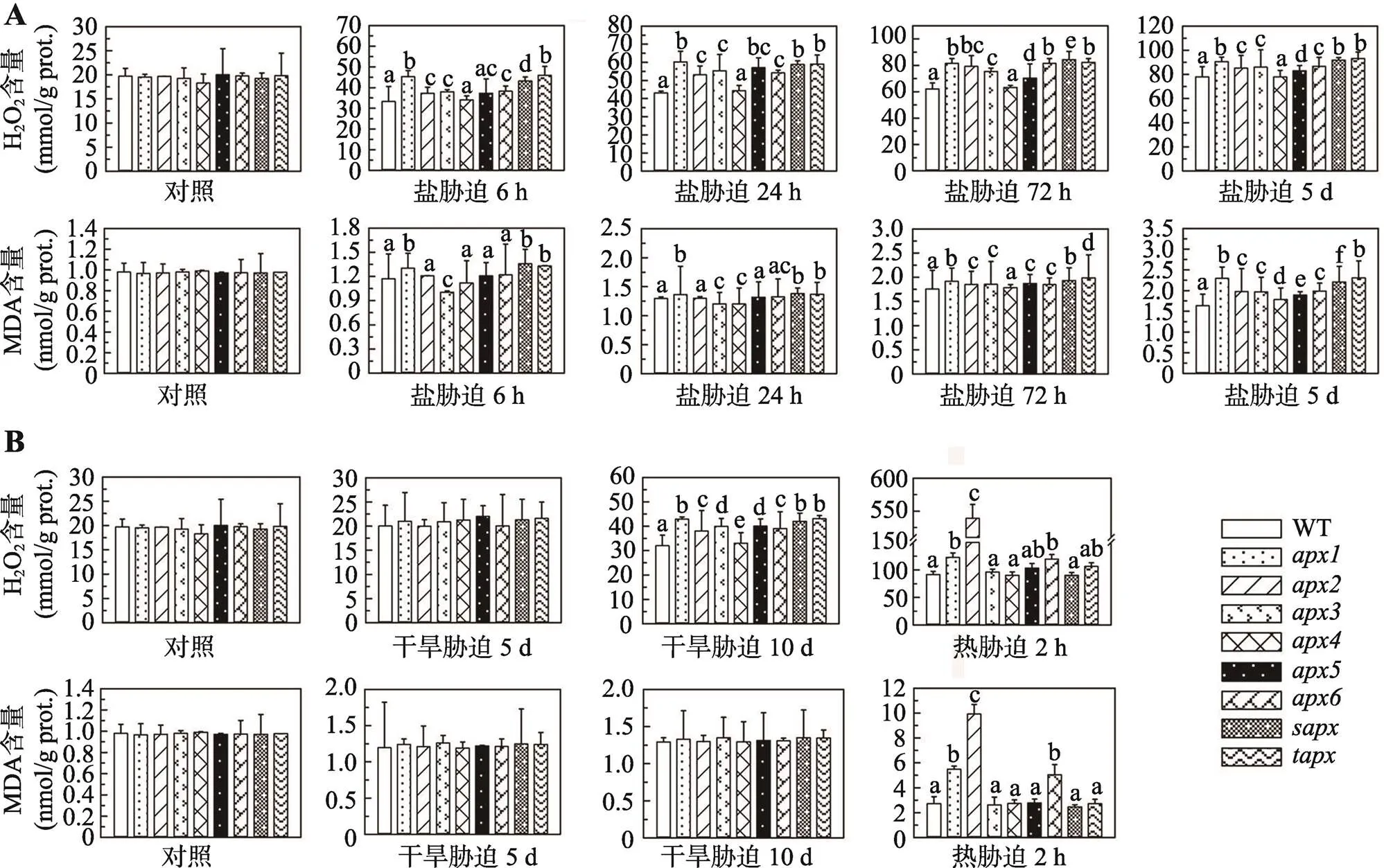
图6 盐、干旱和热胁迫下,apx突变体和野生型拟南芥中H2O2和MDA含量变化
A:盐胁迫下,突变体和野生型拟南芥中H2O2和MDA含量变化;B:干旱和热胁迫下,突变体和野生型拟南芥中H2O2和MDA含量变化。误差线上方不同的小写字母标示代表彼此间有统计学差异(<0.05),若无标示或用相同字母标示则代表无统计学差异。
3.2 拟南芥APX家族基因在非生物逆境胁迫中的作用
在各种生物或非生物胁迫响应中,拟南芥的表达量会显著上调[17]。有研究表明,在不同的细胞器中APX1的功能与ROS信号通路紧密相连;在整个细胞中,APX1参与ROS含量的调控[3,25,27]。本研究结果表明,在盐、干旱和热胁迫响应过程中均有重要作用。此外,在受到非生物胁迫后,突变体中与活性氧代谢相关的基因和的表达量发生显著变化[19],该结果进一步证明APX1在ROS含量调控以及ROS信号通路中的重要作用。
APX2位于细胞质,在拟南芥中又称为APX1B,它也参与植物对非生物逆境胁迫的响应[18]。本研究结果与多篇文献报道均表明,植物中的表达量极低,但当处于高温环境中时,植物根、茎、叶和花粉中的受到明显的诱导表达[17,26]。研究表明,在植物不同的发育阶段,APX2在热胁迫响应过程中起着非常重要的调节作用[26,28~31]。李泽琴[19]研究表明在热处理2 h后,与野生型相比,突变体叶片中、、、和等基因的表达显著上调。当经受机械损伤和氧化胁迫时,植物根中的表达明显上调;在响应盐和渗透胁迫时,植物根和茎中的表达明显上调[17]。本研究也有不同的发现,拟南芥叶片在盐胁迫下表达上调,而渗透胁迫下表达下调,且突变体对盐和渗透胁迫的耐受性降低。一个组成型高表达的突变体植株对干旱胁迫有较强的耐受性,且体内ABA水平较高[32]。此外,在盐胁迫下,突变体中、、、和的表达显著上调,而和的表达显著下调[19];在渗透胁迫下,突变体中、、和的表达显著上调,而、、、和的表达显著下调[19],说明APX2在盐和渗透胁迫响应过程中均起到响应逆境胁迫的调节作用。而强光照射下,植物维管和维管束鞘细胞的表达受到抑制,并受到H2O2、ABA和叶片含水状态等因素的调控[33~35]。综合这些结果,说明APX2在植物逆境响应过程中具有不可或缺的作用。
有关拟南芥过氧化物酶体APX的研究报道非常少。Wang等[36]发现过表达拟南芥的烟草对氨基三唑(除草剂)的耐受性增强;Yan等[37]发现过表达的烟草在适度干旱条件下种子产量增加。功能缺失后,与野生型相比,突变体的生长和发育无明显影响;即使在高温、低温或低盐条件下,也无主要的形态或生物量区别[21]。本研究发现,明显受到盐、热和渗透胁迫诱导表达,且的抗逆能力下降。这些研究表明,APX3在植物抗逆中的功能仍需进一步探讨。
目前,有关APX5的功能研究还未见报道。本研究发现,在正常生长条件下,的表达量低到无法检测到;但功能缺失后,突变体的抗逆能力明显下降,说明可能参与一些信号网络调控。
之前一直认为APX4与APX3和APX5一样,是过氧化物酶体定位的蛋白质[24],但最近几年的研究表明,APX4与tAPX同样存在于叶绿体的类囊体中,位于类囊体腔内[22,23]。APX4既不能与亚铁血红素或抗坏血酸结合,也不具有过氧化物酶活性,将基因突变后,植株的APX总活性无明显变化[22,24]。尽管如此,也有研究表明拟南芥基因突变后,幼苗表现出子叶萎黄,H2O2积累;种皮属性发生变化,最终导致种子的透性、保护性、品质和寿命均发生变化[23]。本研究发现,高浓度的NaCl和甘露醇对突变体的种子萌发、子叶、真叶和根生长均有较明显影响;长时间的盐和干旱胁迫也会促进突变体植株死亡。
Chen等[12]的研究结果表明,拟南芥在种子后成熟期的表达量非常丰富,突变体种子中积累较多的活性氧,种子氧化损伤严重,在土萌发率降低,当种子受到渗透胁迫、盐胁迫或热胁迫时这种伤害更加严重,突变的成熟种子在热胁迫条件下的萌发活力降低。本研究发现APX6对植物的抗逆性有影响;在盐或干旱(渗透)胁迫下,突变体种子萌发率降低,且植株的生命力明显减弱。因此,在拟南芥非生物胁迫响应过程中有重要作用。
研究表明,在光氧化胁迫下叶绿体APX对植物光合系统的保护和基因表达调控具有重要作用,但sAPX还是tAPX起主要作用并不清楚[38]。Maruta等[39]发现,在光氧化胁迫下,sAPX和tAPX不仅可以保护光合系统,同时可以调节H2O2响应基因的表达,其中tAPX的作用更加显著。本研究发现,在热胁迫下比容易受到诱导表达;而在响应盐和干旱胁迫的过程中,比更明显受到诱导表达;成熟突变体植株的抗旱能力比植株弱。这些结果可以说明,sAPX在响应盐和干旱胁迫过程中的作用更显著。
综上所述,本研究通过对拟南芥APX家族8个基因的系统分析发现:在拟南芥正常生长发育过程中,和的表达量比较稳定,一直处于最高水平;和的表达量极低,几乎无法检测到其表达量;、和随着发育进程表达量逐渐下降,而的表达量却随着植株发育成熟至衰老显著增加。在非生物逆境胁迫响应过程中,和对盐、干旱和热胁迫均有响应,但热诱导表达量更多;积极响应热胁迫,对盐和干旱胁迫的应答不明显;和对3种胁迫均表现出明显应答;积极响应盐胁迫,而对盐胁迫无应答反应只对热胁迫表现出一定反应。拟南芥的任意一个基因的单突变,基本不影响植株的正常生长发育过程,但是与野生型相比,突变体植株的抗逆性都明显降低。这些结果充分说明,在拟南芥生长发育的每个阶段,都有特定的几种APX起主要作用;而在逆境胁迫响应过程中,8个APX会在相同或不同的信号通路中发挥各种作用。
附录:
附表1见文章电子版www.Chinagene.cn。
[1] Akbudak MA, Filiz E, Vatansever R, Kontbay K. Genome- wide identification and expression profiling of ascorbate peroxidase () and glutathione peroxidase () genes under drought stress in Sorghum (L.)., 2018, 37(3): 925–936.
[2] Asada K. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons., 1999, 50(1): 601–639.
[3] Davletova S, Rizhsky L, Liang H, Shengqiang Z, Oliver DJ, Coutu J, Shulaev V, Schlauch K, Mittler R. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of., 2005, 17(1): 268–281.
[4] Foyer CH, Shigeoka S. Understanding oxidative stress and antioxidant functions to enhance photosynthesis., 2011, 155(1): 93–100.
[5] Maruta T, Sawa Y, Shigeoka S, Ishikawa T. Diversity and evolution of ascorbate peroxidase functions in chloroplasts: More than just a classical antioxidant enzyme?, 2016, 57(7): 1377–1386.
[6] Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K. Regulation and function of ascorbate peroxidase isoenzymes., 2002, 53(372): 1305–1319.
[7] Huang L, Jia J, Zhao X, Zhang M, Huang X, E Ji, Ni L, Jiang M. The ascorbate peroxidaseis a direct target of a zinc finger transcription factor ZFP36 and a late embryogenesis abundant protein OsLEA5 interacts with ZFP36 to co-regulatein seed germination in rice., 2017, 495(1): 339–345.
[8] Passardi F, Bakalovic N, Teixeira FK, Margis-Pinheiro M, Penel C, Dunand C. Prokaryotic origins of the non-animal peroxidase superfamily and organelle-mediated transmission to eukaryotes., 2007, 89(5): 567–579.
[9] Ribeiro CW, Korbes AP, Garighan JA, Jardim-Messeder D, Carvalho FEL, Sousa RHV, Caverzan A, Teixeira FK, Silveira JAG, Margis-Pinheiro M. Rice peroxisomal ascorbate peroxidase knockdown affects ROS signaling and triggers early leaf senescence., 2017, 263: 55–65.
[10] Teixeira FK, Menezes-Benavente L, Galvão VC, Margis R, Margis-Pinheiro M. Rice ascorbate peroxidase gene family encodes functionally diverse isoforms localized in different subcellular compartments., 2006, 224(2): 300–314.
[11] Teixeira FK, Menezes-Benavente L, Margis R, Margis- Pinheiro M. Analysis of the molecular evolutionary history of the ascorbate peroxidase gene family: inferences from the rice genome., 2004, 59(6): 761–770.
[12] Chen C, Letnik I, Hacham Y, Dobrev P, Ben-Daniel BH, Vanková R, Amir R, Miller G. Ascorbate peroxidase6 protectsdesiccating and germinating seeds from stress and mediates cross talk between reactive oxygen species, abscisic acid, and auxin., 2014, 166(1): 370–383.
[13] Mittler R, Vanderauwera S, Gollery M, Van Breusegem F. Reactive oxygen gene network of plants., 2004, 9(10): 490–498.
[14] Chew O, Whelan J, Millar AH. Molecular definition of the ascorbate-glutathione cycle inmitochondria reveals dual targeting of antioxidant defenses in plants., 2003, 278(47): 46869–46877.
[15] Najami N, Janda T, Barriah W, Kayam G, Tal M, Guy M, Volokita M. Ascorbate peroxidase gene family in tomato: its identification and characterization., 2007, 279(2): 171–182.
[16] Li ZQ, Li JX, Zhang GF. Expression regulation of plant ascorbate peroxidase and its tolerance to abiotic stresses., 2013, 35(1): 45–54.李泽琴, 李静晓, 张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用. 遗传, 2013, 35(1): 45–54.
[17] Zimmermann P, Hirsch-Hoffmann M, Hennig L, Gruissem W. GENEVESTIGATOR.microarray database and analysis toolbox., 2004, 136(1): 2621– 2632.
[18] Suzuki N, Miller G, Sejima H, Harper J, Mittler R. Enhanced seed production under prolonged heat stress conditions inplants deficient in cytosolic ascorbate peroxidase 2., 2013, 64(1): 253–263.
[19] Li ZQ. The functional and regulatory mechanisms of theandand their promoters in response to abiotic stresses[Dissertation]. Beijing Normal University, 2016.李泽琴.和基因及启动子在植物逆境响应中的作用和调控机理研究[学位论文]. 北京师范大学, 2016.
[20] Panchuk II, Zentgraf U, Volkov RA. Expression of thegene family during leaf senescence of., 2005, 222(5): 926–932.
[21] Narendra S, Venkataramani S, Shen G, Wang J, Pasapula V, Lin Y, Kornyeyev D, Holaday AS, Zhang H. Theascorbate peroxidase 3 is a peroxisomal membrane-bound antioxidant enzyme and is dispensable forgrowth and development., 2006, 57(12): 3033–3042.
[22] Granlund I, Storm P, Schubert M, García-Cerdán JG, Funk C, Schröder WP. The TL29 protein is lumen located, associated with PSII and not an ascorbate peroxidase., 2009, 50(11): 1898–1910.
[23] Wang YY, Hecker AG, Hauser BA. The APX4 locus regulates seed vigor and seedling growth in., 2014, 239(4): 909–919.
[24] Lundberg E, Storm P, Schröder WP, Funk C. Crystal structure of the TL29 protein from: an APX homolog without peroxidase activity., 2011, 176(1): 24–31.
[25] Pnueli L, Liang H, Rozenberg M, Mittler R. Growth suppression, altered stomatal responses, and augmented induction of heat shock proteins in cytosolic ascorbate peroxidase ()-deficientplants., 2003, 34(2): 187–203.
[26] Frank G, Pressman E, Ophir R, Althan L, Shaked R, Freedman M, Shen S, Firon N. Transcriptional profiling of maturing tomato (L.) microspores reveals the involvement of heat shock proteins, ROS scavengers, hormones, and sugars in the heat stress response., 2009, 60(13): 3891–3908.
[27] Vanderauwera S, Suzuki N, Miller G, van de Cotte B, Morsa S, Ravanat JL, Hegie A, Triantaphylidès C, Shulaev V, Van Montagu MC, Van Breusegem F, Mittler R. Extranuclear protection of chromosomal DNA from oxidative stress., 2011, 108(4): 1711–1716.
[28] Shi WM, Muramoto Y, Ueda A, Takabe T. Cloning of peroxisomal ascorbate peroxidase gene from barley and enhanced thermotolerance by overexpressing in., 2001, 273(1): 23–27.
[29] Panchuk II, Volkov RA, Schöffl F. Heat stress-and heat shock transcription factor- dependent expression and activity of ascorbate peroxidase in., 2002, 129(2): 838–853.
[30] Larkindale J, Huang B. Thermotolerance and antioxidant systems in: involvement of salicylic acid, abscisic acid, calcium, hydrogen peroxide, and ethylene., 2004, 161(4): 405–413.
[31] Schramm F, Ganguli A, Kiehlmann E, Englich G, Walch D, von Koskull-Döring P. The heat stress transcription factor HsfA2 serves as a regulatory amplifier of a subset of genes in the heat stress response in., 2006, 60(5): 759–772.
[32] Rossel JB, Walter PB, Hendrickson L, Chow WS, Poole A, Mullineaux PM, Pogson BJ. A mutation affecting ascorbate peroxidase 2 gene expression reveals a link between responses to high light and drought tolerance., 2006, 29(2): 269–281.
[33] Fryer MJ, Ball L, Oxborough K, Karpinski S, Mullineaux PM, Baker NR. Control of ascorbate peroxidase 2 expression by hydrogen peroxide and leaf water status during excess light stress reveals a functional organisation ofleaves., 2003, 33(4): 691–705.
[34] Bechtold U, Richard O, Zamboni A, Gapper C, Geisler M, Pogson B, Karpinski S, Mullineaux PM. Impact of chloroplastic- and extracellular-sourced ROS on high light-responsive gene expression in., 2008, 59(2): 121–133.
[35] Galvez-Valdivieso G, Fryer MJ, Lawson T, Slattery K, Truman W, Smirnoff N, Asami T, Davies WJ, Jones AM, Baker NR, Mullineaux PM. The high light response ininvolves ABA signaling between vascular and bundle sheath cells., 2009, 21(7): 2143–2162.
[36] Wang J, Zhang H, Allen RD. Overexpression of anperoxisomal ascorbate peroxidase gene in tobacco increases protection against oxidative stress., 1999, 40(7): 725–732.
[37] Yan J, Wang J, Tissue D, Holaday AS, Allen R, Zhang H. Photosynthesis and seed production under water-deficit conditions in transgenic tobacco plants that overexpress anascorbate peroxidase gene., 2003, 43(4): 1477–1483.
[38] Kangasjärvi S, Lepistö A, Hännikäinen K, Piippo M, Luomala EM, Aro EM, Rintamäki E. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses., 2008, 412(2): 275–285.
[39] Maruta T, Tanouchi A, Tamoi M, Yabuta Y, Yoshimura K, Ishikawa T, Shigeoka S.chloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress., 2010, 51(2): 190–200.
The role analysis of APX gene family in the growth and developmental processes and in response to abiotic stresses in
Zeqin Li1, Jintao Li1, Jie Bing2, Genfa Zhang2
Oxidative stress caused by reactive oxygen species (ROS) is one of the major abiotic stresses in plants. Under adverse growth conditions, the incoordination of various metabolic processes in plant cells can result in increased hydrogen peroxide (H2O2), thus causing a variety of threats and injuries to plant cells. Ascorbate peroxidase (APX) is an important enzyme to remove H2O2in plants. In, there are eight APX gene family members, including‒,and. In this study, we analyzed the expression patterns of the eightgenes in the wild-type andmutant plants at different developmental stages and under different abiotic stress conditions. Meanwhile, the tolerance of eachmutant to salt, drought and heat stresses was studied. qRT-PCR analysis showed that during development (from 4 to 8 weeks old),andexhibited the highest and lowest expression levels, respectively. In addition, the expression levels of,anddecreased during development, while the expression ofincreased with the maturity of the plants. Moreover, under different abiotic stress conditions,,andwere significantly induced by heat stress,actively responded to salt stress, andandexhibited obvious responses to salt, drought and heat stresses. Further tolerance analysis showed that the resistance of allmutants to salt and drought stresses was lower than that of the wild-type plant at both germination and maturity stages. At germination stage, allmutants were more sensitive to drought stress than to salt stress. At maturity stage, theandmutants were more sensitive to salt and drought stresses than the wild-type and othermutant plants. The physiological indexes indicated that the H2O2content in all mutants, especially in the,and,was significantly higher than that in the wild type 10 days after drought stress treatment, the malondialdehyde (MDA) content in all mutants was significantly higher than that in the wild type 5 days after salt stress treatment, while heat stress treatment for 2 h resulted in a significant increase in the contents of H2O2and MDA in,and, especially in. Taken together, our study revealed that all eight APX members ofparticipate in the growth and developmental processes and the abiotic stress responses, with some specific APXs playing a major role in a certain process.
; ascorbate peroxidase (APX); reactive oxygen species (ROS); abiotic stress response
2019-02-08;
2019-04-27
国家自然科学基金项目(编号:81701868,31470399,31872672)和山西省重点研发计划项目(编号:201803D31069)资助[Supported by the National Natural Science Foundation of China (Nos. 81701868, 31470399, 31872672) and the Key Research and Development (R&D) Projects of Shanxi Province (No. 201803D31069)]
李泽琴,博士,讲师,研究方向:分子遗传学和法医物证学。E-mail: zeqin1988.happy@163.com
张根发,博士,教授,研究方向:植物抗逆分子生物学。E-mail: gfzh@bnu.edu.cn
10.16288/j.yczz.19-026
2019/6/12 14:28:13
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190612.1427.002.html
(责任编委: 张红生)

