D-松醇复配Mn2+对HepG2细胞胰岛素抵抗的调节及其作用机制
王 梦,张泽生,李雨蒙,刘亚萍,张文菱子
(天津科技大学食品工程与生物技术学院,天津 300457)
胰岛素抵抗是指各种原因使胰岛素促进葡萄糖摄取和利用的效率下降[1-2]。胰岛素抵抗不仅是II型糖尿病的发病基础,也是高血脂症及代谢综合症的共同病理基础[3-4]。因此缓解胰岛素抵抗是预防及改善II型糖尿病的重要环节[5-6]。HepG2细胞是与人体肝细胞极为相似的肝胚胎瘤细胞株[7-8],在高水平的胰岛素作用条件下,HepG2细胞表面胰岛素受体的数目下降。因此采用HepG2细胞建立胰岛素抵抗细胞模型,便于观察干预因素对胰岛素抵抗的直接影响[9-10]。
D-松醇是D-手性肌醇的一种甲基化衍生物,詹天荣等[11]和Kim等[12]研究结果表明,D-松醇具有类胰岛素的作用,它能够通过提高机体对胰岛素的敏感程度来缓解机体胰岛素抵抗现象,调控机体血糖水平,而且D-松醇在促进胰岛素功能的同时还可以为机体传输营养物质。D-松醇还具有抗肿瘤[13]、免疫调节[14]和抗炎症[15]等生物活性。有研究表明,D-松醇可与肝细胞受损后产生的半乳糖胺在Mn2+的螯合作用下,形成胰岛素第二信使[16],改善胰岛素抵抗症状。
胰岛素能调控糖代谢关键酶的基因表达,且胰岛素通过信号转导途径影响糖异生关键酶的活性,而胰岛素信号转导强度的增加或减少、发生障碍等均会影响胰岛素的敏感性[17-21]。AMPK 是糖代谢的主要调控分子,是胰岛素发挥生理效应的主要信号转导通路,因此可作为II型糖尿病、肥胖症和癌症的潜在治疗靶标[22-26]。
目前,关于D-松醇复配Mn2+缓解胰岛素抵抗和作用机制的研究未见报道。本实验通过胰岛素诱导HepG2细胞建立胰岛素模型,探究D-松醇复配Mn2+后的降血糖作用效果,并初步探讨其作用机制,为预防或延缓糖尿病及其并发症的发生发展提供理论依据。
1 材料与方法
1.1 材料与仪器
D-松醇 纯度95%,购于西安一品生物技术有限公司;食品级MnSO4科汉森(天津)食品添加剂公司;人肝癌细胞(HepG2) 中国科学院上海生命科学研究院细胞资源中心;胰岛素 北京鼎国昌盛生物技术有限责任公司;高糖DMEM培养基 美国Hyclone公司;胎牛血清 杭州四季青生物工程材料有限公司;青霉素-链霉素混合溶液、Trizol、cDNA合成试剂盒 北京索莱宝生物科技有限公司;四甲基偶氮唑盐(MTT) 美国Sigma公司;胰蛋白酶 美国Gibco公司;完全培养基组成成分:10%灭火胎牛血清、1%双抗、0.02%两性霉素葡萄糖,肝肌糖原测定试剂盒 南京建成生物工程研究院;PCR引物 北京鼎国昌盛生物技术有限责任公司合成。
Multiskan FC酶标仪、GSORVALL LEGEND MICRO 17R台式冷冻离心机 美国Thermo Fisher公司;MCO-15AC CO2培养箱 日本三洋电器公司。
1.2 实验方法
1.2.1 HepG2细胞的培养 冻存的HepG2细胞置于37 ℃恒温水中,迅速震荡冻存管,使细胞冻存液尽快融化,后吸取细胞悬液置于离心管中。经过复苏后转入细胞培养瓶中,加入完全培养基,于37 ℃、5% CO2培养箱中孵育培养,每隔24 h换液一次,待细胞贴壁80%以上时吸弃培养液,用pH7.2~7.4的PBS缓冲溶液清洗2遍,加入1 mL 0.25%的胰蛋白酶消化液均匀铺满瓶底消化30~60 s,吸弃消化液,加入4 mL细胞培养液轻轻吹打得到细胞悬液,按照1∶4的比例转至新的细胞培养瓶中培养,以完成细胞的传代[10]。每48 h进行一次传代操作,选择处于生长对数期的细胞进行实验。
1.2.2 HepG2细胞胰岛素抵抗模型的建立
1.2.2.1 不同浓度胰岛素对HepG2细胞增殖的影响 将处于对数期(24 h)的细胞浓度调至1×105个/mL转移至96孔培养板中,每孔100 μL。待细胞单层贴壁后弃去培养液,加入不同浓度的胰岛素溶液,胰岛素浓度分别为1×10-2、1×10-3、1×10-4、1×10-5、1×10-6mmol/L,并设立正常对照组,每组10个复孔,培养36 h。向每孔加入20 μL浓度为5 g/L的MTT溶液,培养箱内培养4 h后弃去混合溶液,加入150 μL二甲基亚砜溶液充分震荡10 min,酶标仪490 nm波长下扫描并记录结果。
1.2.2.2 胰岛素最佳作用浓度的确定 将处于对数生长期(24 h)的细胞浓度调至1×105个/mL,之后转移至96孔培养板中培养,每孔100 μL。待细胞单层贴壁后弃去培养液,加入不同浓度的胰岛素溶液(胰岛素浓度分别为1×10-2、1×10-3、1×10-4、1×10-5、1×10-6mmol/L,并设立正常对照组,每组10个复孔)。培养箱内培养36 h后弃去培养基,PBS清洗后加入无酚红DMEM培养液(不含血清)孵育24 h,取出96孔板。用葡萄糖测定试剂盒测定各孔培养基中葡萄糖含量,以无细胞的空白孔作为对照,计算各组细胞的葡萄糖消耗量。选择葡萄糖消耗量差值最大的胰岛素作用浓度为胰岛素最佳浓度。葡萄糖消耗量计算公式如公式1。
式(1)
式中:5.55为计算常数。
1.2.2.3 胰岛素最佳作用时间的确定 确定胰岛素最佳浓度后,重复上述方法,设立正常对照组和模型对照组,每组10个复孔,正常对照组加入正常DMEM 培养液,模型对照组加入含有最佳胰岛素浓度的DMEM培养液,分别培养24、36、48 h,测定各组的葡萄糖消耗量,选取模型对照组和正常对照组葡萄糖消耗量出现极显著性差异的时间为胰岛素的最佳作用时间。
1.2.2.4 HepG2细胞胰岛素抵抗模型稳定时间的确定 选用上述实验中胰岛素最佳作用浓度和时间来建立HepG2 细胞胰岛素抵抗模型。重复上述方法,正常对照组和模型对照组处理后换为无酚红DMEM 培养液,继续培养12、24、36 h,用葡萄糖测定试剂盒测定各组的培养液上清液中的葡萄糖含量,并计算各组的葡萄糖消耗量,来判定该胰岛素抵抗模型的稳定时间。
1.2.3 样品毒性实验(MTT实验) 选择处于对数生长期的细胞进行D-松醇和MnSO4毒性实验。首先将细胞浓度调至1×105个/mL并转移至96孔培养板中培养,每孔100μL。待细胞贴壁后吸去培养基,PBS 清洗两次。加入不同质量浓度D-松醇0、10、50、100、200、400、600、800 mg/L)和MnSO4(0、1、5、10、50、100 mg/L),每组设立10个复孔,每孔100 μL,培养24 h。向每孔加入20 μL 浓度为5 g/L的MTT溶液,继续培养4 h后弃去混合溶液,加入150 μL二甲基亚砜溶液充分震荡10 min,酶标仪490 nm波长下扫描并记录结果。评价不同受试样品的不同浓度对HepG2细胞增殖的影响。
1.2.4 样品对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响 选择处于对数生长期的细胞将浓度调至1×105个/mL并转移至96孔培养板中培养,每孔100 μL。按照1.2.2方法建立胰岛素抵抗细胞模型。实验样品设立正常对照组、模型对照组和D-松醇复配MnSO4不同剂量组(D-松醇浓度为50、100、200 mg/L;MnSO4浓度为1、5、10 mg/L;每组设10个复孔)。在样品处理24 h后采用葡萄糖氧化酶法检测培养液中葡萄糖含量,以不铺细胞的空白孔为空白对照,计算24 h后各组细胞的葡萄糖消耗量。
1.2.5 糖原含量的测定 选择处于对数生长期的细胞将浓度调至1×105个/mL并转移至6孔培养板中培养,每孔2 mL。按照1.2.2方法建立胰岛素抵抗细胞模型。实验样品设立正常对照组、模型对照组和D-松醇复配MnSO4不同剂量组(D-松醇浓度为50、100、200 mg/L;MnSO4浓度为1、5、10 mg/L;每组设2个复孔)。在样品处理24 h后采用硫酸蒽酮法检测细胞中糖原含量,以不铺细胞的空白孔为空白对照,计算24 h后各组细胞的糖原含量。公式如式2。
糖原含量(mg)=×M×A×10/1.11
式(2)
式中:10:测试过程中的稀释倍数;1.11:此法获得的葡萄糖含量换算成糖原含量的系数;M:标准管含量(mg);A:样品测试前稀释倍数。
1.2.6 实时荧光全定量分析(RT-PCR)实验 用PBS将细胞收集后采用Trizol法提取细胞RNA,反转录得到cDNA,再利用Real-time PCR法以GADPH为看家基因,检测各剂量组IRS-1、IRS-2、AMPKα-1、AMPKα-2、PGC-1α、PEPCK、G6Pase、GLUT4基因mRNA表达水平。PCR引物设计如表1所示,实验分组如表2所示。

表1 全定量PCR引物设计序列Table 1 Real-time PCR primer design sequences

表2 实验设计方案Table 2 Experimental design for grouping rats
1.3 数据处理
本实验所得数据均采用数理统计软件进行统计学分析,实验数据以“均值±标准偏差”(M±SD)表示,采用Duncans进行多重比较检验。组间分析采用t检验,p<0.05表示两组之间具有显著性差异,p<0.01表示两组之间具有极显著性差异。
2 结果与分析
2.1 HepG2细胞胰岛素抵抗模型建立
胰岛素诱导HepG2细胞建立胰岛素抵抗模型,结果如图1所示。由图1A可知,各实验浓度胰岛素对HepG2细胞的正常增殖无影响。故选用此系列实验浓度进行葡萄糖消耗量试验,由图1B可知,与正常对照组相比,当胰岛素浓度为1×10-3mmol/L时,细胞培养液中的葡萄糖消耗量极显著性降低(p<0.01),说明细胞产生显著的胰岛素抵抗现象,故建造HepG2细胞胰岛素抵抗模型时选用胰岛素的作用浓度为1×10-3mmol/L。
由图1C可知,与正常对照组相比,当胰岛素作用时间为24 h时,胰岛素样品组葡萄糖消耗量显著性降低(p<0.05),且在36 h时极显著性降低(p<0.01),说明细胞产生明显的胰岛素抵抗现象,故选取36 h为建造HepG2细胞胰岛素抵抗模型的最佳作用时间。
本实验在建立胰岛素抵抗模型基础上,对该模型的作用稳定时间进行了研究,采用1×10-3mmol/L浓度的胰岛素处理细胞36 h后,换成无酚红DMEM高糖培养基,分别于12、24、36 h后检测上清液中葡萄糖消耗量。结果如图1D所示,与正常对照组相比,12 h后上清液中葡萄糖消耗量出现显著性降低(p<0.05),24 h和36 h出现极显著性降低(p<0.01),说明该胰岛素抵抗模型在建模成功后36 h内稳定。
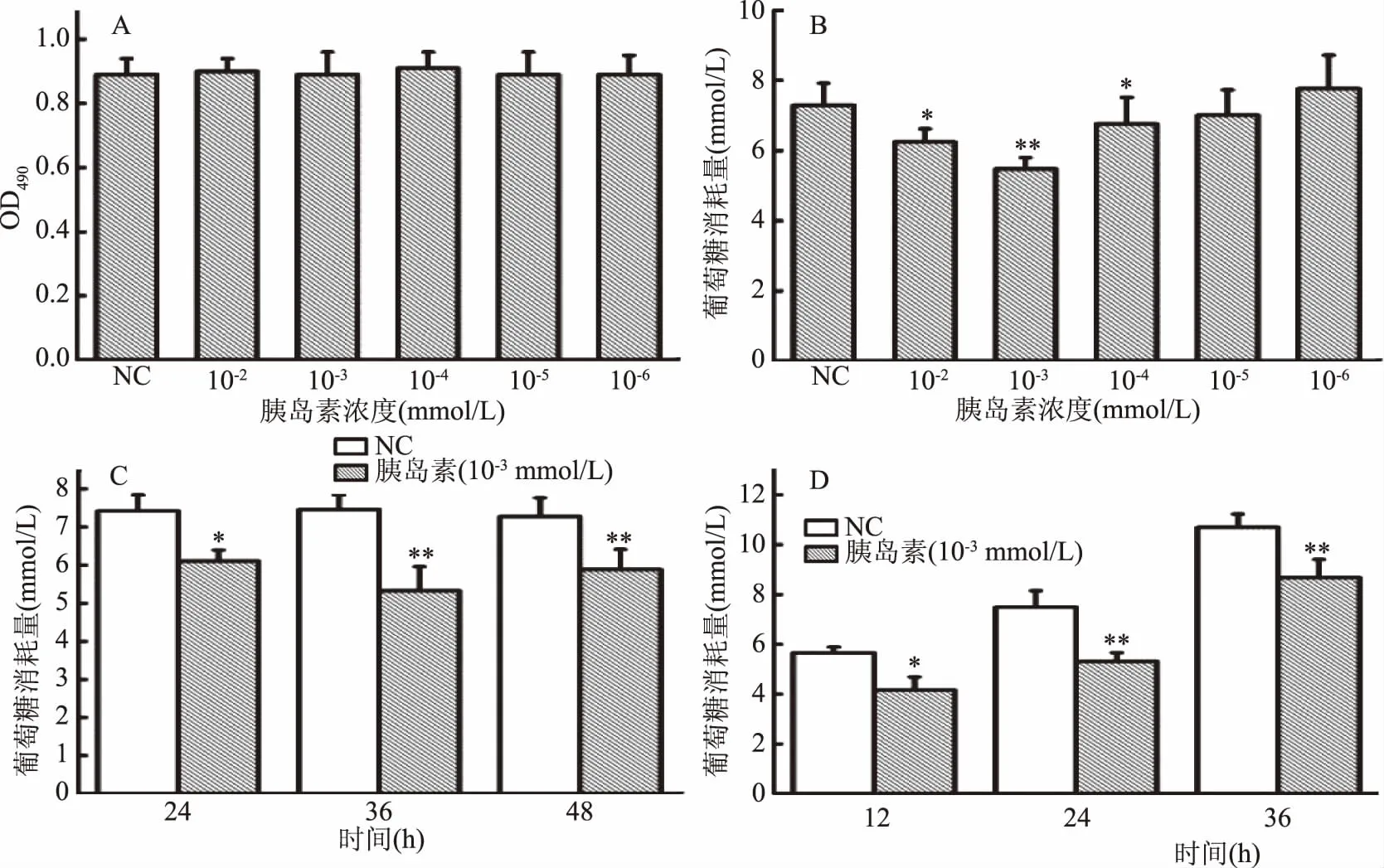
图1 HepG2细胞胰岛素抵抗模型实验结果Fig.1 Results of insulin resistance in HepG2 cells注:NC:正常对照组;*:p<0.05,与正常对照组比较具有显著性差异; **:p<0.01,与正常对照组比较具有极显著性差异;图2同。
2.2 受试样品对HepG2细胞增殖的影响
D-松醇和MnSO4对HepG2细胞增殖的影响如图2所示。由图2A可知,D-松醇浓度在0~400 mg/L范围内,各组在490 nm波长下的吸光度值无差异;浓度在600~800 mg/L范围内,各组的吸光度值略有升高,但无显著性差异。说明D-松醇在该浓度范围内对HepG2细胞的正常增殖无显著性影响,故后续实验所选用的D-松醇浓度在0~400 mg/L范围内。由图2B可知,MnSO4浓度在0~10 mg/L范围内,各组在490 nm波长下的吸光度值无显著性差异;浓度在50~100 mg/L范围内,各组的吸光度值极显著性降低(p<0.01)。说明MnSO4在0~10 mg/L浓度范围内对HepG2细胞的正常增值无显著性影响,在50~100 mg/L浓度范围时,抑制细胞正常增殖,故后续实验所选用的MnSO4浓度在0~10 mg/L范围内。
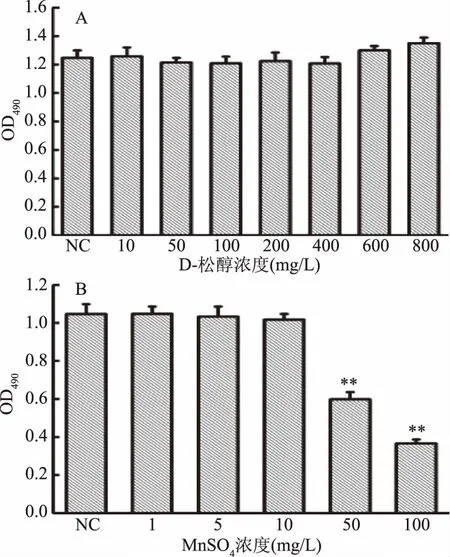
图2 D-松醇和MnSO4对HepG2细胞增殖的影响Fig.2 Effect of D-pinitol and MnSO4 on proliferation of HepG2 cells
2.3 受试样品对HepG2细胞葡萄糖消耗量的影响
D-松醇和复配MnSO4对HepG2细胞葡萄糖消耗量的影响如图3所示。由图3A可知,和正常对照组相比,模型对照组的葡萄糖消耗量极显著降低(p<0.01),说明造模成功,细胞产生胰岛素抵抗。和模型对照组相比,当D-松醇浓度为100~200 mg/L时,葡萄糖消耗量有升高趋势,但无显著性差异,而D-松醇浓度为400 mg/L时,葡萄糖消耗量极显著升高(p<0.01)。由图3B可知,和正常对照组相比,模型对照组的葡萄糖消耗量极显著降低(p<0.01),说明造模成功,细胞产生胰岛素抵抗。和模型对照组相比,当D-松醇浓度为100 mg/L时,复配MnSO4浓度为5 mg/L时,葡萄糖消耗量显著性升高(p<0.05),MnSO4浓度为10 mg/L时,葡萄糖消耗量极显著性升高(p<0.01)。
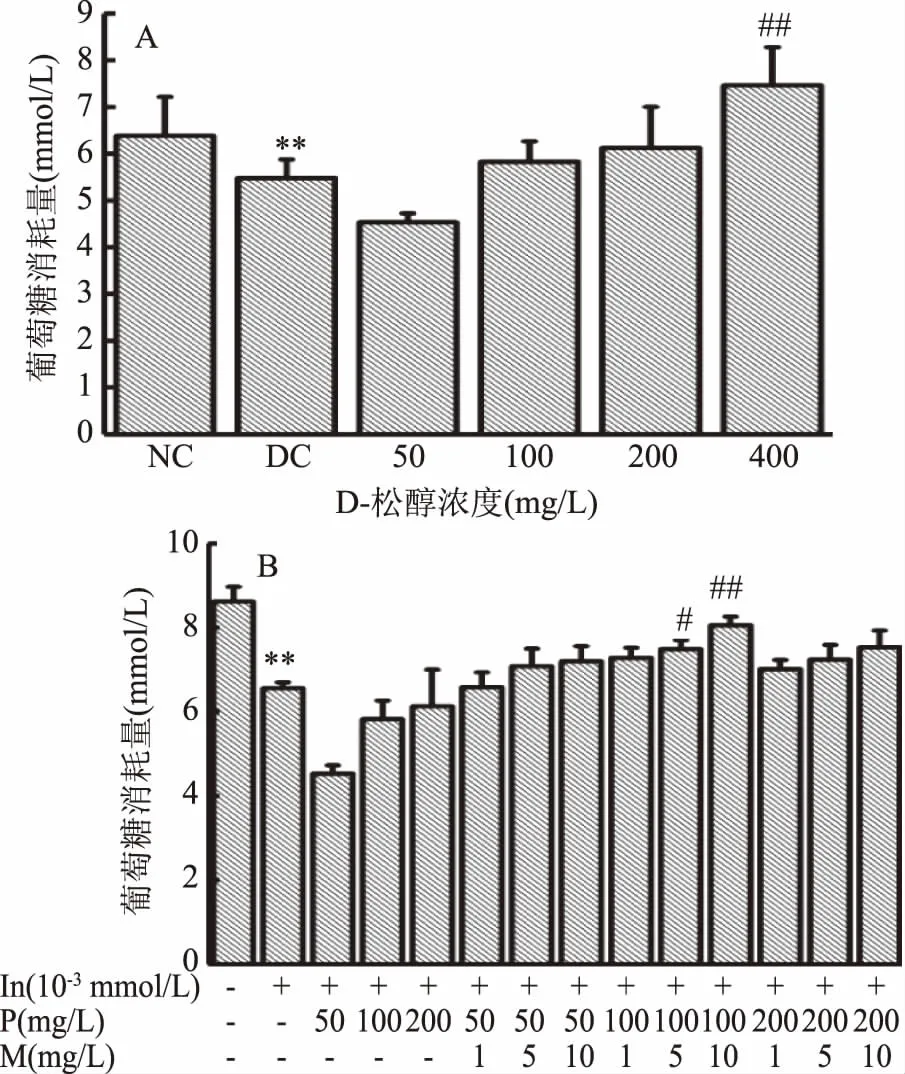
图3 D-松醇和复配MnSO4对HepG2细胞葡萄糖消耗量的影响Fig.3 Effects of D-pinitol and compound with MnSO4 on glucose consumption of HepG2 cells注:#:p<0.01,剂量组与模型对照组比较具有显著性差异; ##:p<0.01,剂量组与模型对照组比较具有极显著性差异; NC:正常对照组;DC:模型对照组;图4~图5同。
2.4 受试样品对HepG2细胞糖原含量的影响
D-松醇和复配MnSO4对HepG2细胞糖原含量的影响如图4所示。由图4A可知,与正常对照组相比,模型对照组糖原含量极显著性降低(p<0.01),说明细胞合成糖原能力下降,细胞造模成功。与模型对照组相比,当D-松醇浓度为50~200 mg/L时,糖原含量有升高趋势,但无显著性差异,而D-松醇浓度为400 mg/L时,糖原含量极显著升高(p<0.01)。由图4B可知,与正常对照组相比,模型对照组糖原含量极显著性降低(p<0.01),说明细胞合成糖原能力下降,细胞造模成功。和模型对照组相比,当D-松醇浓度为100 mg/L时,复配MnSO4浓度为5 mg/L时,糖原含量显著性升高(p<0.05),MnSO4浓度为10 mg/L时,糖原极显著性升高(p<0.01)。
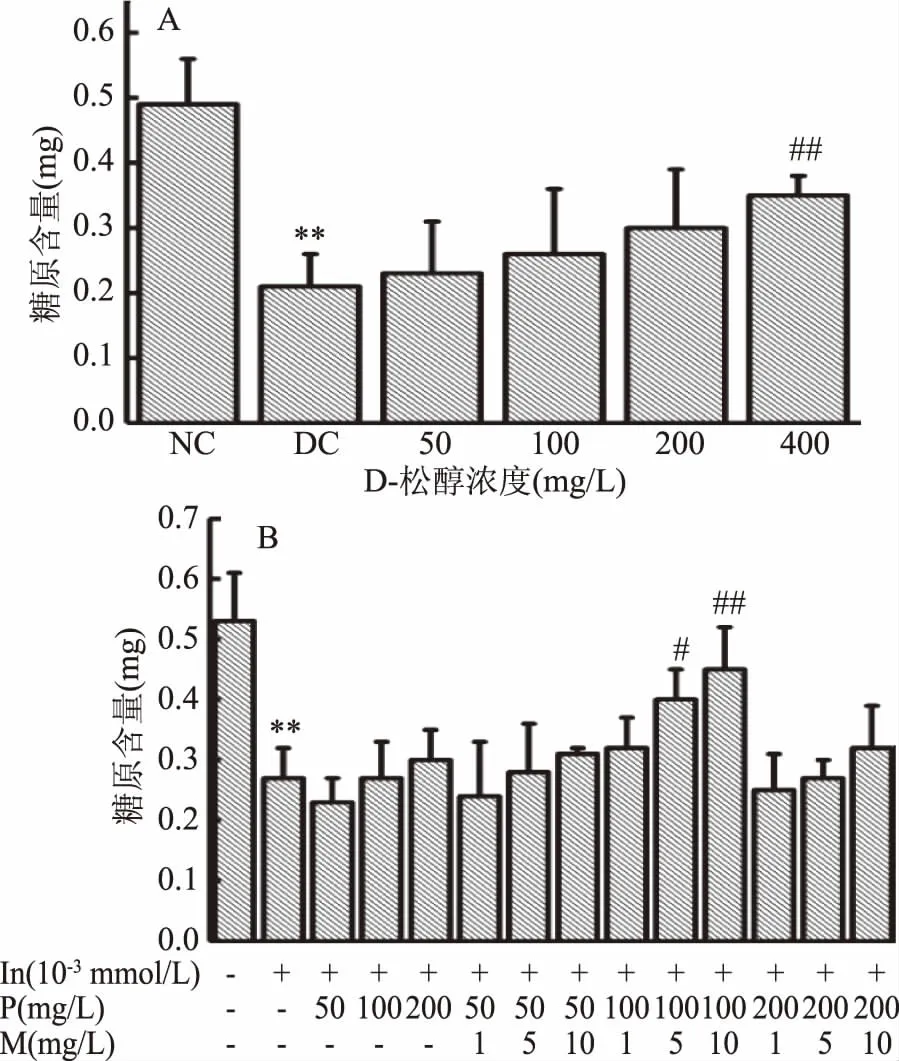
图4 D-松醇和复配MnSO4对HepG2细胞糖原含量的影响Fig.4 Effects of D-pinitol and compound with MnSO4 on glycogen content of HepG2 cells
2.5 受试样品对HepG2细胞相关基因表达的影响
如图5,与模型组相比,DP组各基因mRNA表达水平均未出现显著性变化;LPM组AMPKα-1、AMPKα-2和GLUT4基因mRNA表达水平显著上调(p<0.05),G6Pase基因mRNA表达水平显著下调(p<0.05);MPM组ISI-1、ISI-2、AMPKα-2和GLUT4基因mRNA表达水平显著上调(p<0.05),AMPKα-1基因mRNA表达水平极显著上调(p<0.01),同时,PEPCK基因mRNA表达水平显著下调(p<0.05),G6Pase基因mRNA表达水平极显著下调(p<0.01);HPM组ISI-1、ISI-2、AMPKα-1、AMPKα-2和GLUT4基因mRNA表达水平极显著上调(p<0.01),PGC-1α和PEPCK基因mRNA表达水平显著性下调(p<0.05),G6Pase基因mRNA表达水平极显著下调(p<0.01)。D-松醇复配Mn2+可激活IRS-1和IRS-2基因,促进下游基因的表达;激活AMPKα-1和AMPKα-2基因的磷酸化,促进糖酵解的发生;激活PGC-1α基因的磷酸化,降低激活糖异生关键酶造成肝糖输出的增加,进而改善胰岛素抵抗;激活PEPCK基因的磷酸化,进而促进糖异生;激活G6Pase基因的磷酸化,进而促进下游基因的表达,促进糖原分解;激活GLUT4基因的磷酸化,进而促进下游基因的表达,促进葡萄糖转运。
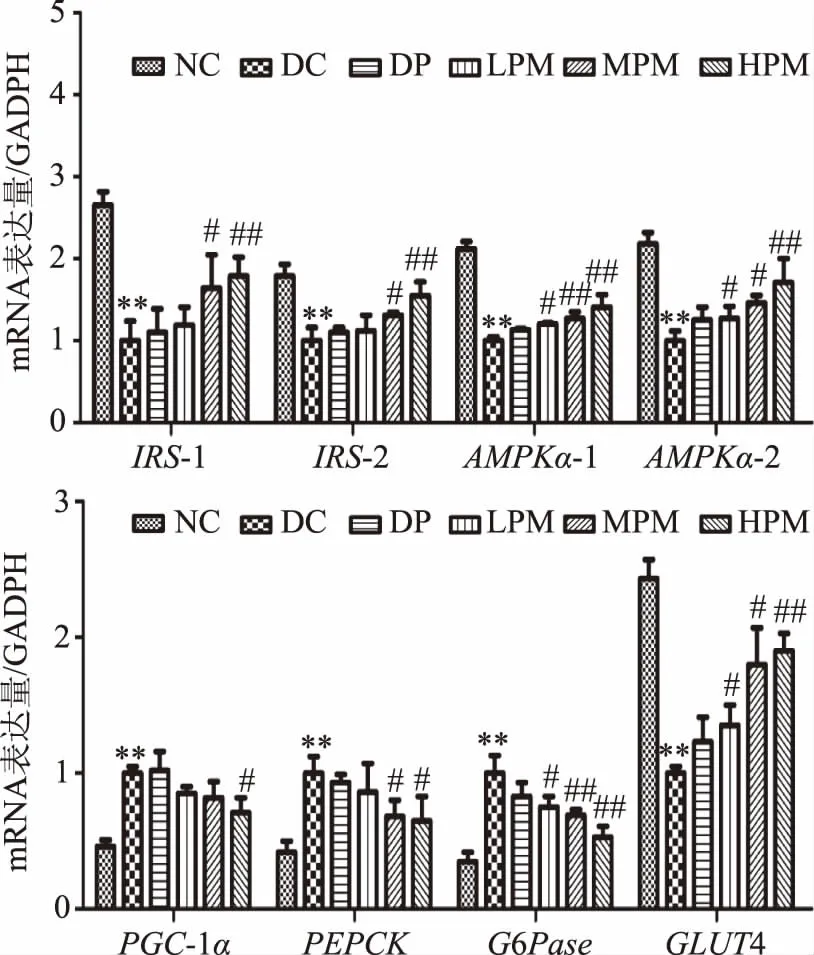
图5 受试样品对HepG2细胞相关基因mRNA表达水平的影响Fig.5 Effects of fermented beverage on the concentration of AMPK in gene level in HepG2 cells
3 结论
本实验采用胰岛素诱导HepG2细胞,对胰岛素作用浓度、作用时间和模型稳定时间进行研究,建立体外胰岛素抵抗模型。在胰岛素浓度为1×10-3mmol/L,作用时间为36 h时,细胞葡萄糖消耗量达到最低,产生最大的胰岛素抵抗效应。此时,进行D-松醇和复配MnSO4对HepG2细胞胰岛素抵抗影响的研究,结果表明,当D-松醇浓度为100 mg/L,复配MnSO4为10 mg/L时,可极显著的缓解胰岛素抵抗。此外,复配组AMPKα-1、AMPKα-2和GLUT4基因表达水平均显著上调(p<0.05),G6Pase基因mRNA表达水平显著下调(p<0.05)。AMPK对糖代谢具有广泛的影响,在促进葡萄糖转运,加强糖酵解以及抑制糖异生等生化反应中均发挥一定功能。
本实验结果为D-松醇复配Mn2+缓解HepG2细胞胰岛素抵抗提供科学依据,但本研究只局限于生理表层和基因表达方面,将来更需要通过蛋白质组学和代谢组学等实验对降血糖机制进一步评价分析,为D-松醇在食品工业中的研究开发提供进一步的理论帮助。

