miR-9-5p下调FRMD6促喉癌Hep2细胞存活的机制研究
程秀琴 谭元元 艾力根·阿不都热依木 唐 亮
喉癌作为头颈部最常见的呼吸道肿瘤之一,发生率位居第二,且以鳞状细胞癌最为多见。有研究显示,喉癌的发生率逐年攀升,每年约增长25%[1~3]。虽然近年来更先进的外科手术、化疗药物及放射疗法已广泛应用于喉癌的临床治疗,然而喉癌患者的总生存率并未得到改善,甚至有所下降[4]。研究发现,喉癌的发生、发展与Ras、c-myc、EFGR等致癌基因和 p53、Rb、p16等抑癌基因密切相关,但喉癌分子水平的发病机制仍不明确[5,6]。
miRNA是一类高度保守的长度约为22nt非编码RNA分子,被认为是一类新型的癌基因或者抑癌基因。miRNA芯片研究表明多种miRNA是喉鳞状细胞癌(LSCC)预后及诊断的独立影响因子,在LSCC发生、发展中起着促癌基因或者抑癌基因作用[7,8]。随着研究的不断深入,miR-9-5p在癌症中的作用逐渐见诸报道,如在宫颈癌和肺癌中,它被认为是致癌分子,但在胃癌、结肠癌等中有报道称它是一种抑癌剂[9~12]。但对于miR-9-5p及其在喉癌中的具体作用机制尚不清楚。FRMD 6是一种Ezrin/Radisin/Moesin(ERM)家族蛋白,是果蝇的人类同源性扩展(EX)基因,其控制细胞增殖、凋亡、组织再生和肿瘤发生。有研究发现FRMD 6可作为人乳腺癌细胞的肿瘤抑制剂,FRMD 6基因敲除能诱导乳腺上皮细胞间充质转化(EMT),即促进肿瘤细胞获得侵袭迁移的能力[13]。另有研究表明,FRMD6依赖或独立于Hippo信号通路发挥作用[14]。但目前在喉癌中未有FRMD6相关报道。
本团队在前期研究中通过实时定量PCR对喉癌中的miRNA差异表达进行初步筛选,并初步明确了miR-9-5p对喉癌Hep2细胞增殖的影响。为进一步研究miRNA与喉癌发生、发展的关系,笔者从miR-9-5p调控FRMD 6的表达进而影响喉癌Hep2细胞的存活来探讨分子水平的发病机制。
材料与方法
1.材料:(1)DMEM培养基、Opti-MEM、胎牛血清均购自美国Gibco公司; Trizol Reagent和Lipofectamine2000 Transfection Kit均购自美国Invitrogen公司;PrimeScriptTMRT reagent Kit with gDNA Eraser和SYBR®Premix Ex TaqTMⅡ购自日本TaKaRa公司; MTT购自Amresco公司;鼠抗人FRMD 6、YAP、β-actin单克隆抗体均购自美国Cell signaling technology公司; pcDNA3.1-luci载体和Dual-Luciferase®Reporter Assay System均购自美国Promega公司; hsa-miR-9-5p阴性和抑制剂送至吉玛公司进行合成。(2)人喉癌细胞株Hep2细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。收集笔者医院2010年1月~2017年8月32例原发性喉癌组织标本,患者年龄为43~75岁,所有患者术前均未接受放、化疗处理,均经病理证实为喉鳞状细胞癌,取癌和癌旁<1cm组织,于-80℃保存备用。
2.细胞培养和瞬时转染:人喉癌细胞株Hep2细胞用含10%胎牛血清的DMEM完全培养基于37℃,5% CO2细胞培养箱中常规进行培养。取处于对数生长期的Hep2细胞以1×105个细胞/孔接种于6孔板,每孔2ml培养基,于细胞培养箱中培养。转染前1h更换为无血清无双抗的DMEM培养基。将 7.5μl的Lipofectamine 2000转染试剂加入125μl的Opti-MEM 培养基中,轻轻混匀,室温静置5min。将各组对照抑制剂、miR-9-5p抑制剂、阴性对照及miR-9-5p阴性等按终浓度为100pmol加入125μl的Opti-MEM培养基中,混匀后室温孵育5min。将Lipofectamine 2000转染试剂稀释液和miR-9-5p阴性抑制剂稀释液充分混匀,室温孵育20min。将miR-9-5p-Lipofectamine 2000 复合物滴加6孔板中,每孔250μl,于细胞培养箱中培养, 4h后更换为有血清有抗生素的DMEM培养基,于37℃ 5%CO2培养箱中继续培养48h。
3. MTT法及细胞克隆形成检测细胞增殖:(1)MTT法:实验分组对照抑制剂、miR-9-5p抑制剂、FRMD6、miR-9-5p 抑制剂+FRMD6,将各组转染Hep2细胞48h后分别接种于96孔板中,每孔细胞密度为1×104。每组3份,每份1个板,设3个副孔。每组培养1、2、3、4、5天,孵育4h,取上清,添加150ml DMSO(美国Gibco公司),通过酶标仪检测各孔570nm波长的吸光度值(A)。计算细胞相对增殖率(P%):A(实验组)/A(空白对照组)×100%,同时绘制细胞生长曲线,实验重复3次。(2)克隆形成实验:实验分组对照抑制剂、miR-9-5p抑制剂、FRMD6、miR-9-5p抑制剂+FRMD6,将各组转染Hep2细胞48h后经胰酶消化后制成细胞悬液接种于平板中,在每60mm培养皿中植入1000个细胞,每隔3天更换培养基。7天后,在显微镜下观察细胞集落形成情况并进行数目统计。
4.实时荧光定量PCR实验:Hep2细胞分别转染对照抑制剂、miR-9-5p抑制剂、阴性对照、miR-9-5p阴性48h后,胰蛋白酶消化收集细胞,分别提取总RNA反转录合成模板cDNA,PCR引物序详见表1。每个样本3个复孔,按两步法PCR扩增,条件为:Step 1:95℃ 30s;Step 2:95℃ 5s,60℃ 30s(40个循环);Step 3: Melt Curve(美国Bio-Rad公司CFX96)。反应结束后确认RT-PCR的扩增曲线及溶解曲线是否满足要求,仪器软件中自动输出Ct值,计算相对表达量采用2-△△Ct方法。

表1 RT-PCR引物序列
5.Western blot法检测FRMD6蛋白水平的表达:Hep2细胞分别转染阴性对照、miR-9-5p 阴性48h后,收集各组细胞,分别提取总蛋白并测定蛋白浓度,处理好待测样品后取50μg蛋白进行SDS-PAGE电泳分离,转膜,将分离的蛋白电转至PVDF膜上。封闭液室温封闭1h,经FRMD6一抗孵育后,4℃过夜。TBST充分洗膜后,加入二抗(1∶2000)室温孵育1h,TBST清洗后显色液显色照相。
6.构建FRMD6基因3′-UTR荧光素酶报告基因重组载体:以FRMD6 wt 3′-UTR设计引物,引入XhoⅠ和XbaⅠ双酶切位点。引物序列上游5′-CCCTCGAGCAGAGAGATGATTGCTCTGTAT-3′,下游:5′-GCTCTAGACATCTGTTACTTGGATGTGGA-3′。从正常喉组织中提取模板,反转录得cDNA,并以其为模板进行PCR,反应条件:95℃/3min;95℃/10s,60℃/2min,30个循环;72℃/10min;4℃保存。PCR产物与pcDNA3.1-luci载体经双酶切纯化回收后连接过夜,经大肠杆菌转化获阳性克隆送上海生工生物技术有限公司测序。测序鉴定正确的重组子命名为pcDNA3.1-luci/FRMD6。再在重组子基础上设计突变引物进行PCR获得FRMD6 mut 3′-UTR重组子:上游序列5′-GGACCAATACGTATGTGACAGA-3′,下游5′-CTTGCTACAACCTTATGATT-3′,使用TaKaRa突变试剂盒进行PCR扩增,扩增产物通过转化大肠杆菌获得克隆,测序鉴定突变正确的重组子命名为pcDNA3.1-luci/FRMD6-mut。
7.双荧光素酶报告基因检测:取对数生长期293T细胞以1×105个细胞/孔接种于6孔板,每孔2ml培养基,于细胞培养箱中培养,将阴性对照、 miR-9-5p阴性分别与FRMD6 wt/mut 3′-UTR荧光素酶报告基因重组载体共转染293T。将 0.1μl Lipofectamine 2000转染试剂加入125μl的Opti-MEM 培养基中,轻轻混匀,室温静置5min。各组转染用量为:pcDNA3.1-luci/FRMD6 wt或mut 3′-UTR 50ng, 阴性对照或miR-9-5p阴性10pmol,以及海肾荧光Renilla 5ng分别加入到125μl Opti-MEM培养基中共转染,混匀后室温孵育5min。将Lipofectamine 2000转染试剂稀释液和各转染组稀释液充分混匀,室温孵育20min,将复合物滴加6孔板中于细胞培养箱中培养,4h后更换培养基,转染48h后收取细胞,用Promega公司的双荧光素酶报告基因试剂盒测定荧光素酶活性,计算相对荧光素酶活性值。
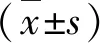
结 果
1.喉癌组织中miR-9-5p及FRMD6的表达:分别提取32例患者及对应癌旁组织样本总RNA并反转录得cDNA,RT-PCR结果如图1所示,与对照比较,喉癌组织中miR-9-5p表达显著增加(图1A),而FRMD6在喉癌组织中表达下降(图1B)。以上结果提示,miR-9-5p和FRMD6在人喉癌组织中可能发挥重要作用。

图1 miR-9-5p在人喉癌组织及Hep2细胞中表达
A.喉癌组织中miR-9-5p表达;B.喉癌组织中FRMD6表达
2.miR-9-5p与FRMD6对喉癌Hep2细胞增殖及凋亡的影响:如图2A所示,miR-9-5p 抑制剂转染Hep2细胞,RT-PCR结果显示抑制效果良好。将对照抑制剂、miR-9-5p抑制剂、FRMD6过表达载体、miR-9-5p抑制剂+FRMD6过表达质粒分别瞬转入Hep2细胞,依次在1、2、3、4、5天收集细胞测定A570值,MTT分析结果表明,与对照组比较miR-9-5p抑制剂显著抑制Hep2细胞增殖活力(P<0.05),FRMD6过表达后同样抑制了Hep2细胞增殖(P<0.05),而miR-9-5p抑制剂+FRMD6过表达共转后抑制效率显著高于单转染(P<0.05,图2B)。细胞克隆形成实验结果显示,与对照组比较,miR-9-5p 抑制剂及FRMD6过表达组Hep2细胞的增殖率比较,差异均有统计学意义(P<0.05),且miR-9-5p抑制剂+FRMD过表达组细胞增殖活力抑制效果最为明显(P<0.05,图2C)。此外caspase-3活性分析结果显示,miR-9-5p 抑制剂+FRMD6过表达组细胞凋亡率较单转染组显著升高(P<0.05,图2D)。以上结果表明,miR-9-5p过表达对喉癌细胞的增殖有促进作用,下调miR-9-5p则抑制细胞的存活率,且过表达FRMD6能增加这种抑制效率,此结果提示FRMD6可能在喉癌组织及Hep2细胞中拮抗miR-9-5p。

图2 miR-9-5p影响Hep2细胞增殖活力
A.miR-9-5p inhibitor瞬转Hep2细胞RT-PCR结果;B.miR-9-5p 抑制剂瞬转Hep2细胞FRMD6表达情况;C、D.MTT法与细胞克隆形成实验;E. caspase-3蛋白活性检测。与对照抑制剂比较,*P<0.05,**P<0.01,ΔP<0.05,#P<0.01。
3.miR-9-5p直接靶向调控FRMD6表达:如图3所示,在micoRNA数据库targetscan中预测得到1个可能与miR-9-5p结合的FRMD63′-UTR位点,同时设计了突变的结合位点作阴性对照(图3A)。在Hep2细胞中转染miR-9-5p阴性及阴性对照,RT-PCR结果显示与阴性对照比较,Hep2细胞中miR-9-5p过表达效果良好(图3B),Western blot法检测结果显示,过表达后FRMD6表达受抑制(图3C)。将前面构建的荧光素酶报告基因载体pcDNA3.1-luci/FRMD6 3′-UTR分别与阴性对照、miR-9-5p阴性共转染293T细胞,48h后收集细胞检测荧光素酶活性,结果显示与阴性对照比较,仅有miR-9-5p阴性与FRMD6 wt 3′-UTR有结合(图3D)。以上结果表明,FRMD6是miR-9-5p的靶基因,FRMD6表达受其直接调控。

图3 miR-9-5p直接靶向调控FRMD6表达
A.MiroRNA数据库搜索获得一个FRMD6 3′-UTR可能与miR-9-5p直接结合的位点;B、C.miR-9-5p阴性瞬转Hep2细胞RT-PCR及Western blot法检测结果;D.Luciferase双荧光素酶报告基因实验;与阴性对照比较,**P<0.005
4.miR-9-5p/FRMD6调控喉癌细胞增殖与Hippo信号通路:在miR-9-5p阴性/抑制剂Hep2细胞中检测YAP表达情况。过表达miR-9-5p后抑制FRMD6,且促进YAP的转录和翻译(图4A、B);而抑制miR-9-5p后FRMD6表达上调,同时YAP表达上调(图4C、D)。

图4 miR-9-5p/FRMD6调控喉癌细胞增殖与Hippo信号相关
A.Hep2细胞过表达miR-9-5p后RT-PCT及Western blot法检测;B.Hep2细胞抑制miR-9-5p后RT-PCT及Western blot法检测
讨 论
FRMD 6属于Hippo信号通路上游因子,一般通过磷酸化该通路的关键因子MST、LATS等激活Hippo信号,控制细胞增殖凋亡[13]。有研究发现过表达FRMD 6可抑制人乳腺癌细胞增殖,而敲除则诱导乳腺上皮肿瘤细胞获得侵袭迁移的能力,但关于FRMD6在喉癌发生、发展中的作用仍知之甚少[14]。研究表明,miRNA表达失调在各种肿瘤包括喉癌等头颈肿瘤的发生、发展、侵袭转移和血管生成中扮演了重要角色,提示miRNA可能作为喉癌的生物标志物或治疗靶标,在喉癌的早期诊断、治疗、预后等方面具有潜在的临床价值[16~18]。
然而,目前喉癌中的差异miRNA 对喉癌发生、发展的调控机制尚未完全阐明。本研究前期利用miRNA基因芯片技术对4例喉癌及癌旁组织进行表达分析,首次发现miR-9-5p在癌组织的表达高于癌旁组织。本研究通过RT-PCR对32例喉癌及癌旁组织中的miR-9-5p进行验证并检测FRMD6的表达情况,发现miR-9-5p在癌组织表达高于癌旁组织,而FRMD6则是显著低于癌旁组织(图1),提示miR-9-5p高表达及FRMD6受抑制可能与喉癌癌变过程相关。为了进一步研究miR-9-5p、FRMD6与喉癌的关系,本研究以喉癌Hep2细胞为模型,采用MTT、细胞克隆形成及caspase-3活性检测等体外细胞实验探讨miR-9-5p及FRMD6对喉癌Hep2细胞存活的影响,结果表明抑制miR-9-5p后FRMD6表达上调;此外抑制miR-9-5p或过表达FRMD6均可以抑制喉癌细胞Hep2细胞的增殖活力,增加细胞凋亡,同时抑制miR-9-5p并过表达FRMD6则加重增殖抑制效果及细胞凋亡率(图2),以上提示miR-9-5p在喉癌中可能发挥着类似癌基因的功能,与FRMD6的功能拮抗,且调节FRMD6的表达。为验证miR-9-5p作用Hep2细胞的分子机制是否通过靶向调控FRMD6基因,本研究利用生物信息学预测FRMD6基因3′-UTR具有miR-9-5p结合位点。本研究通过luciferase实验证明miR-9-5p能使FRMD6 3′-UTR荧光素酶的活性显著性降低,差异有统计学意义,表明miR-9-5p直接靶向FRMD6 3′-UTR调控基因表达(图3)。
Hippo信号通路是近年来新发现的一条在进化上具有保守功能的细胞信号转导通路。它在调控器官大小、组织稳态、肿瘤发生、发展中起着非常重要的作用。分子机制研究发现,该通路接受多种上游信号,如G蛋白偶联受体信号、机械压力信号等,通过其核心激酶链作用于下游效应蛋白YAP/TAZ进而调控基因转录,发挥各种生物学功能[18,19]。FRMD6一般可通过逐级磷酸化MST1/2等基因以活化Hippo通路,抑制下游效应基因YAP/TAZ表达从而控制细胞增殖凋亡。关于miR-9-5p靶向FRMD6调控喉癌细胞增殖凋亡与Hippo通路是否相关,本研究在miR-9-5p阴性/抑制剂 Hep2细胞中检测YAP表达情况,结果显示过表达miR-9-5p后抑制FRMD6,同时YAP的表达上调;而抑制miR-9-5p后FRMD6表达上调,同时抑制YAP表达(图4)。以上结果提示,miR-9-5p下调FRMD6促进喉癌细胞增殖可能通过抑制Hippo信号通路发挥作用。
综上所述,本研究证明miR-9-5p通过下调FRMD6表达促进人喉癌Hep2细胞的增殖存活,这个过程可能存在Hippo信号通路参与。以上结果为喉癌的生物学标志物或治疗靶标在喉癌的早期诊断、治疗、预后等方面提供潜在的临床价值。

