FOXP3和LAP蛋白在结直肠癌中的表达与临床意义
王文静 朱晓东 王经荣 蔡清强 蔡文聘 房太勇

【摘要】 目的:探讨FOXP3及LAP蛋白在结直肠癌中的表达与临床意义,为临床治疗结直肠癌提供实验理论基础。方法:收集2016年9月-2017年6月在福建医科大学附属第二医院诊治的健康体检者结直肠组织、患者结直肠腺瘤及结直肠癌组织,并对各组织进行H&E染色及病理诊断。运用Western-blot检测各组织中FOXP3及LAP蛋白的表达。分析各组FOXP3、LAP蛋白的表达水平,以及两种蛋白的表达与临床病理参数的关系。结果:(1)FOXP3及LAP蛋白在结直肠癌组的表达均高于结直肠腺瘤组及健康人组,差异有统计学意义(P<0.05)。(2)FOXP3及LAP蛋白的表达水平与腺瘤上皮内瘤变级别呈正相关,差异有统计学意义(P<0.05)。(3)FOXP3及LAP蛋白表达水平与淋巴结转移、癌细胞分化程度、肿瘤组织浸润深度、TNM分期呈正相关,差异有统计学意义(P<0.05)。结论:FOXP3、LAP蛋白可能参与了腺瘤向癌的进展过程及肿瘤的发生发展过程。
【关键词】 结直肠癌; 结直肠腺瘤; LAP; FOXP3
doi:10.14033/j.cnki.cfmr.2019.17.080 文献标识码 B 文章编号 1674-6805(2019)17-0-04
结直肠癌(colorectal cancer,CRC)是临床上较常见的恶性肿瘤之一,根据国家癌症中心发布的《2017年最新中国肿瘤现状和趋势》显示:CRC的发病率及死亡率均高居第五位。表明CRC对我国人民的健康产生了重大威胁。对结直肠癌发病机制研究的深入能够帮助大家更早、更多地筛查出结直肠癌,进而达到早诊早治、提高生存率的目标。目前关于FOXP3及LAP蛋白在CRC及CRA组织中的表达情况的研究较少,两种蛋白在CRC组织中的表达情况如何并未明确。因而本研究旨在检测CRC及结直肠腺瘤(colorectal adenomas,CRA)组织中FOXP3及LAP蛋白的表达情况,并分别观察两种蛋白与临床病理参数的关系,观察这两种蛋白对结直肠癌的发病进程的影响。
1 资料与方法
1.1 一般资料
本研究经医院伦理委员会审批后同意执行。选取2016年9月-2017年6月在福建医科大学附属第二医院诊治的研究对象的组织标本,每例样本均详细记录对应患者一般资料(包括姓名、性别、年龄、联系方式、家庭住址)、临床信息(包括现病史、既往史、个人史、临床诊断、诊断时间、手术时间、相关实验室检查结果及影像学检查结果等)、病理资料(包括病理号、详细病理学描述、病理诊断等)、肿块大小、浸润深度、有无淋巴结转移等。其中健康人组:共收集25例,其中男12例,女13例,平均年龄(44±10)岁。结直肠腺瘤组:共收集25例,其中男16例,女9例,平均年龄(56±10)岁。腺瘤部位:直肠腺瘤5例,结肠腺瘤20例;肿瘤大小:>1 cm 16例,≤1 cm 9例;上皮内瘤变:高级别11例,低级别14例。结直肠癌组:共收集33例,其中男19例,女14例,平均年龄(61±12)岁。直肠癌14例,结肠癌19例;肿瘤大小:>5 cm 11例,≤5 cm 22例;有淋巴结转移19例,无淋巴结转移14例;浸润深度:T1~T4分别为5、5、10、13例;分化程度:高分化5例,中分化20例,低分化8例;TNM分期:Ⅰ~Ⅳ期分别为:2、16、14、1例。
1.2 组织标本
组织离体后分成两部分,一部分组织迅速置入-196 ℃液氮速冻,后转送入-80 ℃冰箱保存备用;另一部分组织放入10%福尔马林固定,行常规H&E染色,由专业病理科医师进行病理诊断,对于癌组织参照AJCC/UICC的结直肠癌TNM分期系统、中国结直肠肿瘤筛查、早诊早治和综合预防共识意见,并结合术中所见对结直肠癌组织进行诊断、分级和分期。
1.3 实验方法
1.3.1 H&E染色 取组织标本、冲洗、去除表面残留粪便及血液,放入10%福尔马林中固定大于12 h;脱水→透明→包埋→切片→贴片→脱蜡→染色→脱水Ⅰ和复染→脱水Ⅱ和透明→封藏。
1.3.2 Western-blot 提取组织蛋白,并采用BCA试剂盒检测提取的蛋白浓度;测定后将剩余蛋白提取液进行SDS-PAGE电泳(90 V 30 min,下層分离胶120 V 60 min);采用PVDF膜进行转膜(100 V 60~90 min);使用5%脱脂奶粉封闭后依次与一抗(鼠抗人FOXP3单克隆抗体1∶500稀释;鼠抗人LAP单克隆抗体1∶2 000稀释)、二抗(羊抗鼠单克隆IgG抗体1∶5 000稀释)反应,在避光条件进行曝光、采图,以GAPDH作为内参进行标准对照,分析FOXP3和LAP蛋白表达水平。
1.4 统计学处理
所有数据采用SPSS 21.0统计软件进行处理,计量资料数据以(x±s)表示,三组间的比较采用单因素方差分析(One-way ANOVA),两组间的比较采用t检验,等级指标采用Spearman相关系数分析,P<0.05表示差异有统计学意义。
2 结果
2.1 健康体检者结直肠组织、结直肠腺瘤及结直肠癌组织H&E染色结果
各组织常规H&E染色病理图,见图1、图2,A正常黏膜组织:腺体排列规则,腺体未见拥挤融合,核未见异型。B结肠腺瘤:腺体呈管状,排列规则,未见背靠背现象,腺体未见融合,未见成角,未见间质浸润。细胞轻度异型,位于基底层,未见病理性核分裂。C结肠腺癌:腺体不规则,呈背靠背融合,可见成角及坏死,间质纤维化,浸润明显。细胞重度异型,可见病理性核分裂。
2.2 健康体检者结直肠组织、结直肠腺瘤及结直肠癌组织中FOXP3及LAP蛋白表达情况
运用Western Blot检测各组织中FOXP3及LAP蛋白的表达情况,见图3,采用单因素方差分析对三组间的FOXP3及LAP蛋白表达量进行分析,见表1。
2.3 结直肠腺瘤组织中FOXP3及LAP蛋白的表达与临床病理参数的关系分析
(1)采用独立t检验对FOXP3及LAP蛋白的表达与临床病理参数之间的关系进行分析,见表2。FOXP3及LAP蛋白的表达水平与腺瘤年龄、性别、腺瘤部位、大小相关性尚不确切,差异无统计学意义(P>0.05)。(2)采用Spearman相关系数对FOXP3及LAP蛋白的表达与临床病理参数(等级指标)之间的关系进行分析,见表3,FOXP3蛋白的表达水平与腺瘤上皮内瘤变级别呈正相关(rs=0.838),高级别上皮内瘤变组高于低级别上皮内瘤变组(0.854±0.331,0.495±0.203),差异有统计学意义(P<0.001)。LAP蛋白的表达水平与腺瘤上皮内瘤变级别呈正相关(rs=0.849),高级别上皮内瘤变表达水平高于低级别上皮内瘤变(1.136±0.161,0.949±0.687),差异有统计学意义(P<0.001)。
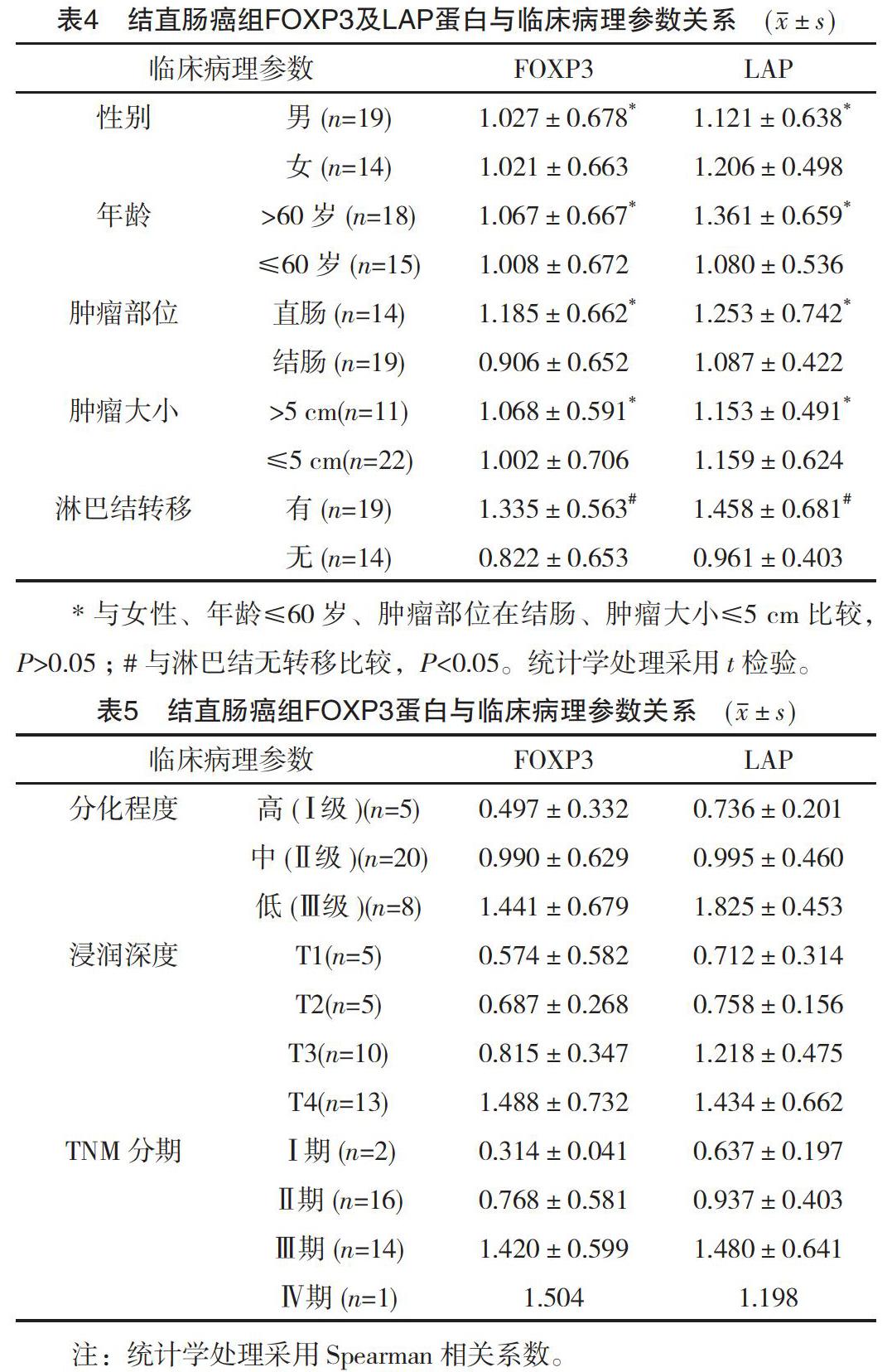
2.4 结直肠癌组织中FOXP3及LAP蛋白的表达与临床病理参数的关系分析
(1)采用独立t检验分析FOXP3及LAP蛋白的表达与临床病理参数的关系,见表4。(2)采用Spearman相关系数分析FOXP3及LAP蛋白的表达水平与等级指标的关系,见表5。FOXP3蛋白与癌细胞分化程度呈正相关(rs=0.464),分化程度越低,表达水平越高(依次为0.497±0.332、0.990±0.629、1.441±0.679),差异有统计学意义(P=0.007);与肿瘤组织浸润深度呈正相关(rs=0.588),浸润深度越深,表达水平越高(依次为0.574±0.582、0.687±0.268、0.815±0.347、1.488±0.732),差异有统计学意义(P<0.001);与TNM分期呈正相关(rs=0.464),分期越晚,表达水平越高(依次为0.314±0.041、0.768±0.581、1.420±0.599、1.504),差异有统计学意义(P<0.001)。LAP蛋白的表达水平与癌细胞分化程度呈正相关(rs=0.680),分化越低表达水平越高(依次为0.736±0.201、0.995±0.460、1.825±0.453),差异有统计学意义(P<0.001);与肿瘤组织浸润深度呈正相关(rs=0.543),浸润深度越深表达水平越高(依次为0.712±0.314、0.758±0.156、1.218±0.475、1.434±0.662),差异有统计学意义(P=0.001);与TNM分期呈正相关(rs=0.567),分期越晚表达水平越高(依次为0.637±0.197、0.937±0.403、1.480±0.641、1.198),差异有统计学意义(P=0.001)。
3 讨论
目前认为结直肠癌是由饮食结构、生活环境、生活方式及遗传等多方面因素相互协同作用的结果。而在发病机制研究方面,已有一些研究从不同角度探索,如突变细胞周期和失巢凋亡途径、血管生成、信号转导等均在CRC的发生和进展过程中起了重要作用[1-4]。本研究检测健康人、结直肠腺瘤、结直肠癌组织中FOXP3及LAP蛋白的表达,探讨两者可能参与了腺瘤向癌的进展过程及肿瘤的发生发展过程。
3.1 FOXP3及LAP蛋白与结直肠腺瘤
结直肠腺瘤是最常见的CRC癌前病变。70%~80%的结直肠癌是由结直肠腺瘤演变而来,这个过程需要10~15年的时间[5]。目前认为腺瘤癌变的高危因素可能与患者年龄、饮食习惯、腺瘤的病理类型、大小、有无蒂、不典型增生程度等因素有关。但从其分子机制水平来看,似乎尚未发现能够准确预估腺瘤癌变风险的生物学指标。Hua等[6]通过检测结直肠腺瘤肿瘤微环境中的FOXP3+Tregs表达情况,他们发现腺瘤肿瘤微环境中FOXP3+Tregs表达增高。本研究中观察到腺瘤组织中的FOXP3蛋白高于健康人,这与Hua等所提出的FOXP3+Tregs在腺瘤肿瘤微环境中的表达相类似。笔者推测FOXP3蛋白对于腺瘤的发生可能有促进作用。另一方面,笔者观察到LAP蛋白在腺瘤组织中的表达与FOXP3蛋白相似,这提示LAP蛋白可能与FOXP3蛋白一样对于腺瘤的发生有促进作用。
2000年《WHO肿瘤病理学及遗传学分类:消化系统肿瘤》将结直肠腺瘤定义为有上皮内瘤变(intraepithelial neoplasia,IN)存在的病變,并将IN分为低级别上皮内瘤变(LGIN)和高级别上皮内瘤变(HGIN),其中有研究表明,80%的HGIN可在1年内进展为浸润癌。笔者研究发现FOXP3蛋白及LAP蛋白表达水平与上皮内瘤变级别呈正相关,且差异有统计学意义,这提示FOXP3与LAP蛋白可能参与了结直肠腺瘤的癌变过程,但两种蛋白之间的关系如何,是否为协同作用,仍需待后续研究证实。
3.2 FOXP3及LAP蛋白与结直肠癌
3.2.1 FOXP3蛋白与结直肠癌 2001年,Hinz等[7]首次在胰腺导管腺癌细胞和肿瘤中检测FOXP3蛋白的表达,发现FOXP3阳性的胰腺癌细胞能够遏制活化T细胞的增殖、抑制TGF-β与IL-10的表达和分泌,进而介导了免疫抑制和肿瘤免疫逃逸。这些都揭示了FOXP3蛋白在肿瘤免疫微环境中可能发挥着抑制免疫活性的作用,从而参与免疫抑制及肿瘤的免疫逃逸。Karanikas等[8]运用免疫组化与流式细胞术检测FOXP3蛋白在25种不同组织来源的肿瘤细胞系的表达情况,证实了这25种肿瘤细胞系均有表达FOXP3蛋白。而在结直肠癌方面,Grimmig等[9-10]研究小组均发现,结肠癌细胞中FOXP3蛋白表达与患者的不良预后相关,即肿瘤恶性度越高,则FOXP3蛋白表达水平随之升高,患者预后越差。本实验中所观察到的结果与之一致:笔者发现结直肠癌中FOXP3蛋白表达高于健康人黏膜组织,推测FOXP3蛋白表达的上调可能在正常结直肠上皮发展为CRC的过程中起着一定的作用。
恶性肿瘤的预后与有无淋巴结转移、癌细胞分化程度、肿瘤组织浸润深度及TNM分期等因素密切相关。在本研究中FOXP3蛋白与上述临床病理参数间的关系:有淋巴结转移者FOXP3蛋白表达较无淋巴结转移者高,且差异有统计学意义(P<0.05)。在FOXP3蛋白与癌细胞分化程度、肿瘤组织浸润深度及TNM分期的关系分析中,笔者发现癌细胞分化程度越差、肿瘤组织浸润深度越深、TNM分期越晚,FOXP3蛋白表达水平越高,这些均提示FOXP3蛋白可能参与肿瘤的发展、侵袭及转移。
3.2.2 LAP蛋白与结直肠癌 LAP在CRC中的研究主要围绕LAP+CD4+T细胞:Zhong等[11]发现CRC肿瘤微环境中LAP+CD4+T细胞的表达量增多,可能是抑制机体产生有效的抗肿瘤免疫应答,最终导致肿瘤的免疫逃逸,使肿瘤进行性生长的因素之一。而LAP蛋白在肿瘤组织中是否表达及其作用机制研究较少,是否与同样作为Tregs表面标志物的FOXP3作用相同,目前仍未明确。在本实验中笔者通过Western blot检测到LAP蛋白在CRC组织中有表达,并观察到LAP蛋白在CRC组织中的表达高于健康人结肠组织,这与Kim等[12]所研究的FOXP3蛋白在肿瘤组织中富集相似,提示LAP蛋白可能与FOXP3蛋白一样发挥着促进肿瘤发生的作用。在进一步分析其表达与有无淋巴结转移、癌细胞分化程度、肿瘤组织浸润深度及TNM分期等因素之间的关系时,发现LAP蛋白的表达与FOXP3蛋白在肿瘤组织中的表达相类似:在有淋巴结转移者组织中表达高,且癌细胞分化程度越差、肿瘤组织浸润深度越深、TNM分期越晚,LAP蛋白表达水平越高,说明LAP蛋白可能参与肿瘤的发展、侵袭及转移。
综上所述,结果提示LAP蛋白与FOXP3蛋白在结直肠癌的发生发展中可能有共同作用,但这两种蛋白表达的意义、调控机制及其与结直肠癌发生、发展及患者预后的关系还有待进一步探索。
参考文献
[1] Yoo B H,Masson O,Li Y,et al.Anoikis of colon carcinoma cells triggered by β-catenin loss can be enhanced by tumor necrosis factor receptor 1 antagonists[J].Oncogene,2015,34(38):4939-4951.
[2] Honda T,Yamamoto I,Inagawa H.Angiogenesis-,metastasis- and signaling pathway-related factor dynamics in human colon cancer cells following interaction with monocytes[J].Anticancer Res,2013,33(7):2895-2900.
[3] Seo G S.The role of NF-kappaB in colon cancer[J].Korean J Gastroenterol,2011,57(1):3-7.
[4] Huang H Y,Zhang Z J,Cao C B,et al.The TLR4/NF-κB signaling pathway mediates the growth of colon cancer[J].Eur Rev Med Pharmacol Sci,2014,18(24):3834-3843.
[5] Snover D C.Update on the serrated pathway to colorectal carcinoma[J].Hum Pathol,2011,42(1):1-10.
[6] Hua W,Yuan A,Zheng W,et al.Accumulation of FoxP3+ T regulatory cells in the tumor microenvironment of human colorectal adenomas[J].Pathol Res Pract,2016,212(2):106-112.
[7] Hinz S,Pagerols-Raluy L,Oberg H H,et al.Foxp3 expression in pancreatic carcinoma cells as a novel mechanism of immune evasion in cancer[J].Cancer Res,2007,67(17):8344-8350.
[8] Karanikas V,Speletas M,Zamanakou M,et al.Foxp3 expression in human cancer cells[J].J Transl Med,2008,6:19.
[9] Grimmig T,Kim M,Germer C T,Gasser M,et al.The role of FOXP3 in disease progression in colorectal cancer patients[J].Oncoimmunology,2013,2(6):e24521.
[10] Ganapathi S K,Beggs A D,Hodgson SV,et al.Expression and DNA methylation of TNF,IFNG and FOXP3 in colorectal cancer and their prognostic significance[J].Br J Cancer,2014,111(8):1581-1589.
[11] Zhong W,Jiang Z Y,Zhong S B,et al.Phenotypic characteristics of LAP(+) CD4(+) T lymphocytes in colorectal cancer tissues[J].Zhonghua Zhong Liu Za Zhi,2016,38(8):596-601.
[12] Kim M,Grimmig T,Grimm M,et al.Expression of Foxp3 in colorectal cancer but not in Treg cells correlates with disease progression in patients with colorectal cancer[J].PLoS One,2013,8(1):e53630.
(收稿日期:2019-01-09) (本文編辑:何玉勤)

