南瓜籽甾醇对SD大鼠体内抗氧化作用的影响
张 宇,孙 波,赵 晓,马艺荧,郝 宇,解双瑜,李天一
(东北农业大学食品学院,哈尔滨 150030)
南瓜籽甾醇是南瓜籽中重要的生物活性物质,占南瓜籽油含量的0.3%左右[1]。近年来,植物甾醇因其具有抗炎、降胆固醇以及抗癌等生理功能而受到广泛关注[2-4],抗氧化性也是其研究的主要热点之一。植物甾醇的抗氧化作用主要是因为其侧链上存在亚乙基,具有不受阻的烯丙基氢原子,可以通过促进氢原子的释放,使所得自由基异构化为更为稳定的叔自由基,进而中断氧化反应[5]。
研究发现,包括癌症、糖尿病、心血管疾病等在内的人体各种疾病的发生都与其体内抗氧化体系失衡有关[6-8],即当机体处于氧化应激状态,过量的自由基会与脂质、蛋白质等生物大分子作用,改变其功能性,导致细胞膜结合受体以及相关酶的失活,损害细胞正常功能,造成细胞坏死、组织退化、衰老以及其他氧化应激相关疾病的发生[9-10]。而一些外源性抗氧化剂的摄入,有助于降低体内自由基水平,在一定程度上预防和修复自由基引起的氧化损伤,增强正常细胞对氧化应激的抵抗能力[11],进而对各种疾病起到预防的作用[12]。
体内抗氧化的常用评价指标有谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、丙二醛(MDA)等。其中GSH-Px和SOD是生物体内清除自由基的重要酶类,T-AOC是生物体整体抗氧化能力的评价指标,其活性及水平越高,表明机体抗氧化能力越强。MDA则是生物体内脂质过氧化损伤产物之一,其含量越低,机体抗氧化能力越强。8-羟基脱氧鸟苷(8-OHdG)是生物体内DNA受自由基攻击后的标志性氧化损伤产物[13],其含量越高表明机体氧化损伤程度越严重,且有研究发现8-OHdG与氧化应激相关的多种疾病的发生发展存在密切关系[14-15]。
因此,选择上述5个指标作为体内抗氧化评价指标研究南瓜籽甾醇对SD大鼠体内的抗氧化作用,进而对南瓜籽甾醇体内抗氧化能力进行综合评价。
1 材料与方法
1.1 实验材料
雄性SD大鼠(清洁级)40只,体重(150±10)g,由黑龙江省医学实验动物供应基地提供。南瓜籽,由黑龙江省双鸭山市宝清县提供。
总抗氧化能力(T-AOC)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒、8-羟基脱氧鸟苷(8-OHdG)试剂盒,均购于南京建成生物工程研究所。考马斯亮蓝G250,合肥博美生物技术有限责任公司;氢氧化钠,天津市大陆化学试剂厂;磷酸、正己烷,天津市富宇精细化工有限公司;冰醋酸,上海超聪化工有限公司;无水乙醇,天津市天利化学试剂有限公司。以上试剂均为分析纯。
CZR 309型榨油机,广州万彪通用设备有限公司;Tecan Infinite M200酶标仪,瑞士帝肯(TECAN)集团公司;Sigma 3-18K低温高速离心机,德国Sigma公司;HWS-24 电热恒温水浴锅,上海齐欣科学仪器有限公司;FA 2004型电子天平,上海横平仪器仪表厂;DPH-9162 电热恒温培养箱,上海齐欣科学仪器有限公司;XW-80A 旋涡混合器,上海弛唐电子有限公司。
1.2 实验方法
1.2.1 南瓜籽甾醇的提取
室温下利用CZR 309型榨油机榨取南瓜籽油,5 000 r/min离心10 min,取上层清油与1 mol/L的氢氧化钾-乙醇溶液以体积比1∶5混合,煮沸回流60 min后,减压蒸馏回收乙醇。余下的皂化液冷却至室温,利用等体积正己烷萃取2次,合并上层萃取液并用蒸馏水洗涤至中性,常温条件下减压蒸馏回收正己烷,得南瓜籽甾醇粗制品。
取一定量的南瓜籽甾醇粗制品,加入无水乙醇,在热水浴中回流至其完全溶解后,缓慢冷却至室温。在4℃条件下冷却结晶,过滤并干燥得到精制南瓜籽甾醇,用以进行体内抗氧化能力的研究。
1.2.2 实验动物分组及灌胃饲养方式
将40只SD大鼠随机分为4组,每组10只,分别为空白对照组、低剂量甾醇组、中剂量甾醇组和高剂量甾醇组。SD大鼠适应性饲养7 d后,以灌胃方式给药。根据FDA推荐的人体甾醇适宜摄入量[16],设置SD大鼠南瓜籽甾醇灌胃的低、中、高剂量分别为80、160 mg/(kg·d)和320 mg/(kg·d)。饲养期间,SD大鼠自由摄食和饮水。
1.2.3 SD大鼠体内生化指标的检测
在SD大鼠饲养灌胃期间,每7 d称量一次SD大鼠的体重,35 d后脱颈处死全部SD大鼠,摘取其眼球取全血,采血过程应注意清洁以避免红细胞溶血。将取出的全血于室温下平衡1~2 h后,4℃条件下8 000 r/min离心10 min,取上清液进行T-AOC水平、SOD活性、GSH-Px活性、MDA含量以及8-OHdG含量的测定。其中SOD活性的测定采用羟胺法检测,GSH-Px活性采用二硫代二硝基苯甲酸(DTNB)法检测,MDA含量采用硫代巴比妥酸(TBA)法检测,8-OHdG含量采用竞争法检测。
摘取SD大鼠的肝脏,用冷藏的生理盐水漂洗以除去肝脏表面血迹以及毛发等,用滤纸吸干表面水分。将肝脏与生理盐水以质量体积比1∶9的比例混合,置于匀浆器中,在冰水浴条件下匀浆。随后4℃条件下8 000 r/min离心10 min,分离上清液得SD大鼠肝脏组织匀浆,用以进行T-AOC水平、SOD活性、GSH-Px活性、MDA含量以及组织蛋白含量的测定。组织蛋白含量采用考马斯亮蓝法测定[17]。
1.2.4 统计分析
利用SPSS Statistics 21.0对数据进行统计分析,结果以“平均值±标准差”的形式表示,图表中字母表示差异性显著的分析结果。
2 结果与分析
2.1 南瓜籽甾醇对SD大鼠体重的影响(见表1)
由表1可知,随着喂养时间的延长,各组SD大鼠的体重均上升,灌胃饲养35 d后,4组SD大鼠体重增加量分别为172.2、173.9、172.9、183.7 g,各组体重之间差异不显著。同时在喂养期间,各组SD大鼠均活泼好动,摄食饮水正常,毛皮顺滑有光泽,可以初步表明喂食南瓜籽甾醇对SD大鼠的体重无不良影响。

表1 不同剂量南瓜籽甾醇对SD大鼠体重的影响
2.2 南瓜籽甾醇对SD大鼠血清和肝脏中T-AOC水平的影响(见表2)

表2 不同剂量南瓜籽甾醇对SD大鼠血清和肝脏中 T-AOC水平的影响
注:同列不同字母表示差异显著(p<0.05),下同。
由表2可知,与空白对照组相比,低、中、高剂量甾醇组SD大鼠的血清和肝脏中T-AOC水平均呈现不同程度的提高,并且在灌胃剂量范围内,这种提高具有一定的剂量依赖性。表明南瓜籽甾醇能够提高SD大鼠血清和肝脏中T-AOC水平。
2.3 南瓜籽甾醇对SD大鼠血清和肝脏中SOD活性的影响(见表3)
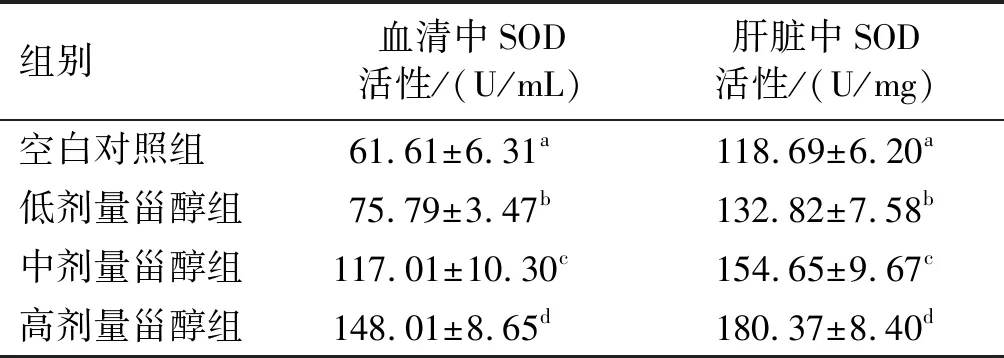
表3 不同剂量南瓜籽甾醇对SD大鼠血清 和肝脏中SOD活性的影响
由表3可知,与空白对照组相比,低、中、高剂量甾醇组的SD大鼠血清和肝脏中SOD活性显著升高(p<0.05)。这说明南瓜籽甾醇在一定剂量时能够提高SD大鼠血清和肝脏中的SOD活性,具有清除SD大鼠体内产生的氧自由基的作用。
2.4 南瓜籽甾醇对SD大鼠血清和肝脏中GSH-Px活性的影响(见表4)
由表4可知,与空白对照组相比,低、中、高剂量甾醇组SD大鼠血清和肝脏中GSH-Px活性显著升高(p<0.05),且在灌胃剂量范围内,这种作用呈现一定的剂量依赖性。表明南瓜籽甾醇具有增强SD大鼠体内GSH-Px活性,具有分解生成的过氧化物的作用。

表4 不同剂量南瓜籽甾醇对SD大鼠血清 和肝脏中GSH-Px活性的影响
2.5 南瓜籽甾醇对SD大鼠血清和肝脏中MDA含量的影响(见表5)

表5 不同剂量南瓜籽甾醇对SD大鼠血清 和肝脏中MDA含量的影响
由表5可知,与空白对照组相比,灌胃南瓜籽甾醇的实验组SD大鼠血清和肝脏中MDA含量均降低,且随着灌胃剂量的增加,降低幅度越显著。说明南瓜籽甾醇对SD大鼠体内的脂质过氧化反应具有一定的抑制作用,并且这种作用与南瓜籽甾醇剂量之间呈现正相关关系。
2.6 南瓜籽甾醇对大鼠血清中8-OHdG含量的影响(见表6)
组织中8-OHdG含量的测定需要DNA的提取及相关酶消化等步骤,这些过程很容易发生人工诱导氧化反应,导致最终测定结果偏高[18],因此在实验过程中仅选择SD大鼠血清作为实验对象。由表6可知,与空白对照组相比,灌胃南瓜籽甾醇的实验组SD大鼠血清中8-OHdG含量显著降低(p<0.05),说明南瓜籽甾醇可以在一定程度上抑制SD大鼠的DNA氧化损伤,且南瓜籽甾醇灌胃剂量越高,这种作用越显著。

表6 不同剂量南瓜籽甾醇对大鼠血清中 8-OHdG含量的影响
3 结 论
南瓜籽甾醇对SD大鼠体内抗氧化能力的增强具有一定的促进作用,并且这种作用在一定程度上存在剂量依赖性。这可能是因为南瓜籽甾醇可以通过直接与SD大鼠体内酶和非酶系统产生的自由基反应,或促进SD大鼠血清及肝脏中相关抗氧化酶的活性,进而与产生的自由基作用,避免其对生物膜中脂质、蛋白质以及核酸等生物大分子的攻击,抑制脂质过氧化物的生成,以达到抗氧化作用的目的。

